Laurinlactam
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Laurinlactam | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H23NO | |||||||||||||||
| Kurzbeschreibung | beiger bis farbloser kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 197,32 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 0,973 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 348 °C bei 1013 hPa[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Laurinlactam (im Englischen meist Laurolactam) ist ein makrocyclisches Lactam, das als Monomer für Polyamid 12 und als Comonomer für Copolyamide Verwendung findet.[5]
Herstellung
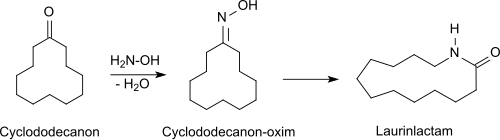
Das bei der Oxidation von Cyclododecan mit Luft oder Sauerstoff in Gegenwart von Borsäure und Übergangsmetallsalzen, z. B. Cobalt(II)-acetat anfallende, auch als Ol/On-Gemisch bezeichnete Cyclododecanol/Cyclododecanon-Gemisch[6] wird an einem Kupferkontakt quantitativ zu Cyclododecanon dehydriert und dieses mit Hydroxylamin zum Cyclododecanon-oxim umgesetzt. Das Oxim wird in einer Beckmann-Umlagerung in Gegenwart einer starken Säure zu Laurinlactam umgelagert.[7][8][9]
Ein alternativer Prozess unterwirft Cyclododecan einer Photonitrosierung mit Nitrosylchlorid[6] in Gegenwart von wasserfreiem Chlorwasserstoff.[10] Das entstehende Cyclododecanon-oxim wird mit konzentrierter Schwefelsäure extrahiert und durch Erhitzen auf 160 °C zu Laurolactam umgelagert. Die Gesamtausbeute (Photonitrosierung + Beckmann-Umlagerung) beträgt bis zu 93 % d.Th. Laurinlactam wird in Europa von Arkema und Evonik Industries sowie in Japan von einem Gemeinschaftsunternehmen der Ems-Grivory und der Ube Industries hergestellt.
Eigenschaften
Laurinlactam ist ein praktisch wasserunlöslicher, in technischer Qualität meist beige gefärbter und in reinem Zustand (Monomerqualität mit 99,9 % Reinheit) weißer kristalliner Feststoff, der in vielen organischen Lösungsmitteln, z. B. 1,4-Dioxan, Benzol, Cyclohexan, löslich ist. Die Reinigung erfolgt konventionell durch mehrstufige Destillation unter vermindertem Druck.[5] Die Kombination von Destillation und Kristallisation aus Lösung oder Schmelze liefert sehr reines Laurinlactam (>99 %).[11] Das von Laurinlactam ausgehende Gefahrenpotential wird als niedrig beurteilt.[4]
Verwendung
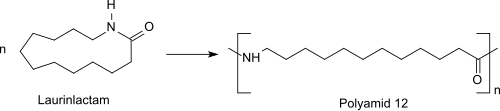
Die ringöffnende Polymerisation des Monomers Laurinlactam verläuft zunächst bei Zusatz von Wasser in einer Vorpolymerisation bei ca. 300 °C unter Druck zu einem Prepolymer, das in einer folgenden Polykondensationstufe bei normalem oder vermindertem Druck und Temperaturen von ca. 250 °C zu höhermolekularem Polyamid 12 (PA 12: -[NH-(CH2)11-CO]n-) reagiert.[12]
Als Comonomer findet Laurinlactam zusammen mit ε-Caprolactam Verwendung zur Herstellung von Copolyamid 6/12.[13]
Einzelnachweise
- ↑ a b c d Datenblatt 12-Amino-dodecansäurelactam bei Sigma-Aldrich, abgerufen am 1. Februar 2014 (PDF).
- ↑ a b Eintrag zu Laurinlactam in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2014. (JavaScript erforderlich)
- ↑ a b GPS Safety Report: Dodecane-12-lactam (Memento des vom 3. Februar 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b c d OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Dodecane-12-lactam, abgerufen am 4. November 2014.
- ↑ a b T. Schiffer, G. Oenbrink: Cyclododecanol, Cyclododecanone, and Laurolactam. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2002, doi:10.1002/14356007.a08_201.
- ↑ a b H.-J. Arpe: Industrielle Organische Chemie. 6., vollst. überarb. Auflage. Wiley-VCH Verlag, Weinheim, 2007, ISBN 978-3-527-31540-6.
- ↑ Douglass F. Taber, Patrick J. Straney: The Synthesis of Laurolactam from Cyclododecanone via a Beckmann Rearrangement. In: Journal of Chemical Education. Band 87, Nr. 12, Dezember 2010, S. 1392–1392, doi:10.1021/ed100599q (PDF).
- ↑ Patent US8309714: Process for producing laurolactam.. Veröffentlicht am 13. November 2012, Anmelder: Ube Industries, Ltd., Erfinder: J. Kugimoto et al..
- ↑ Y. Furuya u. a.: Cyanuric Chloride as a Mild and Active Beckmann Rearrangement Catalyst. In: J.Am.Chem.Soc. 127, Nr. 32, 2005, S. 11240–11241, doi:10.1021/ja053441x
- ↑ Patent US6197999: Photonitrosation of cyclododecane in chloroform in quasi-anhydrous medium.. Veröffentlicht am 6. März 2001, Anmelder: Atofina, Erfinder: J. Ollivier, D. Drutel.
- ↑ Patent US8399658: Method for isolation of laurolactam from a laurolactam synthesis process stream. Veröffentlicht am 19. März 2013, Anmelder: Evonik Degussa GmbH, Erfinder: A. Hengstermann et al..
- ↑ Patent US5362448: Continuous polymerization method of laurolactam and apparatus therefor. Veröffentlicht am 8. November 1994, Anmelder: Ube Industries, Ltd., Erfinder: A. Kawakami et al..
- ↑ Patent DE3730504: Copolyamides containing caprolactam and laurolactam, process for the preparation thereof and use thereof for heat-sealing textiles. Veröffentlicht am 16. März 1989, Anmelder: Atochem Werke GmbH, Erfinder: E. De Jong et al..
Auf dieser Seite verwendete Medien
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Synthese von Laurinlactam aus Cyclododecanon
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
PA12 durch ringöffnende Polymerisation von Laurinlactam


