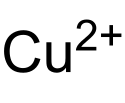Kupferhexafluorosilicat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
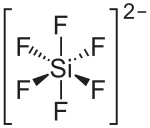 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kupferhexafluorosilicat | |||||||||||||||
| Summenformel | Cu[SiF6] | |||||||||||||||
| Kurzbeschreibung | blassblauer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 205,62 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Kupferhexafluorosilicat ist eine anorganische chemische Verbindung des Kupfers aus der Gruppe der Hexafluorosilicate.
Gewinnung und Darstellung
Kupferhexafluorosilicat kann durch Reaktion von Hexafluorokieselsäure mit Kupfer(II)-oxid gewonnen werden.[4]
Eigenschaften
Kupferhexafluorosilicat ist als Hexahydrat ein blassblaues, kristallines Pulver, das an Luft verwittert und an feuchter Luft zerfließt. Es besitzt eine trigonale Kristallstruktur mit der Raumgruppe R3 (Raumgruppen-Nr. 148) und zersetzt sich in Schwefelsäure und Natriumhydroxid. Das Tetrahydrat hat eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[1][5] Die Verbindung zersetzt sich bei Erhitzung.[6]
Verwendung
Kupferhexafluorosilicat wurden früher als Holzschutzmittel verwendet.[7][8] So wird es als Bestandteil von sogenannten CKF- und CKFZ-Salzen (Holzschutzmittel-Wirkstoffe, die neben den Chrom- oder Kupfersalzen zusätzlich Fluorverbindungen wie eben zum Beispiel Kupferhexafluorosilicat oder Zinkhexafluorosilicat enthalten) eingesetzt.[9] Kupferhexafluorosilicat dient auch als Härter für weißen Marmor.[6]
Einzelnachweise
- ↑ a b c d e f R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 440 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2016, ISBN 978-1-4398-8050-0, S. 62 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg: Industrielle Anorganische Chemie. John Wiley & Sons, 2013, ISBN 978-3-527-33019-5, S. 114 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ M. J. R. Clark, J. E. Fleming, H. Lynton: Crystal and molecular structure of CuSiF6•4H2O. In: Canadian Journal of Chemistry. 47, 1969, S. 3859, doi:10.1139/v69-642.
- ↑ a b Michael D. Larrañaga, Richard J. Lewis, Sr., Robert A. Lewis: Hawley's Condensed Chemical Dictionary. John Wiley & Sons, 2016, ISBN 978-1-118-13515-0, S. 371 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ spektrum.de: Fluorosilicate - Lexikon der Chemie - Spektrum der Wissenschaft, abgerufen am 24. November 2016
- ↑ Konrad Zilch, Claus Jürgen Diederichs, Rolf Katzenbach, Klaus J. Beckmann: Handbuch für Bauingenieure Technik, Organisation und Wirtschaftlichkeit. Springer-Verlag, 2013, ISBN 978-3-642-14450-9, S. 198 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ schadstoffberatung.de: Holzschutz, abgerufen am 23. November 2016.
Auf dieser Seite verwendete Medien
Struktur des Cu2+-Ions
Struktur des Hexafluorosilicat-Ions