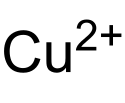Kupfer(II)-tetrafluoroborat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kupfer(II)-tetrafluoroborat | |||||||||||||||
| Summenformel | Cu[BF4]2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 237,16 g·mol−1 (wasserfrei) | |||||||||||||||
| Aggregatzustand | fest (Hydrat)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Kupfer(II)-tetrafluoroborat ist eine anorganische Verbindung. Es handelt sich um ein Salz des Kupfers in der Oxidationsstufe +II mit der Tetrafluorborsäure.
Darstellung
Kupfer(II)-tetrafluoroborat lässt sich durch die Umsetzung von Kupfer(II)-oxid, -carbonat oder -hydroxid mit wässriger Tetrafluorborsäure darstellen.[2]
Eigenschaften
Kupfer(II)-tetrafluoroborat kristallisiert mit einer unbestimmten Zahl an Kristallwasser-Molekülen. Es zersetzt sich an feuchter Luft oder in Gegenwart von Wasser.[1]
Verwendung
Das Tetrafluoroboratanion zählt zu den schwach koordinierendes Anionen, weshalb es leicht durch andere Liganden ausgetauscht werden kann. Aus diesem Grund kann Kupfer(II)-tetrafluoroborat zur Synthese von Kupferkomplexen eingesetzt werden.
Einzelnachweise
- ↑ a b c d Datenblatt Copper(II) tetrafluoroborate hydrate bei Sigma-Aldrich, abgerufen am 4. Februar 2019 (PDF).
- ↑ Eintrag zu Fluoridoborate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Dezember 2014.
Auf dieser Seite verwendete Medien
Struktur des Cu2+-Ions
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Die Zahl 2
Struktur von Tetrafluoroborat-Ion