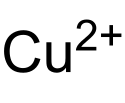Kupfer(II)-azid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||
| Name | Kupfer(II)-azid | |||||||||
| Andere Namen | Kupferazid | |||||||||
| Summenformel | Cu(N3)2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 147,59 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Dichte | 2,60 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | praktisch unlöslich in Wasser (80 mg·l−1 bei 20 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Kupferazid ist das Kupfersalz der Stickstoffwasserstoffsäure. Es ist explosionsgefährlich und findet wegen der hohen Empfindlichkeit gegenüber Reibung und Druck keine Anwendung.[3][4]
Herstellung und Modifikationen

Gemäß Urbanski sind vier Modifikationen bekannt: Die wasserfreie Verbindung ist braun mit rötlichem Schein. Die grüne Modifikation entsteht bei Einwirkung von Stickstoffwasserstoffsäure auf Kupfer(II)-hydroxid oder auf Kupfer(II)-oxid. Manchmal hat es eine eher graue Farbe. Erwärmung in Wasser führt zur Hydrolyse unter Entstehung basischen Kupferazids von gelber Farbe.
Braun-gelbe Modifikation
Durch Reaktion von Kupfersulfat-Trihydrat mit Natriumazid oder Lithiumazid[5]
oder durch Einwirkung einer verdünnten Stickstoffwasserstoffsäure auf metallisches Kupfer entsteht nach Theodor Curtius wasserfreies Kupfer(II)-azid in Form braun-gelber, in Wasser schwerlöslicher Kristalle.[6]
Grüne Modifikation
Es bildet sich durch Einwirkung von Stickstoffwasserstoffsäure auf Kupferhydroxid oder (Straumanis und Cirulis) auf Kupfer(II)-oxid. Manchmal hat es eine mehr graue Farbe.
Gelbe Modifikation
Erwärmen in Wasser (Wöhler und Krupko, 1913) führt zur Hydrolyse unter Entstehung basischen Kupferazids. Sehr lange Erwärmung verursacht nach Straumanis und Cirulis die vollkommene Hydrolyse, wobei Kupferoxid und freie Säuren frei werden.
Stoffdaten
- Detonationsgeschwindigkeit: 5000–5500 m·s−1 [7]
- Verpuffungspunkt: 202–205 °C
- Verbrennungsenthalpie: 67,23 kcal·g−1
- Schlagempfindlichkeit: 2,66 kpm·cm−2
- Aktivierungsenergie: 26,5 kcal·mol−1
Komplexsalze
Die Komplexsalze des Kupferazids sind ebenfalls explosiv. So ist das Salz Cu(NH3)4 (N3)2 bedeutend weniger schlagempfindlich (1 kg aus einer Höhe von 20 cm). Ausnahmsweise starke Initiiereigenschaften hat das komplexe Lithiumhexaazidocuprat(II) Li4[Cu(N3)6].
Verwendung
Kupferazid gehört zu den Initialsprengstoffen. Die grüne Modifikation ist die empfindlichste. Sie explodiert oft bereits bei Berührung. Unter dem 2-kg-Fallhammer explodiert sie bei einer Fallhöhe von unter 1 cm. Die schwarze/braune Modifikation bei 1 cm und die gelbe mit einem 1-kg-Fallhammer von 7 bis 8 cm. Bemerkenswert ist die hohe Initiierfähigkeit für Nitropenta, wobei nur 0,4 mg Kupferazid ausreichen, um das Nitropenta zur Detonation zu bringen.
Kupferazid hat große Bedeutung für die Praxis, da es neben Kupfer(I)-azid bei längerer Einwirkung von Bleiazid auf Kupfer oder dessen Legierungen entstehen kann. Dies führte wegen in Munitionshülsen vorhandenen Kupfers historisch zu ungewollten Zündungen. Heute wird diese Gefahr durch die Verwendung von Aluminium in der Munitionsherstellung mit Bleiazid vermieden.[8]
Schwermetallazide werden als Oxidationsmittel im Labor verwendet.
Kupferazid besitzt keine glatte Oberfläche, sondern bildet Rillen mit einer Breite von 5 nm (in 110-Richtung) aus. Diese Eigenschaft lässt sich nutzen, um Nanodrähte aus Eisen, Palladium oder Gold durch Bedampfung herzustellen.[9]
Sicherheitshinweise
Kupfer(II)-azid ist sehr empfindlich und explodiert schon bei geringem Druck oder Reibung. Da es sicherere Initialsprengstoffe gibt, sollte es weder hergestellt noch verwendet werden.
Einzelnachweise und Anmerkungen
- ↑ a b c D. L. Perry (Hrsg.), S. L. Phillips (Hrsg.): Handbook of Inorganic Compounds, 1995, ISBN 978-0-8493-8671-8.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Ph. Naoum, Phokion P. Naoúm, Theodor Steinkopff: Schiess- und Sprengstoffe, 1927 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J. F. Finklea: Current Intelligence Bulletin 13 Explosive Azide Hazard, aus: Current Intelligence Bulletin 13, NIOSH, U.S. Department of Health and Human Services, Cincinnati, Ohio, 5 pages, 3 references, 1976.
- ↑ Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band 1. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 985.
- ↑ Th. Curtius, J. Rissom: Neue Untersuchungen über den Stickstoffwasserstoff N3H. In: Journal für Praktische Chemie. 1898, 58, 1, S. 261–309, doi:10.1002/prac.18980580113.
- ↑ Wojciech Pawlowski Andrzej Radomski Sprengstoffinformation der polnischen Polizei, Seite 21/22 Cu(N3)2 Explosionsgeschwindigkeit und weitere Werte (poln. eingesehen am 8. September 2009).
- ↑ Thomas Enke: Grundlagen der Waffen- und Munitionstechnik, 2., aktualisierte Auflage. Walhalla Fachverlag, Regensburg 2021, doi:10.5771/9783802947780, S. 91f.
- ↑ X.-D. Ma, D. I. Bazhanov, O. Fruchart, F. Yildiz, T. Yokoyama, M. Przybylski, V. S. Stepanyuk, W. Hergert, J. Kirschner: Strain Relief Guided Growth of Atomic Nanowires in a Cu3bN-Cu(110) Molecular Network. In: Physical Review Letters. Band 102, Nr. 20, 2009, S. 205503, doi:10.1103/PhysRevLett.102.205503 (archives-ouvertes.fr [PDF]).
Literatur
- T. Urbanski: Chemie und Technologie der Explosivstoffe. Band 3. Deutscher Verlag für Grundstoffindustrie, 1964.
Auf dieser Seite verwendete Medien
Die Zahl 2
Struktur des Azid-Ions
Struktur des Cu2+-Ions
Kupferazid, braune Modifikation