Krankheitsbilder des Rückenmarks

Die Krankheitsbilder des Rückenmarks bilden eine große Gruppe neurologischer Erkrankungen, die auf Schädigungen des Rückenmarks (lateinisch Medulla spinalis) beruhen. Nach ihren charakteristischen Symptomen können sie in verschiedene Rückenmarksyndrome (auch: spinale Syndrome) unterteilt werden. Durch äußere Einwirkung hervorgerufene Rückenmarksverletzungen (auch: Rückenmarksläsionen) führen zu spinalen Traumata. Daneben können Rückenmarksyndrome auch nicht-traumatische Ursachen haben, insbesondere neurodegenerative Erkrankungen, entzündliche Prozesse, Durchblutungsstörungen, Tumore oder Bandscheibenvorfälle.[1]
Je nach Lage und Ausmaß der Läsion zeigen sich charakteristische Krankheitsbilder: Rückenmarksläsionen, die sich auf einer bestimmten Höhe in der Transversalebene ausdehnen, führen zu den Querschnittsyndromen, die weiter nach Läsionshöhe differenziert werden und jeweils vollständig oder unvollständig ausgeprägt sein können.[2] Eine andere Gruppe von Syndromen geht auf Läsionen der spinalen Leitungsbahnen und Ganglienzellsäulen in Längsrichtung des Rückenmarks zurück.[3] Liegt der Läsion eine Durchblutungsstörung des Rückenmarks zu Grunde, zeigen sich Rückenmarksinfarktsyndrome, die über das Versorgungsgebiet der betroffenen Arterien definiert werden.[4] Lädierte Nervenwurzeln führen zu den Wurzelsyndromen.[5] Wird das Rückenmark über einen längeren Zeitraum zunehmend von außen – etwa von einem wachsenden Tumor – gequetscht, kommt es zu den extramedullären Kompressionssyndromen, die von einer typischen Abfolge bestimmter Symptome gekennzeichnet sind, welche auf die topologische Anordnung der Nervenfasern innerhalb der Rückenmarkbahnen zurückgehen.[6]
Einführung
Anatomische Grundlagen

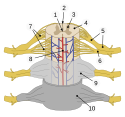
Das Rückenmark ist jener Teil des zentralen Nervensystems, der sich im Wirbelkanal befindet. Entlang seiner Längsachse verlaufen somatische und vegetative Nervenbahnen, die das periphere Nervensystem mit dem Gehirn verbinden; außerdem enthält es Reflexzentren zahlreicher Reflexbögen, sowohl für Eigen- als auch Fremdreflexe. Die vom Rückenmark abgehenden Nervenfasern vereinigen sich segmentweise auf jeder Seite erst zu sensiblen Hinter- und motorischen Vorderhornwurzeln, um dann gemeinsam als Spinalnerven den Wirbelkanal durch die Zwischenwirbellöcher zu verlassen. Hautflächen, die vom gleichen Spinalnerv versorgt werden, bilden sensible Dermatome, Muskeln entsprechend motorische Myotome.
Betrachtet man das Rückenmark in der Transversalebene, zeigt sich die graue Substanz als charakteristische Schmetterlingsfigur, welche die Zellkörper der Nervenzellen enthält. Über die von ihnen abgehenden Axone werden Signale weitergeleitet. Letztere bilden in der umgebenden weißen Substanz auf- und absteigende Bahnen, wobei sich anhand ihrer Lage beidseits je ein Vorder-, Seiten- und Hinterstrang abgrenzen lässt (Funiculus anterior, lateralis und posterior). Diese Stränge umfassen jeweils mehrere Bündel (Tractus), die weiter nach ihrer Funktion differenziert werden.
Zum Nervengewebe gehören neben den Nervenzellen selbst auch die Gliazellen. Letztere bilden ein stützendes Gerüst um die Nervenzellen sowie eine isolierende Myelinscheide um ihre Axone, versorgen sie als nachgeschalteter Teil der Blut-Hirn-Schranke mit Nährstoffen und beteiligen sich an der Immunabwehr. Selbst nicht elektrophysiologisch erregbar, können sie durch Ausschüttung einiger Neurotransmitter die neuronale Signalweiterleitung beeinflussen.[7]
Terminologie
Als motorisches Niveau bzw. sensibles Niveau (auch motorische bzw. sensible Höhe) wird das jeweils letzte intakte Segment bezeichnet, wobei sich linke und rechte Körperhälfte unterscheiden können. Das kopfnähste Segment mit beidseitig normalen Funktionen heißt neurologisches Niveau.[8] Um die Körperhälfte, auf der ein Symptom auftritt, relativ zu jener zu benennen, auf welcher sich die Rückenmarksläsion befindet, werden die anatomischen Bezeichnungen ipsilateral (auf der gleichen Seite) und kontralateral (auf der gegenüberliegenden Seite) verwandt.[9]
Systematik
Syndrome definieren sich zunächst über die charakteristische Gruppierung bestimmter Symptome. Möglich sind weitere Unterteilungen nach Ursachen, Ausmaß der zugrundeliegenden Verletzung und Schwere der neurologischen Ausfälle. Hier werden zunächst die verschiedenen Krankheitsbilder anhand der zugrundeliegenden Rückenmarksläsionen unterschieden, ihre typischen Ursachen benannt und die daraus folgenden Symptome beschrieben. Ansätze zur klinischen Klassifikation mit Schweregraden folgen in einem eigenen Abschnitt.
Querschnittsyndrome
Betrifft die Läsion nur ein oder wenige Rückenmarkssegmente, treten die Querschnittsyndrome auf, je nach Ausdehnung der Läsion in Transversalebene in kompletter oder inkompletter Ausprägung. Grundsätzlich bewirkt die Störung auf- und absteigender Bahnen in der weißen Substanz neurologische Ausfälle unterhalb der Läsionshöhe, hinzu kommen die Folgen der segmentalen Schädigung grauer Substanz.
Komplette Querschnittsyndrome
Ein kompletter Querschnitt liegt vor, wenn sämtliche Leitungsbahnen in Längsrichtung funktionell unterbrochen und die spinalen Kerngebiete auf Läsionshöhe zerstört sind. Bei abrupter Schädigung tritt der vorübergehende Zustand des spinalen Schocks auf, bei dem Ausfälle nicht nur polysynaptische Leitungsbahnen betreffen, sondern auch die Eigenreflexe unterhalb der Läsion aussetzen, obwohl deren Reflexbögen nicht über das lädierte Segment führen. Unterhalb der Läsionshöhe führt der Verlust motorischer Efferenzen zu schlaffen Lähmungen, von der auch Harnblase und Mastdarm betroffen sind; der Verlust sensibler Afferenzen führt zur Gefühlstaubheit. Werden die Sympathikusbahnen zwischen Th1 und L2 unterbrochen, so fallen Herzfrequenz und Blutdruck ab (Bradykardie und Hypotonie), wodurch es zum lebensbedrohlichen kardiovaskulären Schock kommen kann.[10]
Die Reflexe unterhalb der Läsionshöhe – sofern nicht tiefer als L1 – kehren nach wenigen Tagen nicht nur zurück, sondern werden in den folgenden Wochen zunehmend übersteigert (Hyperreflexie), was auf die Ausbildung neuer Dendriten und Synapsen zurückgeführt wird. Aus den schlaffen Lähmungen werden spastische, mit erhöhtem Tonus und gesteigerten Eigenreflexen bis hin zu klonischen Krämpfen, auch das Babinski-Zeichen tritt auf. Auf Läsionshöhe selbst bleibt die Lähmung jedoch schlaff, da hier nicht nur die Leitungsbahnen, sondern auch die Zellkörper im Vorderhorn zerstört sind, was einen Muskelschwund nach sich zieht. Liegt die Läsion oberhalb L1, so entwickelt sich eine neurogene Blase. Der Gefühlsverlust unterhalb der Läsionshöhe bleibt bestehen, auf Läsionshöhe selbst kann sich aber eine auf das Dermatom begrenzte Schmerzüberempfindlichkeit entwickeln. Die Unterbrechung der Sympathikusbahnen bewirkt trophische Gewebeveränderungen der Haut, die sie zusätzlich anfälliger für Dekubitus machen.[10]
Symptome und Prognose hängen wesentlich von der Läsionshöhe ab. Halsmarksläsionen führen zur Tetraplegie bzw. Tetraparese, da hier alle vier Gliedmaße ganz oder teilweise gelähmt sind; tieferliegende Läsionen führen zur Paraplegie bzw. Paraparese. Unmittelbar lebensbedrohlich sind hohe Halsmarkläsionen (oberhalb C5), da die Lähmungen hier wesentliche Teile der Atemmuskulatur betreffen, insbesondere das Zwerchfell. Überlebende Patienten bleiben dauerhaft beatmungspflichtig. Auch Läsionen des unteren Hals- oder oberen Brustmarks (C5–Th6) können noch Atemprobleme aufgrund von Paresen der Zwischenrippenmuskulatur verursachen. Die folgende Tabelle gibt einen Überblick über typische Syndrome bei vollständigem Querschnitt.[10]
| Syndrom | Betroffene Systeme | Symptome | Typische Ursachen |
|---|---|---|---|
| Zervikaler Querschnitt | Leitungsbahnen und Kerngebiete in Höhe C1–C8 | spastische Tetraplegie, Lähmung der Zwischenrippenmuskulatur, Muskelatrophie auf Läsionshöhe, keine Sensibilität unterhalb Läsionshöhe, Reflexinkontinenz; bei Läsion oberhalb C4 auch Atemlähmung. | Trauma, transverse Myelitis, Hämatom, Tumor, Myelomalazie, Strahlenmyelopathie. |
| Thorakaler Querschnitt | Leitungsbahnen und Kerngebiete in Höhe Th1–Th2 | spastische Paraplegie, Muskelatrophie auf Läsionshöhe, keine Sensibilität unterhalb Läsionshöhe, Reflexinkontinenz; bei Läsion oberhalb Th6 Ateminsuffizienz. | Trauma, transverse Myelitis, Hämatom, Tumor, Myelomalazie. |
| Lumbaler Querschnitt | Leitungsbahnen und Kerngebiete in Höhe L1–L4 | i. d. R. schlaffe Paraplegie, keine Sensibilität unterhalb Läsionshöhe, Überlaufinkontinenz | Trauma, transverse Myelitis, Hämatom, Tumor, Myelomalazie im Versorgungsgebiet der A. radicularis magna. |
| Epikonus-Syndrom | Leitungsbahnen und Kerngebiete in Höhe L4–S2 | schlaffe Paraplegie bei erhaltener Fähigkeit zu Hüftbeugung, Hüftadduktion und Kniestreckung; Patellarsehnenreflex (PSR) ist erhalten, Achillessehnenreflex (ASR) und Tibialis-posterior-Reflex (TPR) fehlen; keine Sensibilität unterhalb L4 oder tiefer; Reflex- oder Überlaufinkontinenz, aber erhaltener Analreflex. | Trauma, Hämatom, Tumor. |
| Konus-Syndrom | Conus medullaris (unterhalb S2) | Reithosenanästhesie bei erhaltener Bein- und Fußmotorik; Überlaufinkontinenz und erloschener Analreflex. | Trauma, Tumor, Bandscheibenvorfall. |
| Cauda-equina-Syndrom | kaudale Wurzeln (L4 oder tiefer) | schlaffe Lähmungen unterhalb L4 oder tiefer bei erhaltener Hüftfunktion und Kniestreckung; PSR erhalten, ASR, TPR und Analreflex fehlen; keine Sensibilität unterhalb L4 oder tiefer incl. Reithosenanästhesie; Überlaufinkontinenz. | Tumor (Ependymom, Lipom), Bandscheibenvorfall, Trauma. |
Bei kompletten Querschnitten ist in den Segmenten S4/S5 keinerlei motorische oder sensorische Restfunktion mehr erhalten. Falls dagegen noch eine solche Restfunktion erhalten sein sollte (sog. sakrale Aussparung, sacral sparing), handelt es sich um einen inkompletten Querschnitt.[12]
Inkomplette Querschnittsyndrome

Bleibt das geschädigte Rückenmarksegment zum Teil funktionsfähig, kommt es zu inkompletten (oder auch partiellen) Querschnittsyndromen. Sie treten vor allem infolge gestörter Blutversorgung oder Tumorbildung innerhalb des Rückenmarks auf. Weitere mögliche Ursachen sind Kompressionen von außen (durch äußere Tumore, Hämatome oder Abszesse), Entmarkungskrankheiten wie multiple Sklerose, Rückenmarksentzündungen oder deutlich abgegrenzte Verletzungen, etwa nach Stichverletzungen.[13]
Das klassische Beispiel eines inkompletten Querschnitts ist das Brown-Séquard-Syndrom (BSS), das bei einseitiger Schädigung des Rückenmarks auftritt. Obgleich in seiner reinen Form selten, hat seine Erforschung wesentlich zur Aufklärung der Rückenmarksanatomie und -physiologie beigetragen. Leitsymptome sind einseitige Lähmung sowie – auf der nicht gelähmten Seite – eine dissoziierte Sensibilitätsstörung, bei der die protopathische Sensibilität (Schmerz- und Temperaturempfinden) gestört ist, während epikritische Sensibilität (Berührungsempfinden) sowie Tiefensensibilität erhalten bleiben. Bei den Quadrantensyndromen ist nur der vordere oder hintere Teil einer Rückenmarkshälfte geschädigt. Häufiger als eine dieser Reinformen sind atypische inkomplette Querschnitte, bei denen sich die Läsion weder auf einzelne Quadranten beschränkt noch symmetrisch ist. Sie treten vor allem bei Myelomalazien und Entmarkungsprozessen auf, aber auch bei Tumoren, Entzündungen oder als Residualzustand nach einer Querschnittsverletzung. Sie klinisch von Degenerationsprozessen der langen Leitungsbahnen zu unterscheiden kann schwierig sein. Kriterien zur Abgrenzung sind:[13]
- eine asymmetrische Betroffenheit von Bahnen, da Syndrome der langen Leitungsbahnen meist symmetrisch sind,
- die Existenz eines sensiblen Niveaus, oberhalb dessen keine sensiblen Ausfallerscheinungen auftreten,
- die Begrenzung atrophischer Paresen auf ein oder zwei Segmente auf Höhe des neurologischen Niveaus.
Verletzungen der vorderen zwei Drittel des Rückenmarks führen zum vorderen Rückenmarksyndrom (auch: Anterior-Cord-Syndrom, ACS) mit motorischen Ausfällen und gestörter protopathischer Sensibilität, ggf. auch Blasenstörung.[12] Typisch ist eine schlaffe Paraparese der Arme und eine zunächst schlaffe, später spastische Paraparese der Beine. Da die Hinterstränge unversehrt sind, ist die epikritische Sensibilität nicht beeinträchtigt.[14]
Als häufigstes der inkompletten Querschnittsyndrome gilt das zentromedulläre Syndrom (auch: Central-Cord-Syndrom, CCS).[15] Insbesondere unter den Syndromen des Halsmarks spielt es eine herausragende Rolle.[16] Hierbei sind vor allem die innenliegenden Bereiche des Rückenmarks um den Zentralkanal herum geschädigt. Die Ausdehnung der Läsion kann sowohl in der Transversalebene als auch entlang der Längsachse beträchtlich variieren. Abhängig davon sind die Vorder-, Seiten- und Hinterhörner der grauen Substanz betroffen, in der weißen Substanz ferner die Pyramidenbahnen, die sympathischen Seitenstrangbahnen, die in der vorderen Kommissur kreuzenden spinothalamischen Fasern sowie die Vorderseitenstrangbahnen. Demgegenüber sind die Hinterstränge üblicherweise nicht betroffen.[17] Charakteristisch für das CCS ist, dass die Motorik der Hände und Arme deutlich stärker beeinträchtigt ist als jene der Beine.[12] Die Läsion der Zellkörper in den Vorderhörnern führt zu einer peripheren, schlaffen Lähmung mit Muskelschwund auf Höhe des geschädigten Segments, die Beeinträchtigung der absteigenden Bahnen im Pyramidenseitenstrang bewirkt eine zentrale, spastische Lähmung unterhalb der Läsionshöhe. Infolge der Unterbrechung der sensiblen Bahnen in der vorderen Kommissur und in den Vorderseitensträngen – nicht jedoch in den Hintersträngen – tritt beidseitig eine dissoziierte Sensibilitätsstörung auf.[14][18] Ätiologisch lassen sich zwei typische CSS-Patientengruppen benennen:[19][20]
- ältere Patienten, bei denen infolge von Wirbelsäulenverschleiß der Wirbelkanal verengt ist, und bei denen eine Überstreckung der Halswirbelsäule nach hinten dazu führt, dass das Rückenmark zwischen den vorgeknickten Ligamenta flava auf der Rückseite und knöchernen Vorsprüngen der Wirbelkörper auf der Vorderseite eingequetscht wird,
- jüngere Patienten, deren Wirbelsäule infolge beträchtlicher Gewalteinwirkung destabilisiert wurde, wobei es durch dislozierten Wirbelkörperbruch oder Bandscheibenvorfall zur Rückenmarkskompression kommt.
| Syndrom | Betroffene Systeme | Symptome | Typische Ursachen |
|---|---|---|---|
| Brown-Séquard-Syndrom | einseitig: alle Leitungsbahnen und Kerngebiete des Segments | ipsilateral: auf Läsionshöhe schlaffe Parese und vollständiger Sensibilitätsverlust, darunter spastische Parese sowie Störung von Berührungsempfinden, taktiler Diskriminationsfähigkeit und Tiefensensibilität; kontralateral: dissoziierte Sensibilitätsstörung und vermindertes Berührungsempfinden unterhalb der Läsion. | Myelomalazie im Bereich der A. sulcocommissuralis, Trauma, laterale Kompression. |
| Vorderes Quadrantensyndrom | einseitig: Vorderhorn, Tractus spinothalamicus anterior und laterialis, Tractus corticospinalis anterior, evtl. Tractus corticospinalis lateralis, Tractus spinocerebellaris anterior | ipsilateral: auf Läsionshöhe schlaffe Parese, darunter spastische Parese und vermindertes Berührungsempfinden; kontralateral: dissoziierte Sensibilitätsstörung unterhalb der Läsion | Myelomalazie im Bereich der A. sulcocommissuralis, Trauma, Tumore, ventrolaterale Kompression. |
| Hinteres Quadrantensyndrom | einseitig: Hinterhorn, Hinterstränge, Tractus spinocerebellaris posterior, evtl. Tractus corticospinalis lateralis | ipsilateral: auf Läsionshöhe vollständiger Sensibilitätsverlust, darunter Störung von Tiefensensibilität und taktiler Diskiminiationsfähigkeit, Ataxie, ggf. spastische Parese | Myelomalazie im Bereich der A. spinalis posterolateralis, dorsolaterale Kompression. |
| Atypische inkomplette Querschnitte | meist asymmetrische Beteiligung motorischer und sensibler Bahnen sowie von Teilen der grauen Substanz | abhängig von betroffenen Bahnen und Kerngebieten | Tumor, Myelomalazie, Residualzustand nach Trauma. |
| Zentromedulläres Syndrom | Vorderhörner, Seitenhörner, Commissura anterior; ggf. auch Pyramidenbahnen, sympathische Seitenstränge, Tractus spinothalamicus lateralis | auf Läsionshöhe schlaffe Lähmung mit Muskelschwund, darunter spastische Paresen, dissoziierte Sensibilitätsstörung, trophische Hautstörungen, Störung von Harnblase und Mastdarm. | Syringomyelie, Rückenmarkstumore wie Stiftgliome, Myelomalazie im Bereich der A. spinalis anterior. |
Syndrome der langen Leitungsbahnen und Ganglienzellsäulen


Erstreckt sich die Rückenmarksläsion hauptsächlich entlang der Längsachse, sodass bestimmte Leitungsbahnen der weißen Substanz oder Ganglienzellsäulen der grauen Substanz über viele Segmente hinweg geschädigt sind, treten Syndrome auf, die sich von einer Querschnittsymptomatik charakteristisch dadurch unterscheiden, dass nur bestimmte Funktionen ganz oder teilweise beeinträchtigt sind. In aller Regel sind beide Körperhälften gleichermaßen betroffen. Den Läsionen liegen meist neurodegenerative Erkrankungen zu Grunde, die häufig vererblich sind. Weniger häufig sind Stoffwechselstörungen oder Infektionskrankheiten die Ursache.[22]
Ausschließlich sensible Bahnen sind beim reinen Hinterstrangsyndrom geschädigt. Die Läsion der Hinterstrangbahnen führt zum Ausfall der epikritischen Sensibilität und Tiefensensibilität, was begleitet sein kann von sensiblen Reizerscheinungen wie Parästhesie und Überempfindlichkeit bis hin zu Schmerzen. Trotz normaler Muskelkraft werden Bewegungen dadurch beeinträchtigt, dass die Muskelkoordination infolge der verlorenen Tiefensensibilität schwerfällt. Diese spinale Ataxie kann vom Patienten zum Teil dadurch ausgeglichen werden, dass er seine Bewegungen visuell kontrolliert. Mit geschlossenen Augen treten die Symptome deutlicher zutage. Bevor Antibiotika eingeführt wurden, war das Hinterstrangsyndrom meist syphilitischer Natur als Teil einer Tabes dorsalis, zu der meist noch eine Schädigung der Hinterwurzeln hinzukam. Isolierte Hinterstrangläsionen finden sich auch bei Entmarkungskrankheiten, Myelomalazien im Versorgungsbereich der Aa. spinales posterolaterales,[Anm. 2] bei äußerer Kompression des Rückenmarks von hinten durch Tumore, Abszesse oder Hämatome, sowie gelegentlich als paraneoplastisches Syndrom, insbesondere im Zusammenhang mit Lungenkrebs.[22]
Eine noch umfangreichere Degeneration sensibler Bahnen findet sich bei Morbus Friedreich. Diese autosomal-rezessiven Erbkrankheit nimmt ihren Anfang in den Hinterwurzelganglien, bevor sie die Hinterstrang- und Kleinhirnseitenstrangbahnen befällt. Im weiteren Verlauf greift die Krankheit auch auf die Pyramidenbahnen über und zerstört schließlich meist wesentliche Teile des Kleinhirns. Leitsymptom ist auch hier eine Stand- und Gangataxie, die sich aber mit Fortschreiten der Krankheit weiter verschlimmert und auch auf die Arme übergreift. Sobald die Pyramidenbahnen betroffen sind, treten auch spastische Lähmungen bis hin zur Tetraparese auf. Das vollentwickelte Krankheitsbild umfasst zahlreiche weitere neurologische, orthopädische und sonstige Symptome.[23] Eine bessere Prognose besteht bei der benignen Variante der progressiven zerebellären Ataxie mit frühem Beginn. Auch hier sind sowohl Hinterstrang- als auch Kleinhirnseitenstrangbahnen betroffen. Bei der funikulären Myelose – einer Vitamin-B12-Mangelerkrankung – dominiert die Entmarkung von Fasern des Hinterstrangs und der seitlichen Pyramidenbahnen, die den gesamten Hals- und Brustbereich des Rückenmarks betreffen kann. Dementsprechend findet man hier neben gestörter epikritischer und Tiefensensibilität eine spastische Tetraparese, die vor allem die unteren Extremitäten betrifft.[22]
Überwiegend motorische Bahnen sind beim kortikospinalen Syndrom betroffen. Sie treten meist im Rahmen einer hereditären spastischen Paraplegie auf, einer genetisch und klinisch heterogenen Gruppe langsam fortschreitender neurodegenerativer Erkrankungen, die zu einer zunehmenden spastischen Lähmung vor allem der Beine, später auch der Arme führt. Andere mögliche Ursachen sind eine rückenmarksbetonte multiple Sklerose oder Neurosyphilis.[22]
Beim Vorderhornsyndrom sind die motorischen Wurzelzellen im vorderen Teil der grauen Substanz beschädigt, was in den betroffenen Myotomen zu schlaffen Lähmungen mit erloschenen Eigenreflexen führt. Infolge der gestörten Innervation kommt es zu Faszikulationen und Muskelschwund. Das Vorderhornsyndrom ist das morphologische Korrelat der spinalen Muskelatrophie, die auf verschiedene Genmutationen zurückgehen und in unterschiedlichen Schweregraden auftreten kann. Bei manchen Formen sind auch motorische Hirnnervenkerne des verlängerten Marks betroffen, sodass zur Spinal- eine Bulbärparalyse hinzutritt.[22] Eine herausgehobene Rolle unter den Infektionskrankheiten spielt die Poliomyelitis („Kinderlähmung“), die von Polioviren ausgelöst wird, welche bevorzugt die Vorderhornzellen (und meist auch motorische Hirnnervenkerne) befallen. Diese Krankheit, die – infolge der Lähmung der Atemmuskulatur – einst eine der häufigsten Todesursachen von Kindern und Jugendlichen war, ist dank der Etablierung der Polioimpfstoffe in den Industriestaaten weitgehend verschwunden, in Entwicklungsländern mit niedriger Impfquote jedoch nach wie vor ein großes Problem.[24] Seltener liegt dem Vorderhornsyndrom eine Infektion mit Coxsackie- oder Echoviren zu Grunde.[22]
Besonders umfangreich sind die Schäden der motorischen Anteile des Rückenmarks im Falle der amyotrophen Lateralsklerose (ALS). Hier sind sowohl die oberen Motoneurone im Motorcortex betroffen, deren Axone die Pyramidenbahnen in der weißen Substanz des Rückenmarks bilden, als auch die unteren Motoneurone im Vorderhorn der grauen Substanz. Diese kombinierte Schädigung führt dazu, dass zugleich spastische Symptome und atrophische Paresen auftreten. ALS ist eine komplexe Krankheit mit unterschiedlichen Formen hinsichtlich Pathogenese und Verlauf. Sie schreitet unaufhaltsam und deutlich schneller als rein spinale Atrophien voran und führt in der Regel zu einer Tetraparese, die – aufgrund der Mitbeteiligung von Hirnnerven – von Ausfällen der Schluck-, Sprech- und Gesichtsmotorik begleitet sein kann. Der Tod tritt in der Regel infolge zunehmender Lähmung der Atemmuskulatur ein.[22][25]
Codierung im ICD
Traumatische Rückenmarksschäden werden im ICD-10 im Kapitel XIX als „Verletzungen, Vergiftungen und bestimmte andere Folgen äußerer Ursachen“ aufgeführt, wobei eigene Schlüssel für Verletzungen der Nerven und des Rückenmarkes in Halshöhe (S14),[26] in Thoraxhöhe (S24),[27] sowie in Höhe des Abdomens, der Lumbosakralgegend und des Beckens (S34)[28] vorgesehen sind. Diese Gliederung wurde auch im ICD-11 beibehalten, nur dass die entsprechenden Einträge sich nun im Kapitel 22 finden.[29] Ätiologisch lassen sie sich weiter in ischämische, toxische und mechanische Rückenmarksschädigungen unterteilen.[30]
Allgemein werden Krankheiten des Nervensystems im Kapitel VI (ICD-10) bzw. 08 (ICD-11) kodiert. Insbesondere im Falle der Lähmungssyndrome (G81–G83 im ICD-10)[31] sind Mehrfachkodierungen mit den vorgenannten Schlüsseln möglich. Nicht-traumatische Erkrankungen des Rückenmarks werden im ICD-11 explizit unter Spinal cord disorders excluding trauma aufgeführt,[32] im ICD-10 verteilen sie sich auf verschiedene Schlüssel im Block G00–G99.[33]
Pathogenese
Die Entwicklung von Rückenmarkssyndromen nach akuter Verletzung vollzieht sich in zwei Schritten. Im ersten Schritt führen primäre Mechanismen der Schädigung unmittelbar zum Absterben von Nervenzellen, etwa durch Infarkt, Giftwirkung oder mechanische Krafteinwirkung. Letztere schädigt das Gewebe in der Regel sowohl durch den anfänglichen Energieeintrag als auch durch anhaltende Kompression. Im zweiten Schritt löst diese erste Verletzung pathobiochemische und pathophysiologische Prozesse aus, die im weiteren Verlauf zusätzliche Schäden bis hin zu weiterem Zelltod bewirken können.[34]
Dass solche sekundäre Mechanismen eine bedeutende Rolle spielen, war erstmals im Jahre 1911 von Alfred Reginald Allen[Anm. 3] aufgrund von Tierversuchen vorgeschlagen worden.[35] Er war es auch, der zuerst neben dem erhöhten Flüssigkeitsdruck im Gewebe – wenn auch noch spekulativ – biochemische Faktoren in Betracht gezogen hatte.[36] Seitdem wurden zahlreiche Faktoren identifiziert, die für sekundäre Schädigungsmechanismen in Frage kommen. Angesichts der Unvorhersehbarkeit akuter Verletzungen und allfälliger Verzögerungen bis zum folgenden Behandlungsbeginn wird ihnen in der Forschung große Aufmerksamkeit gewidmet, weil sich hier ein therapeutisches Fenster öffnet, das gegenüber primären Mechanismen verschlossen bleibt.[37]
Der zeitliche Ablauf nach einer akuten Rückenmarksverletzung lässt sich grob in drei Phasen unterteilen, die einander überlappen: eine akute (Sekunden nach Verletzung), eine sekundäre (Minuten bis Wochen) und eine chronische (Monate bis Jahre). Während der Schaden – von systemischen Folgen des Schockzustands abgesehen – in der akuten Phase lokal begrenzt ist, führen die einsetzenden sekundären Mechanismen in der Folgephase zu einer Ausweitung des geschädigten Bereichs.[38]
| akut (nach Sekunden) | sekundär (nach Minuten bis Wochen) | chronisch (nach Monaten bis Jahren) |
|---|---|---|
|
|
|
Akute Phase

Eine akute Rückenmarksverletzung führt zunächst zu einem kurzfristigen Anstieg des Blutdrucks, gefolgt von einem länger dauernden Blutdruckabfall. Unter Umständen kommt es zu systemischer Sauerstoffunterversorgung, insbesondere bei Lähmung der Zwerchfellmuskulatur. Eine unzureichende Versorgung des Nervengewebes mit Sauerstoff und Nährstoffen löst in den ersten 2–24 Stunden nach Verletzung einen spinalen Schock aus.[38] Hierbei handelt es sich um einen weitreichenden Funktionsverlust des Rückenmarks mit vollständiger, schlaffer Lähmung und erloschenen Eigenreflexen, der in diesem frühen Stadium weder Schlüsse auf die Ursache und Schwere der Schädigung noch eine Prognose erlaubt.[39]
Die primären Schädigungsmechanismen führen zum Untergang von Nerven- und Endothelzellen. Bei benachbarten Nervenzellen, die die unmittelbare Verletzung überlebt haben, werden Aktionspotentiale ausgelöst, was lokal beträchtliche Konzentrationsänderungen der beteiligten Elektrolyte verursacht, die noch dadurch verschärft wird, dass durch Scherkräfte aufgerissene Zellen ihr Cytosol in den Extrazellularraum ergießen. Die dadurch bedingte Zerstörung der physiologischen Ionengradienten kann zum Absterben weiterer Nervenzellen führen. Gleiches gilt für die unkontrollierte Ausschüttung von Neurotransmittern in den synaptischen Spalt zwischen verknüpften Nervenzellen, welche an die elektrochemischen Prozesse in deren Zellinneren gekoppelt ist. Einblutungen und Ödembildung im engen Wirbelkanal erhöhen den Druck auf das Gewebe weiter. Krampfhafte Blutgefäßverengung und Blutgerinnsel führen zur Ischämie insbesondere in der grauen Substanz.[38]
Sekundäre Phase
Nachdem die gestörte Elektrolythomöostase bereits in der akuten Phase eine erste Erhöhung der intrazellulären Konzentration von Calcium-Ionen bewirkt hat, kann sich dieser Prozess in der sekundären Phase fortsetzen. Insbesondere in der weißen Substanz konnte im Tierversuche gezeigt werden, wie die in geschädigten Axonen ebenfalls unphysiologisch erhöhte Konzentration von Natrium-Ionen im Cytosol durch sekundär aktiven Transport über Natrium-Calcium-Austauscher zu einer weiteren Erhöhung der Calcium-Konzentration führt. Schon länger ist bekannt, dass hohe intrazelluläre Calcium-Konzentrationen mit oxidativem Stress nach Rückenmarksverletzungen korrelieren.[38][40] In jüngerer Zeit konnte als molekulare Ursache hierfür ein Calcium-abhängiger Prozess in den Mitochondrien ausgemacht werden, der als Mitochondrial Permeability Transition[Anm. 4] (MPT) bezeichnet wird.[41][42] Hierbei bilden sich Poren in der inneren Mitochondrienmembran. Die Störung der oxidativen Phosphorylierung führt zur Anreicherung reaktiver Sauerstoffspezies, welche durch die Poren aus der Mitochondrienmatrix entweichen können.[43] Diese freien Radikale schädigen durch Lipidperoxidation die Doppellipidschicht der Zellmembran. Zusammenbruch der Zellmembran führt zum einen zum Untergang der betroffenen Zelle selbst, zum anderen zur Freisetzung ihres Inhalts in den Extrazellularraum, was weitere Nachbarzellen bedroht.[38]
Die Verletzung löst eine Immunantwort aus, an der neutrophile Granulozyten, Monozyten, Mikroglia und T-Lymphozyten beteiligt sind. Als erstes treffen Neutrophile ein und beginnen, Gewebsbruchstücke und etwaige Mikroorganismen zu beseitigen, wofür sie Enzyme – vor allem Proteasen und Myeloperoxidase – und freie Radikale einsetzen, die auch überlebende Nervenzellen schädigen können. Die von ihnen ausgeschütteten Zytokine dienen als Botenstoffe für die weitere Immunantwort. Im Laufe der nächsten 24 Stunden werden dadurch zum einen Mikrogliazellen vor Ort aktiviert und zum anderen Monozyten aus dem Blutkreislauf herbeigelockt, die nach Eintritt in das Rückenmark zu Makrophagen differenzieren. Über die folgenden Wochen phagozytieren Zellen beider Zelltypen degenerierende Nervenfasern und anderer Gewebsbruchstücke. Während diejenigen Zytokine, die als Wachstumsfaktoren wirken, wichtig für die Regeneration des Gewebes sind, führen pro-inflammatorische Zytokine und freie Radikale dazu, dass sich der Schaden weiter ausdehnt.[38] Die Rolle der T-Lymphozyten wird noch debattiert.[38][44]
War diese inflammatorische Immunantwort durch den unkontrollierten Tod aufplatzender Zellen während der akuten Phase provoziert worden, so übernimmt nach einigen Stunden der programmierte Zelltod in Form der Apoptose die Hauptrolle im Zelluntergangsgeschehen. Sie betrifft sowohl Nerven- als auch Neurogliazellen wie Oligodendrozyten und Astrozyten.[38] Rückenmarksverletzungen führen zur verstärkten Expression von Todesrezeptoren aus der TNF/TNFR-Superfamilie und ihrer Liganden sowie zur Aktivierung von Caspasen und Calpain, welche alle zur apoptotischen Kaskade gehören. Als Auslöser diskutiert werden – neben Glutamat über den exzitotoxischen Mechanismus – die reaktive Sauerstoffspezies Wasserstoffperoxid, das GSH/GSSG-Redoxsystem (was mit der MPT und der Aktivität von Caspase-3 zusammenhängt), das Zytokin TNF-α sowie der Ligand des Fas-Rezeptors.[45]
Chronische Phase

Längerfristig schädlich wirkt sich der Untergang von Oligodendrozyten aus, welche im Zentralnervensystem eine isolierende Myelinscheide um die Axone bilden und dadurch saltatorische Erregungsleitung ermöglichen. Da ein einzelner Oligodendrozyt 10–40 Axone versorgt, führt ihr Verlust zur Demyelinisierung zahlreicher – bis dahin noch funktionaler – Nerven. Zusammen mit der infolgedessen veränderten Funktion der Ionenkanäle überlebender Nervenzellen kann hier die Ursache für die Entwicklung chronischer Schmerzen liegen.[38]
Im Laufe der Zeit nimmt der Anteil normalen Gewebes an der verletzten Stelle immer weiter ab. An seiner Stelle können sich über den Zeitraum einiger Wochen flüssigkeitsgefüllte Hohlräume bilden, die sich über mehrere Segmente ober- und unterhalb der lädierten Stelle ausdehnen und dadurch eine Lücke bilden können, über die hinweg keine Axone nachwachsen können. Auch die einsetzende Narbenbildung durch Astrozyten behindert die axonale Regeneration durch eine Vielzahl von Wachstumshemmern, die von den in der Glianarbe eingeschlossenen Zellen (Astrozyten, Oligodendrozyten incl. Vorläuferzellen, aktivierte Mikroglia sowie Neurothelzellen) ausgeschüttet werden.[38]
Noch viele Jahre später kann eine Zyste im Rückenmark zur Syringomyelie führen.[38]
Diagnose
Klinische Klassifikation
Einteilung nach morphologischer Schwere der Verletzung
Klinisch werden Rückenmarksverletzungen heute in folgende drei Schweregrade eingeteilt:[46]
- Die Rückenmarkserschütterung oder Commotio spinalis ist die einfachste Verletzung des Rückenmarks. Hier treten vorübergehende neurologische Reiz- oder Ausfallserscheinungen auf, die sich im Allgemeinen rasch zurückbilden, ohne dass zu irgendeinem Zeitpunkt morphologische Veränderungen am Rückenmark nachweisbar sind. Der plötzlich eingetretene Funktionsausfall von Sensibilität, Reflexen und Motorik unterhalb bzw. distalwärts der Gewalteinwirkung ist (nach wenigen Stunden bis einigen Wochen)[47] vollständig reversibel.
- Bei der Rückenmarksprellung oder Contusio spinalis sind dagegen stets morphologische Veränderungen nachweisbar. Sie führt zu unmittelbaren neurologischen Ausfällen, welche manchmal auch verzögert auftreten können. Eine vollständige Heilung ist in der Regel nicht mehr möglich. Pathologisches Korrelat sind Ödeme und Schädigung von Axonen.
- Die Rückenmarkszerreißung führt immer zu dauerhaften neurologischen Ausfällen.
Frankel-Schema
Bemühungen um einheitliche Standards bei der Erforschung und Behandlung von Rückenmarksverletzungen hatte es bereits seit den 1960er Jahren gegeben. Der Neurochirurg Lorenz Sigmund Michaelis versandte im Jahr 1967[48] Fragebögen an 49 Kollegen in 16 Ländern, um herauszufinden, wie sie Diagnose und Prognose handhaben. Zusammen mit Hans L. Frankel,[Anm. 5] Ludwig Guttmann und weiteren Kollegen veröffentlichten sie 1969[49] ein erstes Klassifikationsschema, das als Frankel-Schema bekannt wurde und bisweilen heute noch Anwendung findet.[50]
| Grad | Benennung im Original | Klinischer Befund |
|---|---|---|
| A | Complete | komplette Verletzung, weder motorische noch sensible Funktion unterhalb der Höhe der Läsion |
| B | Sensory only | keine Motorik, Sensibilität ist aber bis in die sakralen Segmente erhalten |
| C | Motor Useless | keine Gebrauchsmotorik bei vorhandener motorischer Aktivität unterhalb der Höhe der Läsion |
| D | Motor Useful | vorhandene Restmotorik erlaubt den Gebrauch der Extremität mit oder ohne Unterstützung |
| E | Recovery | normale Motorik und Sensibilität, ggf. pathologische Reflexe oder veränderter Tonus |
Dieses Schema war noch eher grob gehalten, lässt sich aber unproblematisch auf Patienten mit vollständiger Lähmung (Grad A/B) anwenden. Bis zu welcher Stärke jedoch die Restmotorik noch als useful – dt. brauchbar – angesehen wird (Grad C/D), ist naturgemäß subjektiv gefärbt. Auch ob ein Patient als vollständig erholt anzusehen ist (Grad E), hängt vor allem davon ab, wie viel Sorgfalt bei der Untersuchung aufgewandt wird. Dass die Läsionshöhe bei der Klassifikation unberücksichtigt bleibt, erschwert die vergleichende Beurteilung von Behandlungserfolgen, da die Prognose auch von der Läsionshöhe abhängt.[52][53]
ASIA Impairment Scale
| Punkte | Testkriterium: Der Muskel … |
|---|---|
| 0 | … ist ohne jede Funktion. |
| 1 | … hat noch Spuren von Funktion. |
| 2 | … kann Gelenk in der horizontalen Ebene bewegen. |
| 3 | … kann das distale Glied gegen die Schwerkraft heben. |
| 4 | … kann gegen mäßigen Widerstand anarbeiten. |
| 5 | … funktioniert normal. |
Um diesen Einschränkungen zu begegnen, wurden in der Folgezeit verschiedene detaillierte Scores vorgeschlagen. Zur Bewertung der Muskelkraft war bereits seit 1946 ein sechsstufiges Punkteschema verbreitet, das auch dem Muskelfunktionstest des tschechischen Rehabilitationsmediziners Vladimír Janda zugrunde liegt.[55] Die amerikanischen Neurochirurgen John T. Lucas und Thomas B. Ducker entwickelten 1979[56] mit dem Neurotrauma Motor Index einen motorischen Score anhand der Funktion von 14 Kennmuskeln. Hierbei wird neun paarig angelegten Muskeln jeweils ein ganzzahliger Punktewert von 0 bis 5 zugewiesen; fünf weitere Muskelgruppen (u. a. Zwerchfell und Analsphinkter) erhalten einen Wert von 0 (ohne Funktion) bis 2 (normal), sodass insgesamt 100 Punkte erreicht werden können.[54]
Auf Grundlage dieser Vorarbeiten entwickelte die American Spinal Injury Association (ASIA) 1982 die ASIA Standards for the Neurological Classification of Spinal Cord Injuries, die seitdem mehrfach überarbeitet wurden.[50][53] Nachdem sich die International Spinal Cord Society[Anm. 6] diese Standards 1992 zu eigen gemacht hatte, wurden sie bei der nächsten Revision 1996 in International Standards for Neurological and Functional Classification of Spinal Cord Injury umbenannt, seit 2000 nur noch International Standards for Neurological Classification of Spinal Cord Injury (ISNCSCI).[57]
Teil der ISNCSCI ist die ASIA Impairment Scale (AIS), eine Weiterentwicklung des ursprünglichen Frankel-Schemas, die für den motorischen Score auf das sechsstufige Punkteschema zurückgreift und es um einen sensorischen Score erweitert. Für den motorischen Score werden jeweils fünf paarigen Kennmuskeln der oberen und unteren Extremitäten entsprechend ihrer Funktionalität je 0–5 Punkte zugewiesen. Die zuvor problematische Abgrenzung der Grade C/D beruht nun auf dem Ergebnis des motorischen Scores, wobei zur Unterscheidung der Grade B/C die Untersuchung bestimmter weiterer Muskeln empfohlen wird. Für den sensorischen Score wird den 28 Dermatomen auf jeder Seite jeweils 0–2 Punkte zugewiesen. Besonderer Bedeutung kommt dabei den – zu einem Segment zusammengefassten – Dermatomen S4/S5 zu: Der Querschnitt gilt als komplett (Grad A), wenn selbst tiefe anale Druckstimulation nicht mehr wahrgenommen wird. Die Standards definieren ferner die Körperhaltung, in der die einzelnen Kennmuskeln geprüft werden sollen, die Befundung der Analsphinkterfunktion, sowie die Stellen, an denen die Empfindungsfähigkeit getestet wird.[58]
| Grad | Benennung | Klinischer Befund |
|---|---|---|
| A | komplett | weder motorische noch sensible Funktion auf Höhe S4/S5 |
| B | sensibel inkomplett |
|
| C | motorisch inkomplett |
|
| D | motorisch inkomplett | wie C, aber Mehrheit der Kennmuskeln unterhalb des neurologischen Verletzungsniveaus hat Kraftgrad ≥ 3 |
| E | normal | Restitutio ad integrum |
Die AIS gilt heute international als Goldstandard bei der Untersuchung von Rückenmarksverletzungen.[59] Darüber hinaus eignet sie sich auch zur Beurteilung und Verlaufskontrolle bei nicht-traumatischen Querschnittsyndromen.[60]
Im Vergleich mit dem ursprünglichen Frankel-Schema ist die AIS deutlich komplexer, was eine differenziertere Klassifikation ermöglicht, sie aber auch anfälliger macht für untersucherabhängige Ergebnisdifferenzen. In der wissenschaftlichen Literatur wird daher die Bedeutung standardisierter Untersuchertrainings sowie der Mitterfassung der Variabilität bei der Datenerhebung betont.[53][61] Insbesondere im Hinblick auf den minimalen klinisch relevanten Unterschied – die kleinste Änderung ihres Scores, der von Patienten als bedeutsame Verbesserung bzw. Verschlechterung ihres Zustands wahrgenommen wird – besteht noch Forschungsbedarf.[62][63] Ein weiteres Problem besteht darin, dass für den AIS lediglich neurologische Funktionen geprüft werden, ohne zu berücksichtigen, welche funktionellen Einschränkungen sich daraus für den Patienten ergeben. Patienten mit dem gleichen AIS-Grad und Score können in ihrem Alltag sehr unterschiedlich beeinträchtigt sein (z. B. eine Patientin mit beidseitig gelähmten Händen ggü. einer mit einseitig gelähmtem Arm).[53]
Scoring von Alltagsfähigkeiten, Selbständigkeit und Teilhabe
Weitere Scoring-Systeme können herangezogen werden, um quantitative Aussagen über die funktionelle Situation des Patienten – jenseits der rein neurologischen Funktionsfähigkeit – treffen zu können. Zur Beurteilung der Gehfähigkeit lässt sich etwa der aus der Geriatrie bekannte Timed up and go test einsetzen, bei dem beobachtet wird, wie lange ein Patient tatsächlich benötigt, um sich von einem Stuhl zu erheben, eine Strecke von drei Metern hin- und zurückzugehen und sich wieder hinzusetzen. Speziell für die Beurteilung der Gehfähigkeit nach Rückenmarksschädigung wurde der Walking Index for Spinal Cord Injury[Anm. 7] (WISCI) entwickelt. Hier wird auch erhoben, inwieweit der Patient auf unterstützende Personen, Hilfsmittel und Gehhilfen angewiesen ist. Manuelle Fähigkeiten werden im Graded Redefined Assessment of Strength, Sensibility and Prehension[Anm. 8] (GRASSP) geprüft, der ebenfalls speziell für rückenmarksgeschädigte Patienten entworfen wurde. Die Entwicklung eines allgemein akzeptierten Handfunktionstests ist allerdings noch nicht abgeschlossen.[53]
Der Functional Independence Measure (FIM) ist ein seit längerem etabliertes Scoring-System, um die Selbständigkeit eines Patienten im Alltag zu beurteilen (Essen, Anziehen, Körperhygiene, Kontinenz, Transfermöglichkeiten, Fortbewegung, Kommunikation). Mit dem Spinal Cord Independence Measure (SCIM) existiert seit 1997[64] eine speziell an Rückenmarksschäden angepasste Variante des FIM.[53]
Anmerkungen
- ↑ Das zentromedulläre Syndrom wird meist zu den inkompletten Querschnittsyndromen gezählt. Auch Ende-Henningsen – die es selbst unter den Syndromen bei Läsionen der langen spinalen Leitungsbahnen und Ganglienzellsäulen führt – weist auf diese Möglichkeit zur Einordnung hin.
- ↑ Die weiter seitlich verlaufenden Aa. spinales posterolaterales (PSLA) sind wie die ebenfalls in Längsrichtung des Rückenmarks verlaufenden Aa. spinales posteriores (PSA) paarig angelegt. In manchen Segmenten gibt es auf jeder Seite sowohl eine PSA als auch eine PSLA, häufiger ist pro Seite nur eine der beiden angelegt. Zwischen den beiden Arterien bestehen zahlreiche Anastomosen. – Martin Wiesmann: Gefäßversorgung von Wirbelsäule und Rückenmark. In: Martin Wiesmann, Jennifer Linn, Hartmut Brückmann (Hrsg.): Atlas Klinische Neuroradiologie, Sektion I: Neuroanatomie Wirbelsäule und Rückenmark. Springer, Berlin/Heidelberg 2014, ISBN 978-3-642-38109-6 (Ebook), S. 56.
- ↑ Für eine Biographie s. Edward B. Schlesinger: Alfred Reginald Allen: The mythic career of a gifted neuroscientist. In: Surgical Neurology, 1991, Band 36, Nr. 3, S. 229–233, doi:10.1016/0090-3019(91)90119-T.
- ↑ Für ein aktuelles Review s. Massimo Bonora, Carlotta Giorgi, Paolo Pinton: Molecular mechanisms and consequences of mitochondrial permeability transition. In: Nature Reviews Molecular Cell Biology, 2022, Band 23, S. 266–285, doi:10.1038/s41580-021-00433-y.
- ↑ Für eine Kurzbiographie s. J. Cosbie Ross, Isaac Nuseibeh: Profile on Dr. Hans L. Frankel. In: Paraplegia, 1984, Band 22, Nr. 1, S. 5–6, doi:10.1038/sc.1984.3.
- ↑ Damals firmierte die ISCoS noch als International Medical Society of Paraplegia (IMSoP).
- ↑ Für ein Review des WISCI siehe J. F. Ditunno Jr., P. L. Ditunno, G. Scivoletto, M. Patrick, M. Dijkers, H. Barbeau, A. S. Burns, R. J. Marino, M. Schmidt-Read: The Walking Index for Spinal Cord Injury (WISCI/WISCI II): nature, metric properties, use and misuse. In: Spinal Cord, 2013, Band 51, S. 346–355.
- ↑ vgl. Inge-Marie Velstra, Marc Bolliger, Lorenzo Giuseppe Tanadini, Michael Baumberger, Rainer Abel, Johan S. Rietman, Armin Curt: Prediction and stratification of upper limb function and self-care in acute cervical spinal cord injury with the graded redefined assessment of strength, sensibility, and prehension (GRASSP). In: Neurorehabilitation and Neural Repair, 2014, Band 28, Nr. 7, S. 632–642, doi:10.1177/1545968314521695.
Literatur
- Catharyn T. Liverman, Bruce M. Altevogt, Janet E. Joy, Richard T. Johnson (Hrsg.): Spinal Cord Injury: Progress, Promise, and Priorities. National Academy of Sciences, Washington 2005, ISBN 0-309-09585-9.
- Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 81–93.
- Thorsten Steiner, Ricarda Diem: Rückenmarksyndrome. In: Werner Hacke (Hrsg.): Neurologie. Springer, Berlin/Heidelberg 2019 (14. Auflage), ISBN 978-3-662-46892-0 (Ebook), S. 72–76.
Einzelnachweise
- ↑ Hans-Joachim Wojak: Spinales Trauma/Querschnittslähmung. In: Jürgen Piek (Hrsg.): Neurochirurgie für Einsteiger. Walter de Gruyter, Berlin/Boston 2019, ISBN 978-3-11-060930-1, S. 292.
- ↑ Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 81 ff.
- ↑ Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 87 ff.
- ↑ Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 90.
- ↑ Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 92 f.
- ↑ Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 90 ff.
- ↑ Stefan Huggenberger, Natasha Moser, Hannsjörg Schröder, Bruno Cozzi, Alberto Granato, Adalberto Merighi: Neuroanatomie des Menschen. Springer, Berlin/Heidelberg 2019, ISBN 978-3-662-56461-5 (Ebook), S. 2–9.
- ↑ a b Markus Wirz, Volker Dietz: Grundlagen. In: Wilhelm Strubreither, Martina Neikes, Daniel Stirnimann, Jörg Eisenhuth, Barbara Schulz, Peter Lude (Hrsg.): Klinische Psychologie bei Querschnittlähmung. Springer, Wien 2015, ISBN 978-3-7091-1601-2 (Ebook), S. 84–85.
- ↑ Stefan Huggenberger, Natasha Moser, Hannsjörg Schröder, Bruno Cozzi, Alberto Granato, Adalberto Merighi: Neuroanatomie des Menschen. Springer, Berlin/Heidelberg 2019, ISBN 978-3-662-56461-5 (Ebook), S. 194–195.
- ↑ a b c Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 81–84.
- ↑ Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 83.
- ↑ a b c Norbert Weidner, Andreas Hug: Wirbelsäulen- und Rückenmarktraumen. In: Werner Hacke (Hrsg.): Neurologie. Springer, Berlin/Heidelberg 2019 (14. Auflage), ISBN 978-3-662-46892-0 (Ebook), S. 687.
- ↑ a b Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 84–86.
- ↑ a b Hans-Joachim Wojak: Spinales Trauma/Querschnittslähmung. In: Jürgen Piek (Hrsg.): Neurochirurgie für Einsteiger. Walter de Gruyter, Berlin/Boston 2019, ISBN 978-3-11-060930-1, S. 295.
- ↑ William McKinley, Katia Santos, Michelle Meade, Karen Brooke: Incidence and Outcomes of Spinal Cord Injury Clinical Syndromes. In: The Journal of Spinal Cord Medicine, 2007, Band 30, Nr. 3, S. 215–224, doi:10.1080/10790268.2007.11753929.
- ↑ Dennis A. Velez, David W. Newell: Spine Injuries. In: Anne J. Moore, David W. Newell (Hrsg.): Neurosurgery: Principles and Practice. Springer, London/Berlin/Heidelberg 2005, ISBN 1-85233-522-X, S. 382.
- ↑ Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 89–90.
- ↑ Thorsten Steiner, Ricarda Diem: Rückenmarksyndrome. In: Werner Hacke (Hrsg.): Neurologie. Springer, Berlin/Heidelberg 2019 (14. Auflage), ISBN 978-3-662-46892-0 (Ebook), S. 74.
- ↑ James S. Harrop, Ashwini Sharan, Jonathon Ratliff: Central cord injury: pathophysiology, management, and outcomes. In: The Spine Journal, 2006, Band 6, Nr. 6, S. 198S–206S, doi:10.1016/j.spinee.2006.04.006.
- ↑ Nathaniel P. Brooks: Central Cord Syndrome. In: Neurosurgery Clinics of North America, 2017, Band 28, Nr. 1, S. 41–47, doi:10.1016/j.nec.2016.08.002.
- ↑ Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 85/89.
- ↑ a b c d e f g Bettina Ende-Henningsen: Spinale Syndrome. In: Peter Berlit (Hrsg.): Klinische Neurologie. Springer Reference Medizin. Springer, Berlin/Heidelberg 2020, ISBN 978-3-662-60676-6 (Ebook), S. 87–90.
- ↑ Katrin Bürk: Ataxien. In: Werner Hacke (Hrsg.): Neurologie. Springer, Berlin/Heidelberg 2019 (14. Auflage), ISBN 978-3-662-46892-0 (Ebook), S. 630.
- ↑ Uta Meyding-Lamadé, Stefan Hähnel, Julian Bösel: Virale Entzündungen. In: Werner Hacke (Hrsg.): Neurologie. Springer, Berlin/Heidelberg 2019 (14. Auflage), ISBN 978-3-662-46892-0 (Ebook), S. 522.
- ↑ Albert Ludolph: Amyotrophe Lateralsklerose und andere Motoneuronerkrankungen. In: Werner Hacke (Hrsg.): Neurologie. Springer, Berlin/Heidelberg 2019 (14. Auflage), ISBN 978-3-662-46892-0 (Ebook), S. 819–821.
- ↑ BfArM: ICD-10-GM Version 2023, Kapitel XIX: Verletzungen, Vergiftungen und bestimmte andere Folgen äußerer Ursachen (S00-T98), Verletzungen des Halses (S10-S19), abgerufen am 4. April 2023.
- ↑ BfArM: ICD-10-GM Version 2023, Kapitel XIX: Verletzungen, Vergiftungen und bestimmte andere Folgen äußerer Ursachen (S00-T98), Verletzungen des Thorax (S20-S29), abgerufen am 4. April 2023.
- ↑ BfArM: ICD-10-GM Version 2023, Kapitel XIX: Verletzungen, Vergiftungen und bestimmte andere Folgen äußerer Ursachen (S00-T98), Verletzungen des Abdomens, der Lumbosakralgegend, der Lendenwirbelsäule und des Beckens (S30-S39), abgerufen am 4. April 2023.
- ↑ WHO: ICD-11 for Mortality and Morbidity Statistics (Version : 01/2023), abgerufen am 4. April 2023.
- ↑ Michael M. McGarvey, Albert T. Cheung: Preservation of Spinal Cord Function. In: Mark F. Newman, Lee A. Fleisher, Mitchell P. Fink (Hrsg.): Perioperative Medicine: Managing for Outcome. Elsevier Health Sciences, ISBN 978-1-4160-2456-9, S. 335.
- ↑ BfArM: ICD-10-GM Version 2023, Kapitel VI: Krankheiten des Nervensystems (G00-G99), Zerebrale Lähmung und sonstige Lähmungssyndrome (G80-G83), abgerufen am 4. April 2023.
- ↑ WHO: ICD-11 for Mortality and Morbidity Statistics (Version : 01/2023), abgerufen am 4. April 2023.
- ↑ BfArM: ICD-10-GM Version 2023, Kapitel VI: Krankheiten des Nervensystems (G00-G99), abgerufen am 4. April 2023.
- ↑ Lali H. S. Sekhon, Michael G. Fehlings: Epidemiology, Demographics, and Pathophysiology of Acute Spinal Cord Injury. In: Spine, 2001, Band 26, Nr. 24S, S. S2–S12, doi:10.1097/00007632-200112151-00002.
- ↑ Alfred Reginald Allen: Surgery for experimental lesions of spinal cord equivalent to crush injury of fracture dislocation of spinal column: A preliminary report. In: Journal of the American Medical Association, 1911, Band 57, Nr. 11, S. 878–880, doi:10.1001/jama.1911.04260090100008.
- ↑ Alfred Reginald Allen: Remarks on the histopathological changes in the spinal ord due to impact. An experimental study. In: The Journal of Nervous and Mental Disease, 1914, Band 43, Nr. 3, S. 141–147, doi:10.1097/00005053-191403000-00002.
- ↑ Charles Aidemise Oyinbo: Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. In: Acta Neurobiologiae Experimentalis, 2011, Band 71, Nr. 2, S. 281–299, PMID 21731081.
- ↑ a b c d e f g h i j k l Catharyn T. Liverman, Bruce M. Altevogt, Janet E. Joy, Richard T. Johnson (Hrsg.): Spinal Cord Injury: Progress, Promise, and Priorities. National Academy of Sciences, Washington 2005, ISBN 0-309-09585-9, S. 36–45.
- ↑ Thorsten Steiner, Ricarda Diem: Rückenmarksyndrome. In: Werner Hacke (Hrsg.): Neurologie. Springer, Berlin/Heidelberg 2019 (14. Auflage), ISBN 978-3-662-46892-0 (Ebook), S. 73.
- ↑ Tsung-I Peng, Mei-Jie Jou: Oxidative stress caused by mitochondrial calcium overload. In: Mitochondrial Research in Translational Medicine, 2010, Band 1201, Nr. 1, S. 183–188, doi:10.1111/j.1749-6632.2010.05634.x.
- ↑ Mario Zoratti, Ildikò Szabò: The mitochondrial permeability transition. In: Biochimica et Biophysica Acta, 1995, Band 1241, S. 139–176, doi:10.1016/0304-4157(95)00003-A.
- ↑ Marina Frantseva, Jose Luis Perez Velazquez, Alexandre Tonkikh, Yana Adamchik, Peter L. Carlen: Neurotrauma/neurodegeneration and mitochondrial dysfunction. In: Progress in Brain Research, 2002, Band 137, S. 171–176, doi:10.1016/s0079-6123(02)37015-8.
- ↑ Massimo Bonora, Carlotta Giorgi, Paolo Pinton: Molecular mechanisms and consequences of mitochondrial permeability transition. In: Nature Reviews Molecular Cell Biology, 2022, Band 23, S. 266–285, doi:10.1038/s41580-021-00433-y.
- ↑ Christophe Gattlen, Christine B. Clarke, Nicolas Piller, Guylène Kirschmann, Marie Pertin, Isabelle Decosterd, Romain-Daniel Gosselin, Marc R. Suter: Spinal Cord T-Cell Infiltration in the Rat Spared Nerve Injury Model: A Time Course Study. In: International Journal of Molecular Sciences, 2016, Band 17, Nr. 3, S. 352, doi:10.3390/ijms17030352.
- ↑ Ning Zhang, Ying Yin, Sheng-Jie Xu, Yong-Ping Wu, Wei-Shan Chen: Inflammation & apoptosis in spinal cord injury. In: Indian Journal of Medical Research, 2012, Band 135, Nr. 3, S. 287–296, PMID 22561613.
- ↑ Hans-Joachim Wojak: Spinales Trauma/Querschnittslähmung. In: Jürgen Piek (Hrsg.): Neurochirurgie für Einsteiger. Walter de Gruyter, Berlin/Boston 2019, ISBN 978-3-11-060930-1, S. 293.
- ↑ Immo von Hattingberg: Commotio und contusio spinalis. Hämatomyelie. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1325.
- ↑ L. S. Michaelis: International inquiry on neurological terminology and prognosis in paraplegia and tetraplegia. In: Spinal Cord, 1969, Band 7, S. 1–5, doi:10.1038/sc.1969.2.
- ↑ a b H. L. Frankel, D. O. Hancock, G. Hyslop, J. Melzak, L. S. Michaelis, G. H. Ungar, J. D. S. Vernon, J. J. Walsh: The value of postural reduction in the initial management of closed injuries of the spine with paraplegia and tetraplegia: Part I. In: Spinal Cord, 1969, Band 7, Nr. 3, S. 179–192, doi:10.1038/sc.1969.30.
- ↑ a b Rıdvan Alaca: ASIA Assessment of Spinal Cord Injury – History. In: Turkish Journal of Physical Medicine and Rehabilitation, 2015, Band 61, Supp. 1, S. S1–S3, doi:10.5152/tftrd.2015.93653.
- ↑ Hans-Joachim Wojak: Spinales Trauma/Querschnittslähmung. In: Jürgen Piek (Hrsg.): Neurochirurgie für Einsteiger. Walter de Gruyter, Berlin/Boston 2019, ISBN 978-3-11-060930-1, S. 295.
- ↑ Joost J. van Middendorp, Ben Goss, Susan Urquhart, Sridhar Atresh, Richard P. Williams, Michael Schuetz: Diagnosis and Prognosis of Traumatic Spinal Cord Injury. In: Global Spine Journal, 2011, Band 1, Nr. 1, S. 1–8, doi:10.1055/s-0031-1296049.
- ↑ a b c d e f Rainer Abel: Klinische Klassifikationssysteme und Methoden. In: Wilhelm Strubreither, Martina Neikes, Daniel Stirnimann, Jörg Eisenhuth, Barbara Schulz, Peter Lude (Hrsg.): Klinische Psychologie bei Querschnittlähmung. Springer, Wien 2015, ISBN 978-3-7091-1601-2 (Ebook), S. 749–755.
- ↑ a b Thomas B. Ducker, John T. Lucas, Constance A. Wallace: Recovery from Spinal Cord Injury. In: Clinical Neurosurgery, 1983, Band 30, S. 495–513, doi:10.1093/neurosurgery/30.cn_suppl_1.495.
- ↑ Vladimír Janda: Manuelle Muskelfunktionsdiagnostik. Elsevier / Urban & Fischer, München 2009, ISBN 978-3-437-46432-4, S. 3.
- ↑ J. T. Lucas, T. B. Ducker: Motor classification of spinal cord injuries with mobility, morbidity and recovery indices. In: Am. Surg., 1979, Band 45, Nr. 3, S. 151–158, PMID 434614.
- ↑ Steven C. Kirshblum, William Waring, Fin Biering-Sorensen, Stephen P. Burns, Mark Johansen, Mary Schmidt-Read, William Donovan, Daniel Graves, Amit Jha, Linda Jones, M. J. Mulcahey, Andrei Krassioukov: Reference for the 2011 revision of the International Standards for Neurological Classification of Spinal Cord Injury. In: The Journal of Spinal Cord Medicine, 2011, Band 34, Nr. 6, S. 547–554, doi:10.1179/107902611X13186000420242.
- ↑ a b Rüdiger Rupp, Fin Biering-Sørensen, Stephen P. Burns, Daniel E. Graves, James Guest, Linda Jones, Mary Schmidt Read, Gianna M. Rodriguez, Christian Schuld, Keith E. Tansey-Md, Kristen Walden, Steven Kirshblum: International Standards for Neurological Classification of Spinal Cord Injury: Revised 2019. In: Topics in Spinal Cord Injury Rehabilitation, 2021, Band 27, Nr. 2, S. 1–22, doi:10.46292/sci2702-1.
- ↑ Timothy T. Roberts, Garret R. Leonard, Daniel J. Cepela: Classifications In Brief: American Spinal Injury Association (ASIA) Impairment Scale. In: Clinical Orthopaedics and Related Research, 2017, Band 475, Nr. 5, S. 1499–1504, doi:10.1007/s11999-016-5133-4.
- ↑ Mehdi Haschemi, Kristina Müller: Rehabilitation nach spinalem Trauma bei Kindern. In: Heidi Bächli, Jürg Lütschg, Martina Messing-Jünger (Hrsg.): Pädiatrische Neurochirurgie. Springer, Berlin/Heidelberg 2018, ISBN 978-3-662-48699-3, S. 676.
- ↑ A. J. Armstrong, J. M. Clark, D. T. Ho, C. J. Payne, S. Nolan, L. M. Goodes, L. A. Harvey, R. Marshall, M. P. Galea, S. A. Dunlop: Achieving assessor accuracy on the International Standards for Neurological Classification of Spinal Cord Injury. In: Spinal Cord, 2017, Band 55, S. 994–1001, doi:10.1038/sc.2017.67.
- ↑ Julio C. Furlan, Michael G. Fehlings, Charles H. Tator, Aileen M. Davis: Motor and sensory assessment of patients in clinical trials for pharmacological therapy of acute spinal cord injury: psychometric properties of the ASIA Standards. In: Journal of Neurotrauma, 2008, Band 25, Nr. 11, S. 1273–1301, doi:10.1089/neu.2008.0617.
- ↑ X. Wu, J. Liu, L. G. Tanadini, D. P. Lammertse, A. R. Blight, John L. K. Kramer, G. Scivoletto, L. Jones, S. Kirshblum, R. Abel, J. Fawcett, E. Field-Fote, J. Guest, B. Levinson, D. Maier, K. Tansey, N. Weidner, W. G. Tetzlaff, T. Hothorn, A. Curt, J. D. Steeves: Challenges for defining minimal clinically important difference (MCID) after spinal cord injury. In: Spinal Cord, 2015, Band 53, S. 84–91, doi:10.1038/sc.2014.232.
- ↑ A. Catz, M. Itzkovich, E. Agranov, H. Ring, A. Tamir: SCIM--spinal cord independence measure: a new disability scale for patients with spinal cord lesions. In: Spinal Cord, 1997, Band 35, Nr. 12, S. 850–856, doi:10.1038/sj.sc.3100504.
Auf dieser Seite verwendete Medien
Autor/Urheber: Fpjacquot, Lizenz: CC BY-SA 3.0
a schematic diagram showing anatomical signification of uncomplete cord injuries
Autor/Urheber: User:Polarlys, Lizenz: CC BY-SA 3.0
Bahnen des Rückenmarks (Querschnitt)
Autor/Urheber: Tomáš Kebert & umimeto.org, Lizenz: CC BY-SA 4.0
human spinal cord with meninges
Autor/Urheber: PaulWicks, Lizenz: CC BY-SA 4.0
Diagram of a human highlighting the areas affected by amyotrophic lateral sclerosis (ALS) including the upper motor neurons, lower motor neurons, and frontotemporal region of the brain, along with the muscles affected as a result
Autor/Urheber: Akiyao from the University of Michigan Medical School, Lizenz: CC BY-SA 3.0
Oligodendrocyte & Astrocyte cells
Hypothese für chronische Exzitotoxizität