Kontralateralität des Vorderhirns
Die Kontralateralität des Vorderhirns (von lateinisch: contra ‚gegen‘; latus ‚Seite‘, lateral ‚seitlich‘) verweist darauf, dass die Seiten des Großhirns und die des Thalamus jeweils überwiegend die kontralaterale Seite des Körpers repräsentieren. Das heißt, die rechte Hirnseite repräsentiert überwiegend die linke Körperhälfte und die linke Hirnseite die rechte Körperhälfte. Diese kontralaterale Repräsentation betrifft sowohl die Motorik (beispielsweise bewirkt ein linksseitiger Hirninfarkt eine rechtsseitige Hemiplegie) als auch die Sinne. Die Kontralateralität des Vorderhirns betrifft alle Wirbeltiere, aber keinen einzigen Wirbellosen.
Die kontralaterale Repräsentation ist keineswegs vollständig. Einige Ausnahmen sind erwähnenswert:
- Der Geruchssinn ist über die Riechbahn mit der jeweils gleichseitigen (ipsilateralen) Hirnhälfte verbunden.
- Die Sehbahnen kreuzen sich im Chiasma opticum nur teilweise, so dass beide Hirnhälften durch beide Augen „schauen“.
- Bei Haifischen überkreuzen sich die Sehbahnen komplett, und dann im Mittelhirn erneut, so dass das Sehzentrum im Vorderhirn eine ipsilaterale Repräsentation hat.
- Zudem sind manche Funktionen im Großhirn stark lateralisiert (beispielsweise befinden sich die Sprachzentren bei den meisten Menschen links).
- Die übergroße Mehrheit der Verbindungen im Zentralnervensystem ist überwiegend beidseitig, so dass immer ein Teil der Verbindungen von und nach dem Vorderhirn die eigene Seite (ipsilateral) verbindet (aber eben nur eine Minderheit der Verbindungen). Wenn eine Läsion im frühen Kindesalter auftritt, kann eine Hemiplegie vollständig überwunden werden.
Evolution
Die Evolution der Kreuzungen im ZNS ist aus der Sicht der Paläoneurologie schwierig, da aus fossilen Schädeln nur die äußere Form des Gehirns und der Hirnnerven abzuleiten ist[1] und weil die nächsten Verwandten von Wirbeltieren, Manteltiere und Lanzettfischchen, kein echtes Gehirn besitzen.
Allerdings ist bekannt, dass die Kontralateralität des Vorderhirns bei allen Wirbeltieren auftritt.[2][3] Auch sind keine wirbellosen Tiere mit einer Kontralateralität in Teilen des Nervensystems bekannt. Zum Beispiel haben sowohl die Arthropoden (Gliederfüßer) als auch die Cephalopoden (Kopffüßer) keine überwiegend kontralaterale Repräsentation ausgebildet.[3]
Anatomie
Ein Chiasma ist eine Überkreuzung eines Hirnnervs außerhalb des Zentralen Nervensystems (ZNS), eine Dekussierung ist die Kreuzung einer Nervenbahn innerhalb des ZNS.
Von den Hirnnerven kreuzen der Sehnerv (Chiasma opticum des N. II), der Nervus trochlearis (dorsales Chiasma des N. IV) und ein Teil des Nervus oculomotorius (Dekussierung des N. III).
Wenig bekannt ist, dass das Gehör auch eine überwiegend kontralaterale Repräsentation in der auditiven Rinde besitzt.[4][5]
Es gibt zwei Arten von Dekussationen: zum einen eine Überkreuzung im gleichen Segment, wo die Nervenzelle ansetzt (origo), und zum anderen eine Überkreuzung in ein anderes Segment. Überkreuzungen der ersten Art sind extrem häufig und kommen bei allen Tieren vor (auch bei allen Wirbellosen) und in allen Teilen des ZNS. Bekannte Beispiele sind das Corpus callosum im Großhirn und die Müller- und Mauthner-Zellen, die bei Fischen für den Schreckreflex verantwortlich sind.[6][7]
Überkreuzungen der zweiten Art kommen (soweit bekannt) nur bei Wirbeltieren vor und nur bei Nervenzellen, die vom Vorderhirn zum weiteren ZNS verlaufen oder umgekehrt. Die Überkreuzungen dieser zweiten Art verursachen die Kontralateralität des Vorderhirns.
Anatomie einiger Trakte
Es wurden für die folgende Darstellung Trakte ausgewählt, die unterschiedliche motorische wie sensorische Systeme miteinander verbinden. Ein Großteil der in der Tabelle aufgeführten Informationen basiert auf Tierstudien oder wurde aus diesen abgeleitet.[8] Die Spalte „Kreuzung“ ist der Übersicht halber auf die drei Möglichkeiten ipsi-, bi- oder kontralateral reduziert. Für genauere Angaben sei auf die zu Grunde liegenden Quellen verwiesen. Die Informationen beziehen sich auf die Lage des Hirnareals zum jeweiligen innervierten Körperanteil.
| Ipsilateral | Kontralateral | Bilateral | |
|---|---|---|---|
| Rückenmark | Spinalganglien, Neurone des Rückenmarks | ||
| Medulla oblongata | Nucleus cuneatus/Nucleus gracilis, Nucleus spinalis nervi trigemini, Nucleus nervi hypoglossi, Nuclei vestibulares laterales, Nucleus cochleares | Nucleus olivaris inf. | Nuclei vestibularis medialis, Formatio reticularis, Nucleus ambiguus |
| Cerebellum | Ausschließlich ipsilateral | ||
| Pons | Nucleus nervi abducentis, Nucleus motorius nervi facialis | Nuclei pontis, Nucleus trapezoideum | Formatio reticularis, Nucleus motorius nervi trigemini, Nucleus faciales superior |
| Mesencephalon | Nervus oculomotorius (teilweise) | Nucleus ruber, Colliculi inferiores, Colliculi superiores, Substantia nigra, Nervus trochlearis, Nervus oculomotorius (teilweise) | |
| Diencephalon | Ausschließlich kontralateral | ||
| Telencephalon | Geruch | visueller-, motorischer-, somatosensorischer-, auditiver Cortex |
Entwicklungs und Erbstörungen
Theorien und Erklärungsansätze
Seit mehr als einem Jahrhundert gibt es Theorieansätze, die versuchen, eine plausible Erklärung dafür zu geben, dass allein Wirbeltiere – und zwar alle von diesen – ein kontralateral organisiertes Vorderhirn besitzen.
Visuelle Karte-Theorie

O=Chiasma opticum;
C=Visuelle Rinde (und Motorische Rinde);
M, S=gekreuzte motorische und sensorische Bahnen von und aus dem Rückenmark;
R, G: Sensorische und motorische Ganglien und Nerven.

Die visuelle Karte-Theorie wurde 1899 vom Neurowissenschaftler und Nobelpreisträger Santiago Ramón y Cajal entwickelt.[9] Nach seiner Vorstellung hat das Chiasma opticum einen evolutionären Vorteil, weil es eine ganzheitliche visuelle Karte aus der linken und rechten Hälfte des visuellen Gesichtsfeldes ermöglichen würde (siehe Cajal's Abbildung).
Die Pupille verursacht, dass das Bild auf der Netzhaut umgekehrt ist: Sowohl oben und unten als auch links und rechts sind dadurch vertauscht (vgl. Camera obscura). Daher befindet sich die Mitte des jeweiligen halben Gesichtsfelds auf der Außenseite der Netzhaut. Die Sehbahnen aus dem linken und rechten Auge kreuzen sich im Chiasma opticum und verlaufen weiter über das Corpus geniculatum laterale im Thalamus zur Sehrinde an der Rückseite des Großhirns. Durch die Überkreuzung im Chiasma opticum würde die Mitte des linken und rechten Gesichtsfeldes wieder zusammengebracht werden, wie Cajal in seinem Schema dargestellt hat (Pfeil bei Buchstabe C). Wie unten beschrieben geht Cajal's Idee jedoch nicht auf, da sich in der Sehbahn ein weiteres Chiasma befindet.
Cajal hat seine Theorie weiterentwickelt und für Tiere mit frontalen Augen (wie beim Menschen) angewendet. Ferner hat er daraus eine kontralaterale motorische Repräsentation im Vorderhirn abgeleitet (Siehe Cala's Schema, Buchstaben S und M).
Resonanz
Ramón y Cajals Theorie hat sich bis heute gehalten.[10][11] Neuerdings wurde versucht, Cajals Theorie eine entwicklungsbiologische und evolutionstheoretische Grundlage zu geben: Der Neurologe R. G. Loosemore hat die möglichen Entwicklungsstadien[12] und Evolutionsstadien[13] vom einzelnen medianen Auge bis zum Augenpaar mit Chiasma opticum beschrieben. Als wichtiges Argument für seine Theorie führte Loosemore das Vorkommen der Entwicklungsstörung Zyklopie an.[14]
Kritik
Cajals Theorie weist einige gravierende Fehler auf, wie von de Lussanet und Osse beschrieben.[3] Entscheidend jedoch ist, dass sich in der Sehbahn zwischen Thalamus und Sehrinde (die sog. Sehstrahlung, Radiatio optica) ein weiteres Chiasma befindet. Dadurch liegt die Mitte des Sehfeldes trotzdem nicht auf der medianen Seite der linken und rechten Sehrinde, sondern außen (siehe Abbildung der Retinotopen-Karte). Folglich hat das Chiasma opticum keinen evolutionären Vorteil und ist die visuelle Karte-Theorie falsifiziert.
Verdrehungstheorien


Nach einem weiteren Ansatz habe die Kontralateralität keinen direkten evolutionären Vorteil, sondern sei ein Überbleibsel aus der frühen evolutionären Vergangenheit, die sich in der Ontogenese verewigt hat. Es gibt zwei solcher Theorien, die unabhängig voneinander entwickelt wurden.
Somatische Verdrehungstheorie
Die somatische Verdrehungstheorie (engl.: Somatic twist theory) hat ihren Ursprung in den 1970er Jahren,[15] wurde allerdings erst 2013 veröffentlicht.[16] Nach dieser Theorie ist die vordere Kopfseite von Wirbeltieren (inkl. Vorderhirn, Geruch und Augen) um 180° um die Körperachse gedreht. Die Theorie wurde auch als Alternative zur dorsoventralen Inversionstheorie entwickelt.
Axiale Verdrehungstheorie
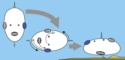
Die axiale Verdrehungstheorie (engl.: Axial twist theory, Verdrehung um die Längsachse) wurde 2012 von M. H. E. de Lussanet und W. M. Osse veröffentlicht.[3] Diese Theorie verbindet ein evolutionäres Szenario mit der Entwicklung in der frühen Embryogenese. Nach dem evolutionären Szenario (siehe Abbildung) ist ein Vorfahre aller Wirbeltiere zur Seite gedreht, was zu entgegengesetzten Kompensationen im Leib und im vorderen Kopfbereich geführt hat, was eine Verdrehung um die Körperachse zur Folge hatte. Solche Verdrehungen finden tatsächlich statt und wurden in der frühen Entwicklung von Hühnern und Fischen nachgewiesen. Außerdem sind ähnliche Verdrehungen bei allen Tiergruppen zu finden, die mit den Wirbeltieren am nächsten verwandt sind (Manteltiere, Lanzettfischchen, Echinodermen, Hemichordaten (Flügelkiemer)), so dass ein solches evolutionäres Szenario plausibel ist.
Die axiale Verdrehungstheorie erklärt eine Reihe von bislang unerklärlichen Phänomenen, beispielsweise die Schieflage des Herzens und der Eingeweide sowie des asymmetrischen Aortenbogens. Das Gehirn würde im Durchschnitt etwas schief im Kopf liegen, was tatsächlich vorgefunden wurde (die sog. Petalia und yakovlevianische Torsion).[17] Bei einer häufigen Entwicklungsstörung, Holoprosencephalie, liegt das Großhirn extrem schief oder sogar quer im Kopf (und ist in solchen Fällen manchmal sehr kleinwüchsig).[18] Einige Entwicklungsstörungen werden durch die axiale Verdrehungstheorie erklärt: Siamesische Zwillinge mit nur einem Kopf bilden zwei Wirbelsäulen mit Rückenmark, die jedoch auf der linken und rechten Körperseite gebildet werden. Eine seltene Form, die Janiceps Zwillinge, haben zwei Gesichter (vorne und hinten) und zwei zentrale Nervensysteme, die jedoch auf der linken und rechten Körperseite liegen.[19] Solche Fehlentwicklungen zeigen eine starke Evidenz für die Theorie, denn sie zeigen die Folgen, wenn die Verdrehung nicht möglich ist.
Die Unterschiede zwischen den beiden Verdrehungstheorien wurden in der wissenschaftlichen Literatur besprochen.[20] Somit ist die axiale Verdrehungstheorie die am besten belegte Theorie, obwohl auch hier noch unabhängige Untersuchungen ausstehen.
Weitere Theorien und Thesen
Es gibt eine Reihe von weiteren Erklärungsansätzen, die jeweils versuchen, einige Phänomene zu erklären.
Verzweigungstheorie
Die Verzweigungstheorie (engl.: Parcellation theory) stellt E. O. Ebbesson auf, der von der These ausgeht, dass mit der Größenzunahme des zentralen Nervensystems immer mehr Kerne der lokalen Spezialisierung entstanden sind. Diese können auf der einen oder anderen Seite liegen und der Zufall bestimmt, ob die Verbindungen eher ipsilateral oder gekreuzt verlaufen.[21] Diese Theorie wäre mit statistischen Verfahren zu untersuchen, aber ein solcher Test steht noch aus.
Sensomotorische Kontrolle
Einige Studien haben sich mit den Effekten von ipsilateralen und kontralateralen Verbindungen vom Auge zu den Beinen und Flossen von Fischen und Landtieren beschäftigt. Loeb (1918) und Bertin (1994) entwickelten die These, dass kontralaterale Verbindungen optimal sind.[22][23] Braitenberg (1984) hingegen hat in einer Studie gezeigt, dass sowohl ipsi- als auch kontralaterale Verbindungen wesentlich sind.[24]
Funktionelle Schleifenhypothese
Die funktionelle Schleifenhypothese ist eine auf den Menschen zugeschnittene Hypothese. Die Idee ist, dass der Aufbau des ZNS vom Ausmaß der Spezialisierung des jeweiligen Abschnittes bestimmt wird. Kreuzungen sind demnach ein Zeichen weit fortgeschrittener Differenzierung.[25]
Bei oberflächlicher Betrachtung entspricht die Anordnung der einzelnen Abschnitte des ZNS zueinander tendenziell einer Reihenfolge der aufsteigenden Komplexität: Spinalganglien, Rückenmark, Hirnstamm, Cerebellum, Mesencephalon, Diencephalon, Basalganglien und Großhirnrinde. Die Entstehung des Chiasma opticum wird wie folgt begründet. Entsprechend dem Einfall des Lichtes auf die Augen, also in Richtung des Stimulus, wachsen die Axone aus und kreuzen sich je nach Augenstellung teilweise oder vollständig. Außerdem befindet sich der visuelle Cortex sehr weit vom eigentlichen Sehorgan entfernt, was der Theorie nach die hohe Spezialisierung und intensive Nutzung des Sehapparates widerspiegelt. Der Geruchssinn ist weniger differenziert beim Menschen ausgebildet und corticale Areale liegen demnach näher am Sinnesorgan.
3-D-Vernetzungshypothese
Die 3-D-Vernetzungshypothese (engl.: 3-D Wiring hypothesis) basiert auf dem geordneten Verlauf der Nervenbahnen, ähnlich wie die Theorie des Ramón y Cajal (siehe oben).[26] Wenn man sich vorstellt, dass man die rechte Körperseite feingeordnet mit dem Gehirn verbindet, passt dies besser auf den linken statt auf den rechten Cortex. Diese Hypothese vergisst, dass das Cerebellum und die Kerne im Hirnstamm nicht kontralateral verbunden sind und erklärt auch nicht das Chiasma opticum.
Informationshypothese
Im Jahre 2010 hat Banihani und drei Jahre später zusammen mit Whitehead zwei Hypothesen zur Kreuzung der Fasertrakte im ZNS publiziert, nämlich ob die Informationen mehrfach oder nur einmal das Gehirn erreichen. Letzteres war bei Lebewesen ohne Extremitäten der Fall. Diese erfuhren einen gleichseitigen sensorischen Informationsfluss und besaßen eine ebenfalls gleichseitige motorische Innervation der Muskulatur. Die Entwicklung der Extremitäten führe das erste Mal dazu, dass unterschiedliche Informationen beider Körperhälften verarbeitet werden müssen. Bilaterale Informationen werden jedoch weiterhin bilateral übertragen. Für seitenspezifische Informationen gäbe es prinzipiell zwei Verknüpfungsoptionen: ipsi- oder kontralateral. Überlegen ist nach der Ansicht von Banihani die kontralaterale Variante.[27] Nach dieser Hypothese müssten Fische, insbesondere Kieferlose, keine Kontralateralität im Vorderhirn aufweisen, was jedoch der Fall sein dürfte.
Verletzungskorrelationshypothese
Nach der Hypothese von Whitehead und Banihani sollen anatomische Bauweisen, welche die Wahrscheinlichkeit einer möglichen Einschränkung der Mobilität reduzieren, im Laufe der Evolution bevorzugt werden. Genau diese Funktion schreiben die Autoren dem kontralateralen Verlauf zu.[28]
Die Funktion der Motorik hängt im Wesentlichen von zwei Variablen ab: einem funktionsfähigen Gehirn und einem ebenso funktionsfähigen Bewegungsapparat. Kommt es zur Beschädigung einer Variablen, so hat dies weitreichende Folgen für die Nahrungssuche, den Schutz vor Prädatoren, für das Paarungsverhalten u.v.m. Evolutionär betrachtet, sind dabei Schädigungen mittleren Grades besonders folgenschwer, da schwerste Verletzungen mit dem Tod enden, jedoch solche leichten Grades das motorische System kaum beeinflussen. Wenn sowohl das Gehirn als der Körper auf einer Seite nur leicht verletzt werden, können sie von der jeweils nicht verletzten Körperseite beziehungsweise der nichtverletzten Hirnseite kompensiert werden.
Einzelnachweise
- ↑ Janvier, P. (1996). Early vertebrates. Oxford University Press
- ↑ Nieuwenhuys, R., Donkelaar, H. J., Nicholson, C., Smeets, W. J. A. J., and Wicht, H., The central nervous system of vertebrates. Springer, New York (1998) ISBN 978-3-540-56013-5. doi:10.1007/978-3-642-18262-4
- ↑ a b c d M. H. E. de Lussanet, & J. W. M. Osse (2012). An ancestral axial twist explains the contralateral forebain and the optic chiasm in vertebrates. Animal Biology (62), 193-216. Abgerufen am 12. Januar 2016. freie PDF-Version, doi:10.1163/157075611X617102
- ↑ van der Loo, E., Gais, S., Congedo, M., Vanneste, S., Plazier, M., Menovsky, T., Van de Heyning, P., and De Ridder, D. (2009). Tinnitus intensity dependent gamma oscillations of the contralateral auditory cortex. PLoS ONE, 4(10):e7396. doi:10.1371/journal.pone.0007396
- ↑ H. E. Heffner, R. S. Heffner: Unilateral auditory cortex ablation in macaques results in a contralateral hearing loss. In: Journal of neurophysiology. Band 62, Nummer 3, September 1989, S. 789–801, PMID 2769359.
- ↑ C. M. Rovainen: Physiological and anatomical studies on large neurons of central nervous system of the sea lamprey (Petromyzon marinus). I. Müller and Mauthner cells. In: Journal of neurophysiology. Band 30, Nummer 5, September 1967, S. 1000–1023, PMID 6069724.
- ↑ C. B. Kimmel, S. L. Powell, W. K. Metcalfe: Brain neurons which project to the spinal cord in young larvae of the zebrafish. In: The Journal of comparative neurology. Band 205, Nummer 2, Februar 1982, S. 112–127, doi:10.1002/cne.902050203, PMID 7076887.
- ↑ Crossman, A. R. Neuroanatomy. In S. Standring, Gray’s Anatomie 7, The Anatomical Basis of Clinical Practice (2008) (S. 225–392). Elsevier. ISBN 0-443-06684-1
- ↑ Ramón y Cajal, S. (1898). Estructura del kiasma optico y teoria general de los entrecruzamientos de las vias nerviosas [Deutsch: (1899): Die Struktur des Chiasma opticum nebst einer allgemeinen Theorie der Kreuzung der Nervenbahnen]. [English 2004]. Rev. Trim. Micrográfica, 3:15–65.
- ↑ R. R. Llinás: The contribution of Santiago Ramón y Cajal to functional neuroscience. In: Nature reviews. Neuroscience. Band 4, Nummer 1, Januar 2003, S. 77–80, doi:10.1038/nrn1011, PMID 12511864.
- ↑ S. Vulliemoz, O. Raineteau, D. Jabaudon: Reaching beyond the midline: why are human brains cross wired? In: The Lancet. Neurology. Band 4, Nummer 2, Februar 2005, S. 87–99, doi:10.1016/S1474-4422(05)00990-7, PMID 15664541 (Review).
- ↑ Loosemore, R. G. (2009). The inversion hypothesis: A novel explanation for the contralaterality of the human brain. Bioscience Hypotheses, 2(66):375–382.
- ↑ R. G. Loosemore (2011). The evolution of forebrain contralaterality as a response to eye development: the path of least resistance. Hyp. Life Sci., 1(1):9–19.
- ↑ Z. M. Varga, J. Wegner, M. Westerfield: Anterior movement of ventral diencephalic precursors separates the primordial eye field in the neural plate and requires cyclops. In: Development. Band 126, Nummer 24, Dezember 1999, S. 5533–5546, PMID 10572031.
- ↑ M. Kinsbourne. Asymmetrical function of the brain. Cambridge University Press, Cambridge. S. 5. 1978.
- ↑ M. Kinsbourne: Somatic twist: a model for the evolution of decussation. In: Neuropsychology. Band 27, Nummer 5, September 2013, S. 511–515, doi:10.1037/a0033662, PMID 24040928.
- ↑ A. W. Toga and P. M. Thompson (2003). Mapping brain asymmetry. Nat. Rev. Neurosci., 4(1):37–48. doi:10.1038/nrn1009
- ↑ E. M. Simon, R. F. Hevner, J. D. Pinter, N. J. Clegg, M. Delgado, S. L. Kinsman, J. S. Hahn, A. J. Barkovich (2002) The middle interhemispheric variant of holoprosencephaly. Am. J. Neuroradiol. 23, 151–155.
- ↑ D. Viggiano, L. Pirolo u. a.: Testing the model of optic chiasm formation in human beings. In: Brain research bulletin. Band 59, Nummer 2. Oktober 2002, S. 111–115, PMID 12379441.
- ↑ M. H. de Lussanet, J. W. Osse: Decussation as an axial twist: A comment on Kinsbourne (2013). In: Neuropsychology. Band 29, Nummer 5, September 2015, S. 713–714, doi:10.1037/neu0000163, PMID 25528610. doi:10.7287/peerj.preprints.432v2
- ↑ S. O. Ebbesson: The parcellation theory and its relation to interspecific variability in brain organization, evolutionary and ontogenetic development, and neuronal plasticity. In: Cell and tissue research. Band 213, Nummer 2, 1980, S. 179–212, PMID 7459999.
- ↑ R. J. V. Bertin (1994) Natural smartness in hypothetical animals: Of paddlers and glow balls. PhD thesis, Universiteit Utrecht.
- ↑ J. Loeb (1918) Forced movements, tropisms and animal conduct. Lippincott. Republished 1973, Dover, New York.
- ↑ V. Braitenberg (1984) Vehicles-experiments in synthetic psychology. MIT Press, Cambridge, MA.
- ↑ S. J. Kashalikar: An explanation for the development of decussations in the central nervous system. In: Medical Hypotheses. Band 26, Nummer 1, Mai 1988, S. 1–8, PMID 3398785.
- ↑ T. Shinbrot, W. Young: Why decussate? Topological constraints on 3D wiring. In: Anatomical record (Hoboken, N.J. : 2007). Band 291, Nummer 10, Oktober 2008, S. 1278–1292, doi:10.1002/ar.20731, PMID 18780298.
- ↑ S. M. Banihani: Crossing of neuronal pathways: is it a response to the occurrence of separated parts for the body (limbs, eyes, etc.) during evolution? In: Medical Hypotheses. Band 74, Nummer 4, April 2010, S. 741–745, doi:10.1016/j.mehy.2009.10.037, PMID 19926228.
- ↑ L. Whitehead, S. Banihani: The evolution of contralateral control of the body by the brain: is it a protective mechanism? In: Laterality. Band 19, Nummer 3, 2014, S. 325–339, doi:10.1080/1357650X.2013.824461, PMID 23931149.
Auf dieser Seite verwendete Medien
Autor/Urheber: Marc H E de Lussanet, Lizenz: CC BY-SA 4.0
Possible evolutionary scenario of the axial twist hypothesis published by de Lussanet and Osse (2012)
Autor/Urheber: Marc H E de Lussanet, Lizenz: CC BY-SA 4.0
Developmental schema of the axial twist hypothesis published by de Lussanet and Osse (2012)
Cajal's Darstellung seiner Theorie. O= Chiasma Optica; C=Visuelle Rinde (und Motorische Rinde); M, S=gekreuzte motorische und sensorische Bahnen von und aus dem Rückenmark; R, G: Sensorische und motorische Ganglien und Nerven.