Konformation


Die Konformation beschreibt in der Chemie die räumliche Anordnung der Atome eines Moleküls bei gegebener Konstitution und Konfiguration. Konformationen entstehen durch Rotation um Einfachbindungen. Durch eine Konformation sind somit die dreidimensionalen Raumkoordinaten aller Atome des Moleküls vollständig beschrieben.
Die Konformation enthält damit auch die Information über die Stereochemie, also die Konfiguration, aller stereotopen Atome und über die Konstitution des Moleküls.
Moleküle mit gleicher Konfiguration, die sich jedoch in der spezifischen Anordnung der Atome unterscheiden und in einem Energieminimum liegen, bezeichnet man als Konformere; synonym dazu ist auch die Bezeichnung Rotamer gebräuchlich. Zu deren Darstellung kann die Sägebock- und die Newman-Projektion verwendet werden. Liegen verschiedene Konformere im Gleichgewicht miteinander vor, ist das Mengenverhältnis durch eine Boltzmann-Statistik gegeben. In Abgrenzung zu den Konformeren liegt Konfigurationsisomerie vor, wenn die betreffenden chemischen Bindungen nicht drehbar sind und die Isomere nur durch Bindungsbruch ineinander überführt werden können.
Konformationen bei offenkettigen Molekülen
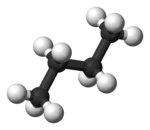
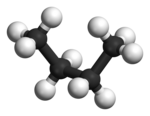
Im Beispiel ist links die gestaffelte und rechts die ekliptische Konformation des Ethans in der Newman-Projektion dargestellt. Darunter befindet sich jeweils eine Darstellung im Kugel-Stab-Modell. Während das gestaffelte Konformer das Molekül im niedrigsten, stabilsten Energiezustand darstellt, ist jenes in ekliptischer Konformation deutlich energiereicher. Die Änderung der Energie, die aus einer Rotation der Bindung von der gestaffelten zur ekliptischen Konformation resultiert, wird als Torsionsenergie bezeichnet.[1]

In Abhängigkeit vom Diederwinkel unterscheidet man bei Butan die Konformationen weiter in gestaffelt (anti) bei einem Diederwinkel von 180°, teilweise verdeckt bei 120°, windschief (gauche) bei 60° und ekliptisch bei einem Diederwinkel von 0°.[2]

Die Konformere lassen sich jedoch nicht isolieren, sondern sind nur bei tiefen Temperaturen spektroskopisch nachweisbar.[3]
Konformationen bei cyclischen Molekülen


Cycloalkane können oft in unterschiedlichen Konformationen vorkommen, die durch eine signifikante Energiebarriere voneinander getrennt sind, so dass die Konformere nebeneinander nachweisbar sind.
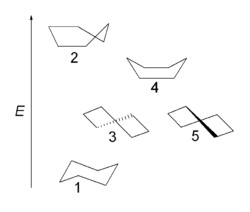
Die Twist-, die Wannen- und die Sesselkonformation sind Konformationen von cyclischen Molekülen wie Cyclohexan. Im Vergleich zur Wannenkonformation oder auch Boot-Konformation ist die Twistkonformation leicht verdreht. Dadurch werden die Wechselwirkungen zwischen den beiden H-Atomen, die an den beiden Wannenspitzen sitzen, schwächer und die Pitzer-Spannung kleiner (die H-Atome stehen nicht genau ekliptisch). Die Baeyer-Spannung wird zwar durch das leichte Verdrehen des Rings geringfügig größer, doch gleicht dies die dafür wegfallende Van-der-Waals-Abstoßung zwischen den beiden an den Wannenspitzen sitzenden H-Atomen aus. Die Twistkonformation ist darum um etwa 5,9 kJ/mol (1,4 kcal/mol) stabiler als die Wannenform und stellt wie die Sesselform ein Konformer dar. Da die Wannenform ebenfalls energiereicher ist als die Sesselkonformation, treten Verbindungen wie Cyclohexan fast ausschließlich in der nahezu spannungsfreien Sesselkonformation auf. Weil es möglich ist, das Molekül in zwei Richtungen zu verdrehen, gibt es zwei energetisch gleichwertige Twistkonformationen.
- Wannenkonformation des Cyclohexans
- Sesselkonformation des Cyclohexans
Ringinversion
Die Ringinversion (engl. ring flip) ist ein Phänomen, bei dem durch Rotation um Einfachbindungen eine Umwandlung cyclischer Konformere gleicher Ringformen stattfindet. Die räumlichen Positionen der Substituenten müssen dabei nicht unbedingt gleich bleiben.
Cyclohexan ist die prominenteste Verbindung, bei der die Ringinversion zu beobachten ist. Die Vorzugskonformation dieses sechsgliedrigen Ring-Alkans ist die Sesselkonformation. Entgegen den Erwartungen zeigt das 1H-NMR-Spektrum von Cyclohexan keine zwei Signale bei verschiedenen Resonanzfrequenzen für axiale und äquatoriale Wasserstoffatome, die sich in leicht unterschiedlichen chemischen Umgebungen befinden. Der ekliptische Übergangszustand, der bei der Konformationsumwandlung durchlaufen wird, ist energetisch wenig angehoben, sodass die Isomerisierung bei Raumtemperatur schnell stattfindet und nur ein Signal beobachtet werden kann. Dies ändert sich, wenn die Temperatur so stark erniedrigt wird, dass aufgrund der Energiebarriere der Isomerisierung die Umwandlung viel langsamer stattfindet. Bei der Ringinversion von Cyclohexan werden alle axialen Substituenten zu äquatorialen und alle äquatorialen zu axialen.

Die Ringinversion von Cyclohexan beginnt mit dem Übergang von der Sessel- über die Halbsessel- zur Twist-Konformation, wobei das Energiemaximum bei der Halbsessel-Konformation liegt. Über den Zwischenschritt der Wannenkonformation wandelt sich die Twist-Konformation in die spiegelbildliche Twist-Konformation um. Die Wannenkonformation stellt dabei das Energiemaximum dar. Über einen weiteren Halbsessel wird die Sessel-Konformation nach Ringinversion erreicht.

Verschiedene Substituenten verhindern das Auftreten der Ringinversion, zum Beispiel ein zweiter angefügter Ring wie im trans-Decalin. Auch acyclische Substituenten können diesen Effekt haben. Die tert-Butylgruppe im tert-Butylcyclohexan lässt nur eine Konformation zu, man bezeichnet den Substituenten daher auch als Konformationsanker. Aufgrund seines großen sterischen Anspruches verursacht er in axialer Position weitaus größere 1,3-diaxiale Spannung als die drei Wasserstoff-Substituenten, wenn er äquatorial steht. Die „Unterseite“ ändert sich bei der Ringinversion von tert-Butylcyclohexan nicht.


In Tetrahydropyran ersetzt ein Sauerstoffatom ein Kohlenstoffatom des Cyclohexanringes, so dass die Sesselkonformere asymmetrisch sind. Dies kann man auch durch eine spezielle Schreibweise verdeutlichen. Denkt man sich eine Ebene, die von drei C-Atomen und dem O-Atom gebildet wird, befindet sich ein Kohlenstoffatom unterhalb und eines oberhalb dieser Ebene (vgl. Bild). Wenn die Ringatome nummeriert sind, wird der Ring durch die Atome C2-C3-C5-O gebildet; C1 liegt unterhalb, C4 oberhalb jener Ebene. Dies bezeichnet man dann als die 4C1-Konformation. Der alternative Sessel (im Bild rechts) hat dann die 1C4-Konformation.

Das substituierte Tetrahydropyran D-Glucose nimmt bevorzugt die 4C1-Konformation ein, bei der der größte Substituent, die Hydroxymethylgruppe, in der äquatorialen Stellung vorliegt (vgl. Bild, 1). In der 1C4-Konformation (2) würde dieser aber axial positioniert werden, so dass in bei β-D-Glucose dieser mit zwei weiteren Substituenten wechselwirkt (1,3-syn-axial). Dies führt zu einer großen 1,3-diaxialen Spannung. Auch andere Hydroxygruppen interagieren axial zueinander. Insgesamt destabilisieren diese Wechselwirkungen die 1C4-Konformation.[4]
In Glucopyranosen liegt der größte Substituent daher in der äquatorialen Stellung, wenn dadurch möglichst wenige sterische Wechselwirkungen zu anderen Substituenten ausgebildet werden. Dies ist bei D-Zuckern allgemein durch die 4C1-Konformation der Fall. In L-Zucker dagegen positioniert sich die Hydroxymethylgruppe gerne äquatorial in der 1C4-Konformation.[5]

Metallocene
Metallocene, wie z. B. Ferrocen können in zwei verschiedenen Konformationen vorliegen.[6]
Siehe auch
- Konstitution (Chemie)
- Sachse-Mohrsche Theorie
Einzelnachweise
- ↑ K. Peter C. Vollhardt, Neil E. Schore, Übersetzung herausgegeben von Holger Butenschön: Organische Chemie. Weinheim 2020, ISBN 978-3-527-34582-3, S. 104.
- ↑ siehe Chemie: das Basiswissen der Chemie (Charles E. Mortimer, Ulrich Müller, Thieme (9. Auflage), Seite 529).
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie, Ausgabe 5, Georg Thieme Verlag, 2005, ISBN 978-3-13-541505-5, Google Books.
- ↑ Momcilo Miljkovic: Carbohydrates: Synthesis, Mechanisms, and Stereoelectronic Effects. Springer, Berlin 2009; S. 41.
- ↑ Momcilo Miljkovic: Carbohydrates: Synthesis, Mechanisms, and Stereoelectronic Effects. Springer, Berlin 2009; S. 40.
- ↑ N. N. Greenwood und A. Earnshaw: Chemie der Elemente, 1. Auflage, 1988, S. 408–409, ISBN 3-527-26169-9.
Quellen
- Clayden, J. Greeves, N. Warren, S. Wothers, P. (2001). Organic Chemistry, Oxford, ISBN 0-19-850346-6.
Weblinks
Auf dieser Seite verwendete Medien
Ferrocen_Conformere_Strukturformeln
Autor/Urheber: Dissolution, Lizenz: CC BY-SA 3.0
Staggered and eclipsed conformation
Eclipsed conformer
Darstellung des Ring-Flips von Cyclohexan.
Sesselkonformation von Cyclohexan
Mechanismus des Ring-Flips von Cyclohexan
A cyclohexane molecule in chair conformation. Hydrogen atoms in axial positions are shown in red, while those in equatorial positions are in blue.
I horizontally flipped {{PD-user}} image :Image:Butane-gauche-side-3D-balls.png using Gimp to give negative dihedral.
Konformation von beta-D-Glucopyranose; 1: 4C1-Konformation, 2: 1C4-Konformation
Staggered conformer
Konformation von Tetrahydropyran, links die 4C1-Konformation (das C4-Atom liegt über der Ebene), rechts die 1C4-Konformation
Die tert-Butylgruppe als Konformationsanker im tert-Butylcyclohexan
Skeletal projection of the boat conformation of cyclohexane.
Autor/Urheber: Dissolution, Lizenz: CC BY-SA 3.0
anti and gauch conformation in butane