Cobalt
| Eigenschaften | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||
| Name, Symbol, Ordnungszahl | Cobalt, Co, 27 | ||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||
| Gruppe, Periode, Block | 9, 4, d | ||||||||||
| Aussehen | stahlgrauer metallisch glänzender Feststoff[1] | ||||||||||
| CAS-Nummer | |||||||||||
| EG-Nummer | 231-158-0 | ||||||||||
| ECHA-InfoCard | 100.028.325 | ||||||||||
| Massenanteil an der Erdhülle | 37 ppm (29. Rang)[2] | ||||||||||
| Atomar[3] | |||||||||||
| Atommasse | 58,933194(3)[4] u | ||||||||||
| Atomradius (berechnet) | 135 (152) pm | ||||||||||
| Kovalenter Radius | low-spin: 126 pm, high-spin: 150 pm | ||||||||||
| Elektronenkonfiguration | [Ar] 3d7 4s2 | ||||||||||
| 1. Ionisierungsenergie | 7.88101(12) eV[5] ≈ 760.4 kJ/mol[6] | ||||||||||
| 2. Ionisierungsenergie | 17.0844(12) eV[5] ≈ 1648.39 kJ/mol[6] | ||||||||||
| 3. Ionisierungsenergie | 33.50(6) eV[5] ≈ 3232.3 kJ/mol[6] | ||||||||||
| 4. Ionisierungsenergie | 51.27(10) eV[5] ≈ 4947 kJ/mol[6] | ||||||||||
| 5. Ionisierungsenergie | 79.50(20) eV[5] ≈ 7671 kJ/mol[6] | ||||||||||
| Physikalisch[3] | |||||||||||
| Aggregatzustand | fest | ||||||||||
| Modifikationen | 2 | ||||||||||
| Kristallstruktur | hexagonal | ||||||||||
| Dichte | 8,90 g/cm³ (20 °C)[7] | ||||||||||
| Mohshärte | 5,0 | ||||||||||
| Magnetismus | ferromagnetisch | ||||||||||
| Schmelzpunkt | 1768 K (1495 °C) | ||||||||||
| Siedepunkt | 3173 K[8] (2900 °C) | ||||||||||
| Molares Volumen | 6,67 · 10−6 m3·mol−1 | ||||||||||
| Verdampfungsenthalpie | 390 kJ·mol−1[8] | ||||||||||
| Schmelzenthalpie | 17,2[9] kJ·mol−1 | ||||||||||
| Schallgeschwindigkeit | 4720 m·s−1 | ||||||||||
| Spezifische Wärmekapazität | 421[2] J·kg−1·K−1 | ||||||||||
| Austrittsarbeit | 5,0 eV[10] | ||||||||||
| Elektrische Leitfähigkeit | 16,7 · 106 S·m−1 | ||||||||||
| Wärmeleitfähigkeit | 100 W·m−1·K−1 | ||||||||||
| Chemisch[3] | |||||||||||
| Oxidationszustände | 0, +1, +2, +3, +4, +5[11] | ||||||||||
| Normalpotential | −0,28 V (Co2+ + 2 e− → Co) | ||||||||||
| Elektronegativität | 1,88 (Pauling-Skala) | ||||||||||
| Isotope | |||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||
| NMR-Eigenschaften | |||||||||||
| |||||||||||
| Sicherheitshinweise | |||||||||||
| |||||||||||
| Toxikologische Daten | |||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||
Cobalt (chemische Fachsprache; lateinisch cobaltum, standardsprachlich Kobalt; vom Erstbeschreiber Georg Brandt (1694–1768) nach dem Kobalterz als Ausgangsmaterial Cobalt Rex benannt[14][15]) ist ein chemisches Element mit dem Elementsymbol Co und der Ordnungszahl 27. Es steht in der 9. Gruppe bzw. Cobaltgruppe des Periodensystems. In der älteren Zählweise zählt es zur 8. Nebengruppe oder Eisen-Platin-Gruppe.
Cobalt ist ein silbergraues, hartes und eher sprödes Metall, welches bereits seit 1739 bekannt ist. Es wird in Akkumulatoren, Katalysatoren, blauen Pigmenten (die u. a. benutzt werden, um Kobaltglas herzustellen) sowie in Legierungen verwendet. Als Bestandteil von Vitamin B12 ist Cobalt zudem für alles menschliche und tierische Leben essenziell. Darüber hinaus ist Cobalt wie seine Nachbarn Eisen und Nickel ferromagnetisch.
Geschichte
Cobaltpigmente mit ihrer blauen Farbe sind schon seit langer Zeit bekannt. Diese wurden für das Färben von Glas (Cobaltglas), Keramiklasuren und als Porzellanfarbe genutzt. In Eridu (Mesopotamien) wurde ein 2000 v. Chr. entstandenes cobalthaltiges blaues Glasstück gefunden.[16] Im Alten Ägypten begann die größere Produktion von Cobaltglas in der 18. Dynastie (etwa 1550 v. Chr.) Hierfür wurde wahrscheinlich cobalthaltiger Alaun genutzt, der in Dachla und Charga gefunden wurde.[17] Eine weitere, schon seit dem Altertum genutzte Mine für Cobalterze, liegt in Qamsar in der Nähe von Kashan (Persien, heute Iran). Hier wurden vor allem Cobaltit und Erythrit abgebaut.[18] In China sind cobalthaltige Pigmente erstmals in der Sancai-Glasurtechnik aus der Tang-Dynastie im 7. Jahrhundert bekannt. Später, vor allem während der Yuan- und Ming-Dynastie wurden cobalthaltige Pigmente als Unterglasurfarbe für Blau-Weiß-Porzellan verwendet.[19] Anfangs wurden Cobalterze aus Persien importiert, später auch lokale Lagerstätten genutzt.[20]
Wann die Cobaltlagerstätten im Erzgebirge erstmals zur Gewinnung von Erzen genutzt wurden, ist nicht geklärt. Die 1684 erschienene Chronik Christian Meltzers nennt Peter Weidenhammer, der angeblich um 1520 in Schneeberg erstmals blaue Farbe hergestellt und nach Venedig verkauft habe. Es gibt aber auch Hinweise darauf, dass schon seit dem 12. Jahrhundert Cobaltpigmente im Erzgebirge produziert und beispielsweise nach Italien exportiert wurden. Um 1540 entwickelte Christoph Schürer gemäß Christian Lehmann in der Eulenhütte angeblich das Pigment Smalte und begründete damit die Blaufarbenwerke Böhmens und Sachsens.[21][22] Georgius Agricola nennt im 1530 entstandenen Bermannus cobaltum als ein Cobalt- oder Arsenhaltiges Mineral.[23]
1735 konnte Georg Brandt aus Smalte, den er aus Linneit hergestellt hatte, ein unbekanntes Metall gewinnen, dass er cobalt regulus nannte. Er klassifizierte es als Halbmetall, um es von den schmiedbaren „richtigen“ Metallen zu unterscheiden.[24] Nachdem andere Forscher seine Entdeckung zunächst in Zweifel gezogen hatten, bestätigte schließlich 1780 Torbern Bergman, dass es sich bei Cobalt um ein eigenständiges Metall handelt.[25]
Der Name Cobalt oder Kobalt leitet sich vom Berggeist Kobold ab. Dies beruht darauf, dass die Bergleute bei der Suche nach Silber Kobalterze für wertlos hielten und glaubten, dass ein Kobold das Silber gestohlen und ihnen dann das wertlose Cobalterz untergeschoben hätten.[22][26] Im Deutschen wurde lange Zeit Kobalt als Name des Elements verwendet. Die offizielle Schreibweise wurde 1975 von einer Kommission der Gesellschaft Deutscher Chemiker, der Schweizerischen Chemischen Gesellschaft und der Gesellschaft Österreichischer Chemiker geändert und an die international übliche Schreibweise Cobalt angepasst.[27]
Vorkommen

Cobalt ist ein seltenes Element mit einer Häufigkeit in der Erdkruste von 0,004 Prozent.[2] Damit steht es in der Liste der nach Häufigkeit geordneten Elemente an dreißigster Stelle.[7] Elementar kommt es nur äußerst selten in Meteoriten sowie im Erdkern vor. In vielen Mineralen ist Cobalt vertreten, kommt jedoch meist nur in geringen Mengen vor. Das Element ist stets mit Nickel, häufig auch mit Kupfer, Silber, Eisen oder Uran vergesellschaftet. Nickel ist dabei etwa drei- bis viermal so häufig wie Cobalt. Beide Metalle zählen zu den siderophilen Elementen und sind für basische und ultrabasische Magmatite charakteristisch.
Cobalt findet sich als Spurenelement in den meisten Böden. Es gibt eine Reihe Cobalterze, in denen sich das Cobalt durch Verwitterung oder andere Prozesse angereichert hat. Die wichtigsten sind: Cobaltit (veraltet Kobaltglanz; CoAsS), Linneit und Siegenit (veraltet und irreführend Kobaltnickelkies[28]; (Co,Ni)3S4), Erythrin (veraltet Kobaltblüte), Asbolan (veraltet Erdkobalt), Skutterudit (Speiskobalt, Smaltin, CoAs3) und Heterogenit (CoOOH). Der Cobaltgehalt der sulfidischen Erze ist aber gering, meist nur 0,1–0,3 Prozent.[29]
Die weltweit bekannten Cobalt-Reserven betragen 7,2 Millionen Tonnen, die terrestrischen Ressourcen werden auf 25 Millionen Tonnen geschätzt.[30] Die wichtigsten Erzlagerstätten befinden sich in der Demokratischen Republik Kongo[31] und in Sambia, wo das Cobalt zusammen mit Kupfer auftritt, außerdem in Kanada, Marokko, Kuba, Russland, Australien und den USA.[32] Weitere 120 Millionen Tonnen Cobalt werden in der Erdkruste auf den Böden des Atlantischen, Pazifischen und des Indischen Ozeans vermutet.[30] Das Kobalt kommt dort in Manganknollen vergesellschaftet mit Mangan, Kupfer und Nickel vor und lässt sich in einem Schmelz-Reduktionsofen als Metalllegierung gewinnen.[33]
Aufgrund der Bedeutung von Cobalt bei der Herstellung von elektronischen Geräten könnte es in den kommenden Jahren zu einer Verknappung des Angebots kommen.[34] So wurden im Dezember 2020 Bestrebungen von den Unternehmen Lockheed Martin, Deep Green und DEME bekannt, sich Zugriff auf Rohstoffe der Tiefsee, darunter auch Cobalt, zu verschaffen, deren Abbaurechte bei kleinen Inselstaaten im Südpazifik liegen. Problematisch ist, dass für den Tiefseebergbau noch keine globalen Umweltregeln bestehen.[35]
Gewinnung und Darstellung


Cobalt wird überwiegend aus Kupfer- und Nickelerzen gewonnen. Die genaue Gewinnungsart ist von der Zusammensetzung des Ausgangserzes abhängig. Zunächst wird ein Teil der vorhandenen Eisensulfide (FeS und FeS2) durch Rösten in Eisenoxid umgewandelt und mit Siliciumdioxid als Eisensilicat verschlackt. Es entsteht der sogenannte Rohstein, der neben Cobalt noch Nickel, Kupfer und weiteres Eisen als Sulfid oder Arsenid enthält. Durch weiteres Abrösten mit Natriumcarbonat und Natriumnitrat wird weiterer Schwefel entfernt. Dabei bilden sich aus einem Teil des Schwefels und Arsens Sulfate und Arsenate, die mit Wasser ausgelaugt werden. Es bleiben die entsprechenden Metalloxide zurück, die mit Schwefel- oder Salzsäure behandelt werden. Dabei löst sich nur Kupfer nicht, während Nickel, Cobalt und Eisen in Lösung gehen. Mit Chlorkalk kann anschließend selektiv Cobalt als Cobalthydroxid ausgefällt und damit abgetrennt werden. Durch Erhitzen wird dieses in Cobalt(II,III)-oxid (Co3O4) umgewandelt und anschließend mit Koks oder Aluminiumpulver zu Cobalt reduziert:
Der größte Teil von Cobalt wird durch Reduktion der Cobalt-Nebenprodukte des Nickel- und Kupferabbaus und der Schmelze gewonnen.[36][37] Weil Cobalt in der Regel als Nebenprodukt anfällt, hängt die Cobaltversorgung in hohem Maße von der wirtschaftlichen Durchführbarkeit des Kupfer- und Nickelabbaus in einem bestimmten Markt ab.[38]
Es gibt verschiedene Methoden, um Cobalt von Kupfer und Nickel zu trennen, abhängig von der Cobaltkonzentration und der genauen Zusammensetzung des verwendeten Erzes. Eine Methode ist die Schaumflotation, bei der Tenside an verschiedene Erzbestandteile binden, was zu einer Anreicherung von Cobalterzen führt. Durch anschließendes Rösten werden die Erze in Cobalt(II)-sulfat umgewandelt und Kupfer und Eisen oxidiert. Durch Auswaschen mit Wasser wird das Sulfat zusammen mit den Arsenaten extrahiert. Die Rückstände werden weiter mit Schwefelsäure ausgelaugt, was eine Kupfersulfatlösung ergibt. Cobalt kann auch aus der Kupferschmelze ausgelaugt werden.[39]
Förderung
Staaten mit der größten Fördermenge

Die Demokratische Republik Kongo ist der größte Produzent von Kobalt. Laut einer Reportage des Fachmagazins „Illuminem“ sind die Hauptproduzenten Unternehmen mit Sitz in Großbritannien (Eurasian Natural Resources) und China (China Molybdenum und Metorex). Die chinesischen Anteilseigner wiederum kontrollieren die beiden Unternehmen, auf die 13,8 % der weltweiten Produktion und etwa 24 % der Produktion großer, bekannter und aktiver Unternehmen entfallen. Unternehmen mit Sitz in der Demokratischen Republik Kongo kontrollieren dagegen nur 3,5 % der weltweiten Produktion.[40]
| Land | 2006[41] | 2013[30] | 2016[42] | 2019[43] | 2020[44] | 2022[45] |
|---|---|---|---|---|---|---|
| 22.000 | 54.000 | 66.000 | 100.000 | 98.000 | 144.000 | |
| 1.400 | 7.200 | 7.700 | 2.500 | 2.200 | ||
| 5.600 | 6.920 | 7.300 | 3.340 | 3.690 | 3.060 | |
| 5.100 | 6.300 | 6.200 | 6.300 | 9.000 | 9.200 | |
| 1.000 | 3.000 | 5.800 | ||||
| 6.000 | 6.400 | 5.100 | 5.740 | 5.630 | 5.790 | |
| 8.600 | 5.200 | 4.600 | ||||
| 4.000 | 4.200 | 4.200 | 3.800 | 3.800 | 3.700 | |
| 3.000 | 3.500 | 5.100 | 4.500 | 3.900 | ||
| 1.100 | 3.190 | 3.300 | 2.000 | |||
| 3.000 | 3.000 | 2.100 | ||||
| 1.500 | 1.700 | 2.300 | 2.300 | |||
| 3.400 | 850 | 3.500 | ||||
| 2.910 | 2.940 | 2.990 | ||||
| 1.100 | 9.600 | |||||
| 500 | 600 | 500 | ||||
| 3.400 | 850 | 2.100 | ||||
| restliche Länder | 1200 | 8000 | 8300 | 6.320 | 7.640 | 6.600 |
| Gesamt | 57.500 | 110.000 | 123.000 | 144.000 | 142.000 | 197.000 |
Cobaltproduzenten
Vielfach wird Cobalt nicht in den Ländern raffiniert, in denen Cobalterze gefördert werden. Die folgende Tabelle des Cobalt Development Instituts (CDI)[46] listet die Produzenten von metallischem Cobalt sowie Cobaltsalzen und deren Produktionsmengen in Tonnen auf:[47][48][49]
| Name | Land | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CDI- Mit- glieder | Ambatovy | Madagaskar | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2083 | 2915 | 3464 | 3273 |
| BHPB/QNPL[A 1] | Australien | 1800 | 1900 | 1400 | 1600 | 1800 | 1600 | 1700 | 2141 | 2631 | 2369 | |||||
| CTT | Marokko | 1431 | 1593 | 1613 | 1405 | 1591 | 1711 | 1600 | 1545 | 1788 | 1314 | 1353 | 1391 | 1722 | 1568 | |
| Eramet | Frankreich | 181 | 199 | 280 | 256 | 305 | 311 | 368 | 302 | 354 | 326 | 308 | 219 | 133 | 119 | |
| Freeport Cobalt, früher OMG | Finnland | 7990 | 7893 | 8170 | 8580 | 9100 | 8950 | 8850 | 9299 | 10441 | 10547 | 10010 | 11452 | 8582 | 11187 | |
| Gécamines | DR Kongo | 1200 | 735 | 600 | 550 | 606 | 300[A 2] | 415 | 745 | 650 | 870 | 700 | 500 | 400 | 400 | |
| Glencore[A 3], Katanga | DR Kongo | 2800 | 2900 | 0 | ||||||||||||
| Glencore, Minara | Australien | 2900 | 3300 | 3200 | ||||||||||||
| Glencore, Mopani Copper | Sambia | 0 | 0 | 0 | ||||||||||||
| Glencore, früher Xstrata | Norwegen | 4556 | 4670 | 5021 | 4927 | 3939 | 3719 | 3510 | 3208 | 3067 | 2969 | 3400 | 3600 | 3100 | 3500 | |
| ICCI | Kanada | 3141 | 3225 | 3391 | 3312 | 3573 | 3428 | 3721 | 3706 | 3853 | 3792 | 3319 | 3210 | 3733 | 3693 | |
| Rubamin | Indien[A 4] | 0 | 517 | 579 | 200 | 45 | ||||||||||
| Sumitomo | Japan | 379 | 429 | 471 | 920 | 1084 | 1071 | 1332 | 1935 | 2007 | 2542 | 2747 | 3654 | 4259 | 4305 | |
| Umicore[A 5] | Belgien | 1704 | 2947 | 3298 | 2840 | 2825 | 3020 | 2150 | 2600 | 3187 | 4200 | 5415 | 5850 | 6306 | 6329 | |
| Vale Inco | Kanada | 1000 | 1562 | 1563 | 1711 | 2033 | 2200 | 1193 | 940 | 2070 | 1890 | 2240 | 2051 | 1858 | 1851 | |
| Chambishi Metals | Sambia | 4570 | 3769 | 3648 | 3227 | 2635 | 2591 | 235 | 3934 | 4856 | 5435 | 5000 | 4317 | 2997 | 4725 | |
| Gesamt CDI | 27.952 | 28.922 | 29.455 | 29.328 | 29.491 | 28.901 | 25.074 | 30.872 | 35.483 | 36.454 | 36.620 | 44.859 | 42.754 | 44.150 | ||
| Nicht- CDI- Mit- glieder | China[A 6] | 4576 | 8000 | 12700 | 12700 | 13245 | 18239 | 2544 | 35929 | 34969 | 29784 | 36062 | 39292 | 48719 | 45046 | |
| Indien[A 7] | 255 | 545 | 1220 | 1184 | 980 | 858[A 2] | 1001 | 670 | 720 | 600 | 250 | 100 | 150 | 100 | ||
| Glencore[A 3], Katanga | DR Kongo | 0 | 0 | 0 | 0 | 0 | 749 | 2535 | 3437 | 2433 | 2129 | 2300 | ||||
| Kasese | Uganda | 0 | 457 | 638 | 674 | 698 | 663 | 673 | 624 | 661 | 556 | 376 | 0 | 0 | 0 | |
| Glencore[A 3], Minara | Australien | 2039 | 1979 | 1750 | 2096 | 1884 | 2018 | 2350 | 1976 | 2091 | 2400 | 2700 | ||||
| Glencore[A 3], Mopani Copper[A 2] | Sambia | 2050 | 2022 | 1774 | 1438 | 1700 | 1450 | 1300 | 1092 | 1100 | 230 | 0 | ||||
| Norilsk Nickel[A 8] | Russland | 4654 | 4524 | 4748 | 4759 | 3587 | 2502 | 2352 | 2460 | 2337 | 2186 | 2368 | 2302 | 2040 | 3092 | |
| QNPL[A 1] | Australien | 2281 | 2519 | 1850 | 0 | |||||||||||
| Südafrika | 285 | 300 | 214 | 257 | 307 | 244 | 236 | 833 | 840 | 1100 | 1294 | 1332 | 1300 | 1101 | ||
| Votorantim | Brasilien | 1097 | 1155 | 1136 | 902 | 1148 | 994 | 1012 | 1369 | 1613 | 1750 | 1653 | 1350 | 1300 | 400 | |
| DLA[A 9] | USA | 1987 | 1632 | 1199 | 294 | 617 | 203 | 180 | −8 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Gesamt Nicht-CDI | 16.943 | 20.614 | 25.379 | 24.304 | 24.166 | 27.920 | 37.183 | 48.382 | 46764 | 40.735 | 49.284 | 46.895 | 55.359 | 49.739 | ||
| Gesamt[A 10] | 44.895 | 49.536 | 54.834 | 53.632 | 53.657 | 56.821 | 59.851 | 79.252 | 82.247 | 77.189 | 85.904 | 91.754 | 98.113 | 93.889 | ||
Anmerkungen A:
- ↑ a b seit 2013 kein CDI-Mitglied mehr
- ↑ a b c geschätzt
- ↑ a b c d seit 2014 CDI-Mitglied
- ↑ von 2009 bis 2013 CDI Mitglied
- ↑ inklusive Umicore China
- ↑ ohne Umicore China
- ↑ inklusive Nicomet und Rubamin (nicht 2009 bis 2013)
- ↑ seit 2009 kein CDI-Mitglied mehr
- ↑ Defence Logistic Agency: Cobaltverkauf aus den strategischen Reserven der USA
- ↑ beinhaltet keine Mengen von Herstellern, die ihre Produktion nicht veröffentlichen
Arbeitsbedingungen
Wie bei vielen anderen Erzen erfolgt der Abbau teils unter prekären Bedingungen (insbesondere Kinderarbeit in den oft ungesicherten Minen im Kongo).[50][51][52] So wird geschätzt, dass im Kongo, wo gut die Hälfte des globalen Cobalts gefördert wird, etwa 20 % des Cobalts per Hand geschürft werden.[53]
BMW kauft Cobalt (und Lithium) seit 2020 direkt selbst bei Minen in Australien und in Marokko (Bou Azzer Mine) ein;[50] Mercedes äußerte im Jahr 2020, Cobalt (und Lithium) künftig nur aus zertifiziertem Abbau kaufen zu wollen.[52]
Eigenschaften
Physikalische Eigenschaften


Cobalt ist ein stahlgraues, sehr zähes Schwermetall mit einer Dichte von 8,89 g/cm³.[56] Es ist ferromagnetisch mit einer Curie-Temperatur von 1150 °C.[56] Cobalt tritt in zwei Modifikationen auf: einer hexagonal-dichtesten (hcp) Kristallstruktur in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 250,7 pm und c = 406,9 pm sowie zwei Formeleinheiten pro Elementarzelle und einer kubisch-flächenzentrierten Form (fcc) mit dem Gitterparameter a = 354,4 pm.[55] Die fcc-Modifikation ist dabei die duktilere, die hcp-Modifikation die sprödere Form.[57] Die hcp-Modifikation (α-Cobalt, historisch ε-Cobalt[15]) ist bei tieferen Temperaturen stabil und wandelt sich bei ca. 450 °C in die fcc-Modifikation (β-Cobalt, historisch α-Cobalt[15]) um.[58] In sehr kleinen Kristallen ist auch bei einer Temperatur unter 450 °C die fcc-Modifikation die stabilere Form.[59]
Als typisches Metall leitet es Wärme und elektrischen Strom gut, die elektrische Leitfähigkeit liegt bei 26 Prozent von der des Kupfers.[29] Nicht passiviertes Cobaltmetallpulver ist dunkelgrau und kann sich auch selbst entzünden. Das Metall in kompakter Form ist nicht brennbar.[12]
Eine Besonderheit stellt die Atommasse des natürlich vorkommenden Cobalts dar; sie ist mit 58,93 größer als die mittlere Atommasse von Nickel mit 58,69, dem nächsten Element im Periodensystem. Diese Besonderheit gibt es auch bei Argon und Kalium sowie bei Tellur und Iod.
Chemische Eigenschaften
Im chemischen Verhalten ist es dem Eisen und Nickel ähnlich, an der Luft durch Passivierung beständig; es wird nur von oxidierend wirkenden Säuren gelöst. Cobalt zählt mit einem Normalpotential von −0,277 V zu den unedlen Elementen. In Verbindungen kommt es vorwiegend in den Oxidationsstufen +II und +III vor. Es sind jedoch auch die Oxidationsstufen −I, 0, +I, +II, +III, +IV und +V in Verbindungen vertreten. Cobalt bildet eine Vielzahl von meist farbigen Komplexen. Darin ist, im Gegensatz zu kovalenten Verbindungen, die Oxidationsstufe +III häufiger und stabiler als +II.
Isotope
Es sind insgesamt 30 Isotope und 18 weitere Kernisomere zwischen 47Co und 77Co bekannt. Natürliches Cobalt besteht dabei vollständig aus dem Isotop 59Co. Das Element ist daher eines der 22 Reinelemente.[60] Dieses Isotop lässt sich durch die NMR-Spektroskopie untersuchen.
Das Nuklid 57Co zerfällt über Elektroneneinfang zu 57Fe. Die beim Übergang in den Grundzustand des Tochterkerns emittierte Gammastrahlung hat eine Energie von 122,06 keV (85,6 %) und 14,4 keV (9,16 %).[61] Hauptanwendung von 57Co ist die Mößbauerspektroskopie, z B. zum Nachweis kleinster Energie- oder Frequenzverschiebungen wie etwa zur Unterscheidung von zweiwertigem und dreiwertigem Eisen.
Cobalt-60

Das langlebigste der instabilen Isotope ist 60Co (Cobalt-60, Spin 5+), das mit einer Halbwertszeit von 5,27 Jahren durch Betazerfall zunächst in einen angeregten Zustand von 60Ni (Spin 4+) und anschließend unter Aussendung von Gammastrahlung (zwei Gammaquanten der Energie 1,17 und 1,33 MeV[62]) in den Grundzustand (Spin 0+) dieses Nuklids zerfällt. Aus diesem Grund wird 60Co als Gammastrahlungsquelle zur Sterilisierung oder Konservierung von Lebensmitteln, zur Materialuntersuchung (Durchstrahlungsprüfung) und in der Krebstherapie („Kobaltkanone“) verwendet.[63] In der Medizin können auch andere Isotope wie 57Co oder 58Co als Tracer verwendet werden.[64] 60Co wird ausschließlich künstlich durch Neutronenaktivierung aus 59Co gewonnen. Als Neutronenquelle für die Herstellung kleinerer Mengen dienen Spontanspaltungsquellen wie 252Cf; zur Herstellung größerer Mengen werden 59Co-Pellets dem Neutronenfluss in Kernreaktoren ausgesetzt. Größter Produzent ist Kanada, dessen Schwerwasserreaktoren vom Typ CANDU exzellent für die Produktion von Cobalt-60 geeignet sind.[65][66] Aufgrund der – gerade im Licht der COVID-19-Pandemie – weiter steigenden Nachfrage wird auch in Rumänien (Kernkraftwerk Cernavodă)[67] sowie in China (Kernkraftwerk Qinshan)[68] in dortigen CANDUs über eine Produktionsaufnahme nachgedacht bzw. ist diese erfolgt. Auch in anderen Reaktortypen wird oder soll Cobalt-60 produziert werden: 2018 nahm Russland am Kernkraftwerk Kursk (Typ RBMK) die Produktion von Cobalt-60 auf.[69] Des Weiteren arbeiten die Hersteller Framatome (EPR)[70] und Westinghouse (AP1000)[71] daran, in bestehenden oder noch zu bauenden Druckwasserreaktoren Cobalt-60 zu produzieren. Da Leichtwasserreaktoren deutlich häufiger und in mehr Ländern gebaut wurden als Reaktoren des CANDU-Typs, könnte eine erfolgreiche Produktion von Cobalt-60 in diesen Reaktoren helfen, die Versorgung zu verbessern.
Die Entstehung von 60Co aus 59Co unter Neutronenstrahlung könnte potentiell auch zur Verstärkung der Wirkung von Kernwaffen benutzt werden, bei denen Neutronenstrahlung entsteht, indem diese mit Cobalt ummantelt würden (Cobaltbombe). Bei der Detonation würde dann der starke Gammastrahler gebildet, durch den die Umgebung stärker kontaminiert würde als durch die Kernexplosion allein.[72] Wird 60Co nicht sachgerecht entsorgt, sondern mit anderem Cobalt eingeschmolzen und zu Stahl verarbeitet, können daraus gefertigte Stahlteile in schädlichem Maß radioaktiv sein.[73][74] Da Reaktordruckbehälter beständig dem Neutronenfluss ausgesetzt sind, kann sich – je nach Zusammensetzung des Stahls – in ihnen Cobalt-60 bilden.[75] Da der größte Teil des Eisens 56Fe ist und somit drei aufeinander folgende Neutroneneinfänge zur Erzeugung von 59Co und dann einen weiteren Neutroneneinfang im gebildeten 59Co benötigen würde, ist der Effekt in cobaltfreien Stählen allerdings sehr gering.[76]
Mit 60Co wurde 1956 das Wu-Experiment vorgenommen, durch das die Paritätsverletzung der schwachen Wechselwirkung entdeckt wurde.[77]
Verwendung

Cobalt wurde in Form von Oxiden, Sulfaten, Hydroxiden oder Carbonaten als Erstes für hitzefeste Farben und Pigmente, z. B. für die Bemalung von Porzellan und Keramik verwendet (siehe auch Smalte sowie Blaufarbenwerke). Danach folgte die wohl bekannteste dekorative Anwendung in Form des blauen Kobaltglases. Nach 1800 wurde das Cobaltaluminat (CoAl2O4) als farbkräftiges Pigment industriell hergestellt.
Als Legierungsbestandteil
Cobalt dient heute als Legierungsbestandteil zur Erhöhung der Warmfestigkeit legierter und hochlegierter Stähle, insbesondere Schnellarbeitsstahl und Superlegierungen, als Binderphase in Hartmetallen und Diamantwerkzeugen (siehe: Widia). Seine Verwendung als Legierungselement und in Cobaltverbindungen macht es zu einem strategisch wichtigen Metall. (Siehe Vitallium: Implantate, Turbinenschaufel, chemische Apparate.) Eingesetzt werden Cobaltstähle z. B. für hochbelastete Werkteile, die hohe Temperaturen aushalten müssen, wie z. B. Ventilsitzringe in Verbrennungsmotoren oder Leitschaufeln in Gasturbinen.[78]
Superlegierungen auf Cobaltbasis haben in der Vergangenheit den größten Teil des erzeugten Cobalts verbraucht.[36][37] Die Temperaturstabilität dieser Legierungen macht sie für Turbinenschaufeln von Gasturbinen und Flugzeugtriebwerken geeignet, obwohl Einkristalllegierungen auf Nickelbasis ihre Leistung übertreffen.[79] Cobaltbasierte Legierungen sind auch korrosions- und verschleißfest, sodass sie wie Titan zur Herstellung von orthopädischen Implantaten verwendet werden können, die sich mit der Zeit nicht abnutzen. Die Entwicklung verschleißfester Cobaltlegierungen begann im ersten Jahrzehnt des 20. Jahrhunderts mit den Stellitlegierungen, die Chrom mit unterschiedlichen Anteilen an Wolfram und Kohlenstoff enthielten. Legierungen mit Chrom- und Wolframcarbiden sind sehr hart und verschleißfest.[80] Spezielle Cobalt-Chrom-Molybdän-Legierungen wie Vitallium werden für Prothesenteile verwendet.[81] Cobaltlegierungen werden auch für Zahnersatz als nützlicher Ersatz für Nickel verwendet, das möglicherweise allergen ist.[82] Einige Schnellarbeitsstähle enthalten auch Cobalt, um die Wärme- und Verschleißfestigkeit zu erhöhen. Die speziellen Legierungen von Aluminium, Nickel, Cobalt und Eisen, bekannt als Alnico, sowie von Samarium und Cobalt (Samarium-Cobalt-Magnet) werden in Dauermagneten verwendet.[83]
Cobalt ist Bestandteil von magnetischen Legierungen, als Trockner (Sikkativ) für Farben und Lacke, als Katalysator zur Entschwefelung und Hydrierung, als Hydroxid oder Lithium-Cobalt-Dioxid (LiCoO2) in Batterien, in korrosions- bzw. verschleißfesten Legierungen und als Spurenelement für Medizin und Landwirtschaft. Cobalt wird ebenfalls in der Produktion magnetischer Datenträger wie Tonband- und Videokassetten verwendet, wo es durch Dotierung die magnetischen Eigenschaften verbessert. Seit geraumer Zeit dient Cobalt als Legierungsbestandteil für Gitarrensaiten.

In Akkumulatoren

Seit Lithium-Ionen-Akkumulatoren in den 1990er-Jahren auf den Markt kamen, wird Cobalt für Akkumulatoren vor allem für mobile Anwendungen eingesetzt, da der Lithium-Cobaltoxid-Akkumulator eine besonders hohe Energiedichte aufweist. Der erste kommerziell erhältliche Lithium-Ionen-Akku kam als Lithium-Cobaltdioxid-Akkumulator von Sony im Jahr 1991 auf den Markt. Lithium-Cobalt(III)-oxid wird häufig in Lithium-Ionenbatterie-Kathoden verwendet. Das Material besteht aus Cobaltoxidschichten mit eingelagertem Lithium. Während der Entladung wird das Lithium als Lithiumionen freigesetzt.[84] Nickel-Cadmium-Batterien und Nickel-Metallhydrid-Akkumulatoren enthalten auch Cobalt, um die Oxidation von Nickel im Akku zu verbessern.[85][86]
Durch den Nachfrageanstieg bei Elektroautos stieg die Nachfrage nach Cobalt an. Auch wenn der Cobaltanteil neuer Batterien rückläufig ist, wird die Nachfrage die nächsten Jahre voraussichtlich zunehmen, wenn die Verbreitung von Elektrofahrzeugen zunimmt. 2017 entfielen 8,2 % des globalen Cobaltverbrauchs auf die Elektromobilität; inklusive aller weiteren Anwendungsbereiche war die Batterieproduktion für rund 46 % des Cobaltverbauchs verantwortlich.[87]
Moderne Batterien enthielten mit Stand 2019 aufgrund besserer Zellkonstruktionen nur noch einen Bruchteil früherer Konstruktionen. Bestanden die Kathoden ursprünglich zu etwa einem Drittel aus Cobalt, sind es mit Stand 2023 nur noch 3 bis 6,5 %.[88] LiFePO4-Batterien (LFP), wie sie etwa für Batteriespeicher verwendet werden, benötigen hingegen wie die Rezepturen LMO und LTO überhaupt kein Cobalt.[89] Die etwas schwereren und billigeren LFP-Zellen werden seit 2020 auch im in China produzierten Tesla Model 3 SR+ eingesetzt.[90] Mit Stand 2023 lag der Marktanteil von kobaltfreien LPF-Akkus bei mehr als 30 %, Tendenz stark steigend.[88] Im Jahr 2021 begann die Firma SVolt mit der Produktion von cobaltfreiem Kathodenmaterial für Lithium-Ionen-Batterien, das auf Nickel und Mangan basiert.[91] Als sehr interessant gilt zudem der Umstieg auf Natrium-Ionen-Akkumulatoren, die ebenfalls kobaltfrei sind und gegenüber Lithium-Ionen-Akkus deutlich günstigere Kosten erwarten lassen.[88]
In einer Studie von 2021 wurde der Verbrauch von Cobalt und anderen Ressourcen durch deutsche PKW für die Zukunft bis ins Jahr 2035 abgeschätzt: unter der Annahme, dass dann nur noch elektrische Fahrzeuge zugelassen werden, ergibt sich ein stark erhöhter Bedarf an Kupfer, Nickel, Cobalt, Lithium und Seltenen Erden.[92]
Als Katalysator
Katalysatoren auf Cobaltbasis werden bei Reaktionen mit Kohlenstoffmonoxid eingesetzt. Cobalt ist auch ein Katalysator im Fischer-Tropsch-Verfahren zur Hydrierung von Kohlenstoffmonoxid zu flüssigen Brennstoffen.[93] Bei der Hydroformylierung von Alkenen wird häufig Cobaltoctacarbonyl als Katalysator verwendet, obwohl es häufig durch effizientere Katalysatoren auf Iridium- und Rhodiumbasis ersetzt wird, z. B. den Cativa-Prozess.[94]
Bei der Hydrodesulfurierung von Erdöl wird ein Katalysator verwendet, der von Cobalt und Molybdän abgeleitet ist. Dieses Verfahren hilft, das Erdöl von Schwefelverunreinigungen zu reinigen, die die Raffination flüssiger Brennstoffe beeinträchtigen.[95]
Im Bereich der organischen Synthese spielt die [2+2+2]-Cobalt-Zyklisierung eine bedeutsame Rolle beim schnellen Aufbau komplexer Molekülstrukturen. Hierbei kann Ethin als grundlegender Baustein in Verbindung mit funktionalisierten Indolen unter Normaldruckbedingungen und η5-Cyclopentadienylbisethylenecobalt(I) direkt zu Carbazol-Derivaten umgesetzt und zur totalsynthetischen Darstellung, z. B. von Strychnin, verwendet werden.[96]
Radionuklide

60Co ist bei weitem das bedeutendste Radionuklid des Cobalts und eines der wichtigsten künstlichen Radionuklide überhaupt. Gründe dafür sind neben der vielfältigen Nutzungsmöglichkeiten der Gammastrahlung, welche beim Zerfall von Cobalt-60 anfällt, die Einfachheit der Herstellung und die relative chemische und physikalische Beständigkeit von Cobalt. Trotz der relativ hohen Zerfallsenergie ist die Halbwertszeit von 60Co mit 5,27 Jahren verhältnismäßig hoch, so dass entsprechende Quellen relativ lange „halten“ – ein weiterer Vorteil des 60Co.
Cobalt-60 wird überwiegend in Kernreaktoren hergestellt, dabei – im Gegensatz zu manch anderem industriell oder medizinisch genutzten Radionuklid – nicht vornehmlich in Forschungsreaktoren, sondern in kommerziellen Schwerwasserreaktoren vom Typ CANDU.[97] Bei der Herstellung erweisen sich zwei Eigenschaften natürlichen Cobalts als sehr vorteilhaft: zum einen ist das Element mononuklidisch, besteht also ausschließlich aus dem stabilen Isotop 59Co. Zum anderen ist der Wirkungsquerschnitt für den Neutroneneinfang bei Cobalt-59 relativ hoch. Wird natürliches Cobalt also Neutronenstrahlung, wie sie im Inneren eines laufenden Kernreaktors anfällt, ausgesetzt, so wird nach und nach ein Teil des stabilen natürlichen Cobalts durch Einfang eines Neutrons zu radioaktiven 60Co umgewandelt.
Durch die besondere Bauform und Funktionsweise der mit natürlichem Uran betriebenen CANDU Reaktoren eignen sich diese besonders zur Produktion von 60Co. Zum Beispiel ist die Geschwindigkeit der Neutronen im Durchschnitt geringer als bei Leichtwasserreaktoren, wodurch Einfänge wahrscheinlicher werden. Dazu kommt die Fähigkeit, bei laufendem Betrieb Teile des Reaktorkerns auszutauschen, was es erlaubt, je nach Bedarf Cobalt- oder „herkömmliche“ Kontrollstäbe zur Verringerung des Neutronenflusses einzusetzen und „fertiges“ 60Co aus dem Reaktorkern zu entfernen auch wenn der Brennstoff noch nicht „abgebrannt“ ist.[98]
Cobalt-60 findet Anwendung vor allem in der nicht-thermischen Desinfektion von medizinischen Geräten – sensible Instrumente, die die Hitze im Autoklav nicht überstehen, können so sicher und ohne die Gefahr chemischer Rückstände sterilisiert werden. Auch beim Bestrahlen von Nahrungsmitteln zur Haltbarmachung wird 60Co angewandt. Vorteilhaft auch gegenüber anderen Formen der Bestrahlung ist dabei auch die große Eindringtiefe der Gammastrahlung, die es erlaubt Lebensmittel bzw. medizinische Geräte auch in der Verpackung zu bestrahlen. Rund 40 % der weltweit im Einsatz befindlichen medizinischen Geräte zum einmaligen Gebrauch werden mit Cobalt-60 aus nur einem einzigen Kernkraftwerksstandort sterilisiert – Bruce am Huronsee in Kanada.[99]
Prinzipiell denkbar wäre auch der Einsatz von 60Co als Radionuklidbatterie. Mit einer spezifischen Leistung von 13,6 W/g ist die Leistungsdichte sogar deutlich höher als bei Strontium-90 oder Plutonium-238, jedoch ist der hohe Anteil dieser Leistung, der in Form von Gammastrahlung frei wird, ebenso problematisch wie die – verglichen mit 90Sr oder 238Pu – deutlich geringere Halbwertszeit.
Physiologie
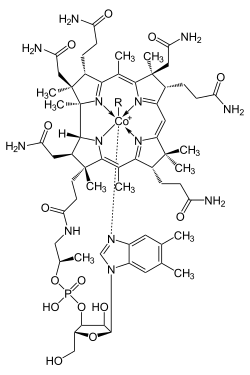

Cobalt ist Bestandteil von Vitamin B12, dem Cobalamin, das für den Menschen lebensnotwendig ist. Beim gesunden Menschen kann dieses Vitamin möglicherweise von Darmbakterien direkt aus Cobaltionen gebildet werden. Allerdings muss Cobalamin von dem im Magen produzierten Intrinsic Factor gebunden werden, um im Ileum aufgenommen werden zu können.[100] Da der Produktionsort des vom Menschen hergestellten Cobalamins jedoch im Dickdarm liegt,[101] ist eine Resorption nach aktuellem Wissensstand nicht möglich. Das Vitamin muss also zwingend durch die Nahrung aufgenommen werden. Es wird dennoch eine tägliche Zufuhr von 0,1 μg Cobalt als Spurenelement für den täglichen Bedarf für Erwachsene angegeben. Der Mangel an Vitamin B12 kann zu einer gestörten Erythropoese und damit zu Blutarmut führen.[102] Bei Wiederkäuern beruht ein solcher Mangel überwiegend auf unzureichender Cobaltzufuhr[103], die daraus resultierende Erkrankung wird als „Semper“, „Hinsch“ oder „Dörre“ bezeichnet und war vor allem im Schwarzwald häufig.[104] In der Tierproduktion wird dem Futter in Spuren Cobalt hinzugefügt, falls die Tiere von cobaltarmen Weideflächen ernährt werden müssen. Hierüber soll Wachstums- und Laktationsstörungen, Blutarmut und Appetitlosigkeit entgegengewirkt werden.[105] Cobalt und seine Verbindungen werden seit einiger Zeit zur Leistungssteigerung als Dopingmittel im Leistungs- und Pferdesport eingesetzt.[106][107] Daher gewinnen Verfahren zum sicheren Nachweis der Cobaltverbindungen an Bedeutung.[108] Bakterien im Magen von Wiederkäuern wandeln Cobaltsalze in Vitamin B12 um, eine Verbindung, die nur von Bakterien oder Archaeen produziert werden kann. Eine minimale Anwesenheit von Cobalt in Böden verbessert daher die Gesundheit weidender Tiere erheblich.[109]
Auf Cobalamin basierende Proteine verwenden Corrin, um das Cobalt zu halten. Coenzym B12 weist eine reaktive C-Co-Bindung auf, die an den Reaktionen beteiligt ist.[110] Beim Menschen hat B12 zwei Arten von Alkylliganden: Methyl und Adenosyl. Methylcobalamin fördert den Transfer von Methylgruppen. Die Adenosylversion von B12 katalysiert Umlagerungen, bei denen ein Wasserstoffatom unter gleichzeitigem Austausch des zweiten Substituenten X, der ein Kohlenstoffatom mit Substituenten, ein Sauerstoffatom eines Alkohols oder ein Amin sein kann, direkt zwischen zwei benachbarten Atomen übertragen wird. Methylmalonyl-CoA-Mutase wandelt Methylmalonyl-CoA in Succinyl-CoA um, ein wichtiger Schritt bei der Energiegewinnung aus Proteinen und Fetten.[111]
Obwohl weitaus seltener als andere Metalloproteine (z. B. Zink und Eisen), sind neben B12 auch andere Cobaltoproteine bekannt. Diese Proteine umfassen Methionin-Aminopeptidase 2, ein Enzym, das beim Menschen und anderen Säugetieren vorkommt und den Corrin-Ring von B12 nicht verwendet, sondern Cobalt direkt bindet. Ein weiteres nichtkorriniertes Cobaltenzym ist die Nitrilhydratase, ein Enzym in Bakterien, das Nitrile metabolisiert.[112]
Mitte der 1960er Jahre kam es in Kanada und den USA zu einer Reihe von Fällen einer cobalt-induzierten Kardiomyopathie (Cobalt-Kardiomyopathie). In Quebec wurden 49, in Omaha 64 Patienten registriert. Die Symptome umfassten unter anderem Magenschmerzen, Gewichtsverlust, Übelkeit, Atemnot und Husten. Die Letalitätsrate betrug 40 Prozent. Autopsien ergaben schwere Schädigungen an Herzmuskel und Leber. Alle Patienten waren starke Biertrinker mit einem Konsum von 1,5 bis 3 Liter pro Tag. Sie konsumierten bevorzugt Sorten von lokalen Brauereien, die etwa einen Monat zuvor angefangen hatten, dem Bier Cobalt(II)-sulfat als Schaumstabilisator beizumischen.[113] Die Grenzwerte für Cobalt in Lebensmitteln wurden hierbei nicht überschritten. Das Auftreten der Krankheitsfälle kam unmittelbar zum Stillstand, nachdem die Brauereien die Cobalt(II)-sulfat-Beimischungen eingestellt hatten.[114][115]
Cobalt(II)-Salze aktivieren die hypoxie-induzierbaren Transkriptionsfaktoren (HIF) und steigern die Expression HIF-abhängiger Gene. Hierzu gehört das Gen für Erythropoietin (EPO). Cobalt(II)-Salze könnten von Sportlern missbraucht werden, um die Bildung roter Blutzellen zu fördern.[116] Das Unternehmen Cassella Farbwerke Mainkur hatte in den 1950er Jahren ein die zur Vitamin B-12-Gruppe gehörende Kobaltverbindung Methylcobalamin enthaltendes Präparat namens Cobaltin forte als Arzneimittel „bei Anämien verschiedenster Genese“ angeboten.[117][118]
Gelegentlich treten Cobaltvergiftungen durch schadhafte Metallimplantate auf.[119][120]
Toxikologie
Kontakt mit kobalthaltigen Materialien kann beim Menschen zu Hautrötungen, juckenden Hautausschlägen oder Akne führen. Außerdem kann Kobalt wie Nickel eine allergische Kontakt-Dermatitis (Hautentzündung mit Ekzem) verursachen.[121]
Im Tierversuch zeigen anorganische Cobaltsalze, sofern das Anion nicht einen zusätzlichen Beitrag liefert (z. B. Fluorid), ähnliche Daten bei der akuten oralen Toxizität bezogen auf den Cobaltgehalt.[122]
| Substanz | Formel | Molmasse | LD50-Wert in mg/kg Körpergewicht | ||
|---|---|---|---|---|---|
| Testsubstanz | ber. auf wasser- freie Substanz | ber. auf den Co-Gehalt | |||
| Cobalt(II)-fluorid | CoF2 | 96,93 | 150 | 150 | 91 |
| Cobalt(II)-oxid | CoO | 74,93 | 202 | 202 | 159 |
| Cobalt(II)-phosphat | Co3(PO4)2·8 H2O | 511,0 | 539 | 387 | 187 |
| Cobalt(II)-bromid | CoBr2 | 218,74 | 406 | 406 | 109 |
| Cobalt(II)-chlorid | CoCl2·6 H2O | 237,93 | 766 | 418 | 190 |
| Cobalt(II)-sulfat | CoSO4·7 H2O | 281,10 | 768 | 424 | 161 |
| Cobalt(II)-nitrat | Co(NO3)2·6 H2O | 291,04 | 691 | 434 | 140 |
| Cobalt(II)-acetat | Co(CH3CO2)2·4 H2O | 249,08 | 708 | 503 | 168 |
Nachweis

Eine relativ aussagekräftige Vorprobe für Cobalt ist die Phosphorsalzperle, die von Cobaltionen intensiv blau gefärbt wird. Im Kationentrennungsgang kann es neben Nickel mit Thiocyanat und Amylalkohol nachgewiesen werden, es bildet beim Lösen im Amylalkohol blaues Co(SCN)2. Das in Wasser rotviolette Cobalt(II)-thiocyanat wird beim Versetzen mit Aceton ebenfalls blau.[123]
Quantitativ kann Cobalt mit EDTA in einer komplexometrischen Titration gegen Murexid als Indikator bestimmt werden.[124]
Verbindungen
Cobalt tritt in seinen Verbindungen meist zwei- oder dreiwertig auf. Diese Verbindungen besitzen oft kräftige Farben. Wichtige Cobaltverbindungen sind:
Oxide
Cobalt(II)-oxid ist ein olivgrünes, in Wasser unlösliches Salz. Es bildet eine Natriumchlorid-Struktur der Raumgruppe Fm3m (Raumgruppen-Nr. 225). Cobalt(II)-oxid wird als Rohstoff für die Herstellung von Pigmenten verwendet, insbesondere zur Herstellung des Pigments Smalte, das auch in der Keramikindustrie verwendet wird. Außerdem kann es zur Herstellung von Kobaltglas sowie von Thénards Blau verwendet werden. Cobalt(II,III)-oxid ist ein schwarzer Feststoff und zählt zur Gruppe der Spinelle.[125]
Cobalt(II,III)-oxid ist ein wichtiges Zwischenprodukt bei der Gewinnung von metallischen Cobalt. Durch Rösten und Auslaugen wird aus verschiedenen Cobalterzen (meist Sulfiden oder Arseniden) zunächst Cobalt(II,III)-oxid gewonnen. Dieses kann nun mit Kohlenstoff oder aluminothermisch zum Element reduziert werden.[125]
Cobalt(III)-oxid ist ein grau-schwarzer Feststoff, welcher praktisch unlöslich in Wasser ist. Bei einer Temperatur über 895 °C spaltet es Sauerstoff ab, wobei sich Cobaltoxide wie Co3O4 und CoO bilden.
Halogenide


Cobalt(II)-chlorid ist ein im wasserfreien Zustand blaues, als Hexahydrat rosafarbenes Salz. Es hat eine trigonale Kristallstruktur vom Cadmium(II)-hydroxid-Typ mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164). Wasserfreies Cobalt(II)-chlorid ist sehr hygroskopisch und nimmt leicht Wasser auf. Dabei ändert es sehr charakteristisch seine Farbe von blau nach rosa. Der entgegengesetzte Farbwechsel von rosa auf blau ist ebenfalls möglich, indem man das Hexahydrat auf Temperaturen oberhalb 35 °C erhitzt.[126] Wegen des typischen Farbwechsels diente es als Feuchtigkeits-Indikator in Trockenmitteln wie etwa Kieselgel. Mit Hilfe von Cobalt(II)-chlorid lässt sich Wasser auch in anderen Lösungen nachweisen. Auch wird es als sogenannte Geheimtinte benutzt, da es als Hexahydrat in wässriger Lösung auf dem Papier kaum sichtbar ist, wenn es aber erhitzt wird, tritt tiefblaue Schrift hervor.
Cobalt(II)-bromid ist ein grüner hygroskopischer Feststoff, der an der Luft in das rote Hexahydrat übergeht. In Wasser ist es mit roter Farbe leicht löslich.[127] Cobalt(II)-iodid ist eine schwarze graphitähnliche hygroskopische Masse, die an Luft langsam schwarzgrün anläuft. Sie ist löslich in Wasser, wobei die verdünnte Lösungen rot aussehen, konzentrierte Lösungen bei niedriger Temperatur rot, bei höherer Temperatur alle Nuancen von braun bis olivgrün annehmen. Cobalt(II)-bromid und Cobalt(II)-iodid besitzen eine hexagonale Cadmiumiodid-Kristallstruktur der Raumgruppe P63mc (Raumgruppen-Nr. 186).[128]
Weitere Verbindungen
Cobalt(II)-nitrat ist ein Salz der Salpetersäure, gebildet aus dem Cobaltkation und dem Nitratanion. Das braunrote und hygroskopische Salz liegt in der Regel als Hexahydrat vor und bildet monokline Kristalle, die in Wasser, Ethanol und anderen organischen Lösemitteln gut löslich sind.
Cobalt(II)-oxalat ist ein brennbarer, schwer entzündbarer, kristalliner, rosa Feststoff, der praktisch unlöslich in Wasser ist. Er zersetzt sich bei Erhitzung über 300 °C. Es kommt in zwei allotropen Kristallstrukturen vor. Eine besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15), die andere eine orthorhombische Kristallstruktur mit der Raumgruppe Cccm (Raumgruppen-Nr. 66).[129] Cobalt(II)-oxalat wird hauptsächlich zur Herstellung von Cobaltpulver verwendet.[130] Das gelblich-rosa Tetrahydrat wird bei der Herstellung von Katalysatoren verwendet.[131]
Cobalt(II)-sulfat ist im wasserfreien Zustand ein violettstichig-rotes, hygroskopisches Salz. Cobalt(II)-sulfat wird zur Herstellung von Pigmenten, Glasuren, in der Porzellanmalerei, zur Tonung von Papieren (Fotografie), in Bädern für Cobalt-Electroplating und zur Spurenelementsupplementierung in der Aquaristik u. a. verwendet.[132]
Cobaltgelb ist ein feines, leichtes kristallines Pulver und wird als Pigment für Öl- und Aquarellmalerei verwendet.
Thénards Blau ist ein blaues Pigment, das durch Sintern von Cobalt(II)-oxid mit Aluminiumoxid bei 1200 °C hergestellt wird. Es ist äußerst stabil und wurde in der Vergangenheit als Farbstoff für Keramik (insbesondere chinesisches Porzellan), Schmuck und Farben verwendet. Transparente Gläser werden mit dem Kobaltpigment-Smalt auf Siliciumdioxidbasis getönt.[133]
Das Pigment Rinmans Grün ist ein türkisgrünes Pulver und wird vor allem für Ölfarben und Zementfarben verwendet. Rinmans Grün ist ein beliebter Nachweis für Zink. Zinkoxid oder Zinkhydroxid wird auf einer Magnesiarinne mit einer geringen Menge einer stark verdünnten Cobaltnitratlösung versetzt. Beim schwachen Glühen in der oxidierenden Flamme entsteht Rinmans Grün.[134]
Cobaltkomplexe

Aus einer Cobalt(II)-chloridlösung fällt bei Zugabe von Ammoniaklösung zunächst ein Niederschlag von Cobalt(II)-hydroxid aus, der sich im Überschuss von Ammoniaklösung und Ammoniumchlorid bei Gegenwart von Luftsauerstoff als Oxidationsmittel unter Bildung von unterschiedlichen Ammincobalt(III)-komplexen auflöst. Hierbei entstehen insbesondere das orangegelbe Hexaammincobalt(III)-chlorid und das rote Aquapentaammincobalt(III)-chlorid.
Daneben können sich auch verschiedene Chloroammincobalt(III)-komplexe bilden, wie Chloropentaammincobalt(III)-chlorid oder Dichlorotetraammincobalt(III)-chlorid. Teilweise fallen diese Verbindungen aus der Lösung aus. Daneben existieren auch Amminkomplexe von Cobalt(II)-salzen, wie das Hexaammincobalt(II)-sulfat, das durch Überleiten von Ammoniakgas über wasserfreies Cobalt(II)-sulfat hergestellt werden kann.
Neben den Amminkomplexen existieren eine Vielzahl von Verbindungen mit unterschiedlichen Liganden. Beispiele sind das Kaliumhexacyanocobaltat(II) (K4[Co(CN)6]), das Kaliumtetrathiocyanatocobaltat(II) (K2[Co(SCN)4]), das Kaliumhexanitritocobaltat(III) (Fischers Salz, Cobaltgelb), sowie Komplexe mit organischen Liganden wie Ethylendiamin oder dem Oxalation.[123]
Bemerkenswert ist eine Eigenschaft von [Co(NH3)5(NO2)]Cl(NO3). Bei Bestrahlung mit UV-Licht springen die mikrometer- bis millimetergroßen Kristalle in dieser Cobalt-Koordinationsverbindung und legen dabei Distanzen zurück, die dem tausendfachen ihrer Größe entsprechen. Ursache dafür sind Isomerisierungen des Nitrit-Ligands (NO2), was zu Spannungen im Kristall führt. Diese Umwandlung von Licht- in mechanische Energie wurde von Wissenschaftlern der Vereinigten Arabischen Emirate und Russlands untersucht.[135]
Siehe auch
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1681–1695.
- Michael Binnewies: Allgemeine und Anorganische Chemie. 1. Auflage, Spektrum Verlag, Heidelberg 2004, ISBN 3-8274-0208-5.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
Weblinks
- Mineralienatlas:Kobalt (Wiki)
- Kobalt, die dunkle Seite der Energiewende, Dokumentarfilm 2022, Arte
Einzelnachweise
- ↑ Hermann Sicius: Cobaltgruppe: Elemente der neunten Nebengruppe. Springer Fachmedien Wiesbaden, 2016 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Cobalt) entnommen.
- ↑ IUPAC Commission on Isotopic Abundances and Atomic Weights: Standard Atomic Weights of 14 Chemical Elements Revised. In: Chemistry International. 40, 2018, S. 23, doi:10.1515/ci-2018-0409.
- ↑ a b c d e Eintrag zu cobalt in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: National Institute of Standards and Technology, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- ↑ a b c d e Eintrag zu cobalt bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- ↑ a b N. N. Greenwood und A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1427.
- ↑ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ John Dallas Donaldson, Detmar Beyersmann: Cobalt and Cobalt Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a07_281.pub2 (Zugang über subskribierte Institutionen).
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik, Band 6: Festkörper. 2. Auflage, Walter de Gruyter, 2005, ISBN 978-3-11-017485-4, S. 361.
- ↑ Erin K. Byrne. Klaus H. Theopold: Synthesis, characterization, and electron-transfer reactivity of norbornyl complexes of cobalt in unusually high oxidation states. In: Journal of the American Chemical Society. 1989, 111, S. 3887–3896, doi:10.1021/ja00193a021.
- ↑ a b c d Eintrag zu Cobalt, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Februar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu Cobalt in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 16. Februar 2022. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Claus Priesner, Karin Figala: Alchemie: Lexikon einer hermetischen Wissenschaft. C.H.Beck, 1998, ISBN 978-3-406-44106-6, S. 199 (Online).
- ↑ a b c Centre D’Information du Cobalt (Hrsg.): Cobalt Monograph. Prepared in collaboration with the staff of Battelle Memorial Institute, Columbus, Ohio. M. Weissenbruch, Brüssel 1960, OCLC 921191777 (englisch).
- ↑ Harry Garner: An Early Piece of Glass from Eridu. In: Iraq. 1956, Band 18, Nummer 2, S. 147, doi:10.2307/4199608.
- ↑ Andrew Shortland, M. S. Tite, I. Ewart: Ancient exploitation and use of cobalt alums from the western oases of egypt. In: Archaeometry. 2006, Band 48, Nummer 1, S. 153–168, doi:10.1111/j.1475-4754.2006.00248.x.
- ↑ Moujan Matin, Mark Pollard: Historical Accounts of Cobalt Ore Processing from the Kashan Mine, Iran. In: Iran. 2015, Band 53, Nummer 1, S. 171–183 doi:10.1080/05786967.2015.11834755.
- ↑ Yun Zhang, A. Mark Pollard: The archaeological and scientific analysis of blue‐decorated ceramics in the Tang and Song dynasties. In: Archaeometry. 2022, Band 64, Nummer 6, S. 1394–1410, doi:10.1111/arcm.12794.
- ↑ Howell G. M. Edwards , Philippe Colomban: Blue by Fire: A Marker of the Technical History of Glass and Ceramics. Springer, 2025, ISBN 978-3-031-77122-4, S. 50–53.
- ↑ A. Zucchiatti, Anne Bouquillon, I. Katona, A. D’Alessandro: The 'della Robbia blue’: A case study für the use of cobalt pigments in ceramics during the italian renaissance. In: Archaeometry. 2006, Band 48, Nummer 1, S. 131–152 doi:10.1111/j.1475-4754.2006.00247.x.
- ↑ a b Die sächsischen Blaufarbenwerke. In: Louis Oeser (Hrsg.): Album der Sächsischen Industrie. Band 1, 1856, Seite 78–81 (online auf Wikisource).
- ↑ Dominik Berrens: Names and Things: Latin and German Mining Terminology in Georgius Agricola’s Bermannus. In: Antike und Abendland. 2020, Band 65-66, Nummer 1, S. 232–243 doi:10.1515/anab-2019-0011.
- ↑ Edwin M. Gusenius: Beginnings of Greatness in Swedish Chemistry: Georg Brandt, (1694-1768). In: Transactions of the Kansas Academy of Science. 1967, Band 70, Nummer 4, S. 413 doi:10.2307/3627593.
- ↑ Anders Lennartson: Carl Wilhelm Scheele and Torbern Bergman: The Science, Lives and Friendship of Two Pioneers in Chemistry. Springer Nature. 2020, ISBN 978-3-030-49194-9, S. 225.
- ↑ Kobalt. In: Digitales Wörterbuch der deutschen Sprache. Abgerufen am 28. August 2025
- ↑ W. Klemm: Vorwort zur deutschen Fassung der zweiten Ausgabe. Veröffentlicht in: International Union of Pure and Applied Chemistry (Hrsg.): Nomenklatur der Anorganischen Chemie. Deutsche Ausgabe der Empfehlungen 1990. Wiley-VCH, 1993, ISBN 978-3-527-60319-0, S. XXIV-XXVII.
- ↑ Mineralienatlas:Kobaltnickelkies (Wiki).
- ↑ a b Hans Breuer: dtv-Atlas Chemie. Bd. 1, 9. Auflage, dtv Verlagsgesellschaft, München 2000, ISBN 3-423-03217-0.
- ↑ a b c Kim B. Shedd: COBALT. (PDF) In: Mineral Yearbook 2014. USGS, Februar 2014, abgerufen am 7. Januar 2023 (englisch).
- ↑ Cobalterzabbau durch Kinder im Kleinbergbau, abgerufen am 11. Januar 2023
- ↑ Weltweite Cobaltvorkommen, abgerufen am 11. Januar 2023
- ↑ Marcus Sommerfeld, David Friedmann, Thomas Kuhn, Bernd Friedrich: “Zero-Waste”: A Sustainable Approach on Pyrometallurgical Processing of Manganese Nodule Slags. In: Minerals. Band 8, Nr. 12, Dezember 2018, S. 544, doi:10.3390/min8120544.
- ↑ Akram Belkaïd: Kobalt wird knapp. In: monde-diplomatique.de. 21. März 2018, abgerufen am 7. Januar 2023.
- ↑ Stefan Schultz: Tiefsee: Greenpeace warnt vor Oligopol bei Rohstoffförderung. In: Der Spiegel. 4. Dezember 2020, abgerufen am 7. Januar 2023.
- ↑ a b Kim B. Shedd: COBALT. (PDF) In: Mineral Yearbook 2006. USGS, Januar 2006, abgerufen am 7. Januar 2023 (englisch).
- ↑ a b Kim B. Shedd: COBALT. (PDF) In: Mineral Yearbook 2008. USGS, Januar 2008, abgerufen am 7. Januar 2023 (englisch).
- ↑ Cobalt’s meteoric rise at risk from Congo’s Katanga. Financial Times, 14. März 2017, abgerufen am 23. Januar 2021 (Zugang zur Quelle nur gegen Entgelt).
- ↑ Davis, Joseph R.: ASM specialty handbook: nickel, cobalt, and their alloys. ASM International, 2000, ISBN 0-87170-685-7, S. 347 (Online).
- ↑ Adnan Mazarei: Who controls the world’s minerals needed for green energy? | illuminem. 26. September 2022, abgerufen am 7. Januar 2025 (englisch).
- ↑ Kim B. Shedd: COBALT. (PDF) In: Mineral Yearbook 2007. USGS, Januar 2007, abgerufen am 7. Januar 2023 (englisch).
- ↑ Kim B. Shedd: COBALT. (PDF) In: Mineral Yearbook 2017. USGS, Februar 2017, abgerufen am 7. Januar 2023 (englisch).
- ↑ Kim B. Shedd: COBALT. (PDF) In: Mineral Yearbook 2021. USGS, Januar 2021, abgerufen am 7. Januar 2023 (englisch).
- ↑ Kim B. Shedd: COBALT. (PDF) In: Mineral Yearbook 2022. USGS, Januar 2022, abgerufen am 7. Januar 2023 (englisch).
- ↑ Cobalt. Abgerufen am 7. Januar 2025.
- ↑ Offizielle Website des Cobalt Development Instituts
- ↑ Cobalt Development Institut:Cobalt_news_april12 ( vom 3. Dezember 2017 im Internet Archive) (PDF; 2 MB)
- ↑ Cobalt Development Institut:14-2_cobalt_news ( vom 3. Dezember 2017 im Internet Archive) (PDF; 1,6 MB)
- ↑ Cobalt Development Institut:17-2_cobalt_news ( vom 3. Dezember 2017 im Internet Archive) (PDF; 1,6 MB)
- ↑ a b handelsblatt.com vom 17. Januar 2020, Lithium-Ionen-Batterien sind ein Milliardengeschäft – mit Schattenseite, abgerufen am 3. Oktober 2020.
- ↑ handelsblatt.com vom 20. Februar 2020, Die schwierige Suche nach der kobaltfreien Batterie, abgerufen am 3. Oktober 2020.
- ↑ a b FAZ.net vom 14. November 2020: An Kongo führt kein Weg vorbei
- ↑ Aktivisten verklagen Tech-Konzerne wegen Kinderarbeit. In: Handelsblatt, 18. Dezember 2019. Abgerufen am 3. Oktober 2020.
- ↑ Charles Steinmetz: Theory and Calculation of Electric Circuits. Hrsg.: McGraw-Hill. 1917, Fig. 42.
- ↑ a b K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, B30, S. 193–204, doi:10.1107/S0567740874002469.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1682.
- ↑ Daniel Eka Perkasa, Aliya Qonita, Bambang Soegijono: Influence Of Heat Treatment On Crystal Structure And Corrosion Properties Of Co-Cr-Mo-Al Alloy In Simulated Body Fluid Solution. In: Journal of Physics: Conference Series. Band 1825, 2021, doi:10.1088/1742-6596/1825/1/012055.
- ↑ B. Lee, R. Alsenz, A. Ignatiev, M. Van Hove, M. Hove: Surface structures of the two allotropic phases of cobalt. In: Physical Review B. Band 17, Nr. 4, 1978, S. 1510–1520, doi:10.1103/PhysRevB.17.1510.
- ↑ E A Owen, D Madoc Jones: Effect of Grain Size on the Crystal Structure of Cobalt. In: Proceedings of the Physical Society. Section B. Band 67, Nr. 6, 1954, S. 456, doi:10.1088/0370-1301/67/6/302.
- ↑ G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- ↑ Table of Isotopes decay data.
- ↑ Georgia State University: Cobalt-60 bei HyperPhysics.
- ↑ Centers for Disease Control and Prevention (CDC):Cobalt-60. ( vom 30. November 2005 im Internet Archive) Atlanta 2004, abgerufen am 21. Februar 2009.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1681.
- ↑ Malkoske et al.: COBALT-60 PRODUCTION IN CANDU POWER REACTORS
- ↑ J. Slack, J. L. Norton, G. R. Malkoske: Cobalt-60 production in CANDU power reactors. 1. Juli 2003 (osti.gov [abgerufen am 27. März 2023]).
- ↑ Central Office, NucNet a.s.b.l., Brussels, Belgium: Romania / Nuclearelectrica To Consider Cobalt-60 Production At Cernavodă : NucNet – The Independent Nuclear News Agency. In: nucnet.org. 26. Juni 2020, abgerufen am 7. Januar 2023.
- ↑ Liao Shumin: China to Put Its First Medical Cobalt-60 Radioactive Source on the Market. In: yicaiglobal.com. 12. September 2019, abgerufen am 7. Januar 2023 (englisch).
- ↑ Russia starts cobalt-60 production at Kursk plant : Corporate - World Nuclear News. In: world-nuclear-news.org. 29. November 2018, abgerufen am 7. Januar 2023.
- ↑ Framatome and Exelon to explore Co-60 production : Corporate - World Nuclear News. In: world-nuclear-news.org. 5. Januar 2022, abgerufen am 7. Januar 2023.
- ↑ Central Office, NucNet a.s.b.l., Brussels, Belgium: Medical Isotopes / Westinghouse To Partner With Nordion On Cobalt-60 Production In PWRs : NucNet – The Independent Nuclear News Agency. In: nucnet.org. 27. Februar 2020, abgerufen am 7. Januar 2023.
- ↑ Cobalt bei rutherford-online – Lexikon der Elemente 2006.
- ↑ Christian Schwägerl: Giftmüll-Import: Strahlenschrott wurde über ganz Deutschland verteilt. In: Der Spiegel. 17. Februar 2009, abgerufen am 7. Januar 2023.
- ↑ Oak Ridge Associated Universities: Contaminated Pipe Fitting from Taiwan.
- ↑ Tomaž Žagar, Matjaž Ravnik: Determination of Long-Lived Neutron Activation Products in Reactor Shielding Concrete Samples. In: Nuclear Technology. Band 140, Nr. 1, 13. Mai 2017, S. 113, doi:10.13182/NT02-A3327.
- ↑ Masaharu KINNO, Ken-ichi KIMURA, Takashi NAKAMURA: Raw Materials for Low-Activation Concrete Neutron Shields. In: Journal of Nuclear Science and Technology. Band 39, Nr. 12, Dezember 2002, S. 1275, doi:10.1080/18811248.2002.9715321.
- ↑ C. S. Wu, E. Ambler, R. W. Hayward, D. D. Hoppes, R. P. Hudson: Experimental Test of Parity Conservation in Beta Decay. In: Physical Review. Band 105, Nr. 4, Februar 1957, S. 1413–1415, doi:10.1103/PhysRev.105.1413.
- ↑ Sebastian Weber, Frederic van gen Hassend: Eisen statt Kobalt – Ein Weg zur nachhaltigen Rohstoffnutzung. Bergische Universität Wuppertal. Abgerufen am 11. Juni 2019.
- ↑ Matthew J. Donachie: Superalloys: A Technical Guide. ASM International, 2002, ISBN 978-0-87170-749-9 (Online).
- ↑ Flake C. Campbell: Elements of metallurgy and engineering alloys. 2008, ISBN 978-0-87170-867-0, Cobalt and Cobalt Alloys, S. 557–558 (Online).
- ↑ R. Michel: Systemic effects of implanted prostheses made of cobalt-chromium alloys. In: Archives of Orthopaedic and Trauma Surgery. 110. Jahrgang, Nr. 2, S. 61–74, doi:10.1007/BF00393876, PMID 2015136 (englisch).
- ↑ John A. Disegi: Cobalt-base Aloys for Biomedical Applications. ASTM International, 1999, ISBN 0-8031-2608-5, S. 34 (Online).
- ↑ F. E. Luborsky: Reproducing the Properties of Alnico Permanent Magnet Alloys with Elongated Single-Domain Cobalt-Iron Particles. In: Journal of Applied Physics. 28. Jahrgang, Nr. 344, doi:10.1063/1.1722744, bibcode:1957JAP....28..344L (englisch).
- ↑ M. Hawkins: Why we need cobalt. In: Applied Earth Science: Transactions of the Institution of Mining & Metallurgy, Section B. 110. Jahrgang, Nr. 2, S. 66–71, doi:10.1179/aes.2001.110.2.66 (englisch).
- ↑ Some effects of the addition of cobalt to the nickel hydroxide electrode. In: Journal of Applied Electrochemistry. 18. Jahrgang, Nr. 2, S. 215–219, doi:10.1007/BF01009266 (englisch).
- ↑ Recovery of metal values from spent nickel–metal hydride rechargeable batteries. In: Journal of Power Sources. 77. Jahrgang, Nr. 2, S. 116–122, doi:10.1016/S0378-7753(98)00182-7, bibcode:1999JPS....77..116Z (englisch).
- ↑ #Faktenfuchs: Kobalt-Nachfrage steigt wegen der E-Mobilität. In: Bayerischer Rundfunk, 17. November 2019. Abgerufen am 13. Juli 2020.
- ↑ a b c Schafft es die Autoindustrie ohne das verrufene Kobalt?. In: Wirtschaftswoche, 17. November 2023. Abgerufen am 18. November 2023.
- ↑ Martin Doppelbauer: Strategiepapier elektrische Pkws – aktueller Stand und zukünftige Entwicklung (V1.5). Karlsruher Institut für Technologie. Abgerufen am 7. November 2019.
- ↑ Gerd Stegmaier: Tesla Model 3 in China: Kampfpreis dank brandsicherer Billig-Batterien. 6. Oktober 2020, abgerufen am 21. März 2022.
- ↑ SVOLT beginnt mit Kathodenmaterialproduktion für kobaltfreie NMX-Batteriezellen. 14. April 2021, abgerufen am 21. März 2022 (deutsch).
- ↑ Resource consumption of the passenger vehicle sector in Germany until 2035 – the impact of different drive systems, Öko-Institut e.V, Darmstadt, 28. Mai 2021.
- ↑ Khodakov, Andrei Y.: Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels. In: Chemical Reviews. 107. Jahrgang, Nr. 5, S. 1692–1744, doi:10.1021/cr050972v, PMID 17488058.
- ↑ Hebrard, Frédéric: Cobalt-Catalyzed Hydroformylation of Alkenes: Generation and Recycling of the Carbonyl Species, and Catalytic Cycle. In: Chemical Reviews. 109. Jahrgang, Nr. 9, S. 4272–4282, doi:10.1021/cr8002533, PMID 19572688.
- ↑ M. Hawkins: Why we need cobalt. In: Applied Earth Science: Transactions of the Institution of Mining & Metallurgy, Section B. 110. Jahrgang, Nr. 2, S. 66–71, doi:10.1179/aes.2001.110.2.66.
- ↑ Eichberg, M.J., Dorta, R.L., Grotjahn, D.B., Lamottke, K., Schmidt, M., Vollhardt, K.P.C. (2002), ChemInform Abstract: Approaches to the Synthesis of (±)-Strychnine via the Cobalt-Mediated [2 + 2 + 2] Cycloaddition: Rapid Assembly of a Classic Framework. ChemInform, 33: 5, doi:10.1002/chin.200205206.
- ↑ Bruce Power harvests first HSA cobalt-60 : Regulation & Safety. In: World Nuclear News. Abgerufen am 27. März 2023.
- ↑ The unseen wonders of nuclear power. Abgerufen im Jahr 2023.
- ↑ Sonal Patel: A Nuclear Power Side Venture: Medical Isotope Production. In: POWER Magazine. 1. Mai 2020, abgerufen am 27. März 2023 (amerikanisches Englisch).
- ↑ Schmidt, Lang: Physiologie des Menschen. 30. Auflage, S. 856.
- ↑ Kurt Hausmann: Die Bedeutung der Darmbakterien für die Vitamin B12- und Folsäure-Versorgung der Menschen und Tiere. In: Klinische Wochenschrift, Ausgabe 33/1955, Nummer 15–16, S. 354–359, doi:10.1007/BF01467965.
- ↑ Cem Ekmekcioglu, Wolfgang Marktl: Cobaltmangel. In: Essentielle Spurenelemente: Klinik und Ernährungsmedizin, Springer 2006, ISBN 978-3-211-20859-5, S. 198 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Wolfgang Löscher, Fritz Rupert Ungemach, Reinhard Kroker: Vitamin B12. In: Pharmakotherapie bei Haus- und Nutztieren, 7. Auflage, Georg Thieme Verlag 2006; S. 346. ISBN 978-3-8304-4160-1.
- ↑ Kirsten Stemme: Untersuchungen zur Kobalt-Versorgung von Milchkühen. Dissertation TiHo Hannover, 2002, S. 32.
- ↑ Hans-Konrad Biesalski, Stephan C. Bischoff, Christoph Puchstein (Hrsg.): 11.4 Cobalt. In: Ernährungsmedizin: nach dem neuen Curriculum Ernährungsmedizin der Bundesärztekammer, 4. Auflage, Georg Thieme Verlag 2010; ISBN 978-3-13-100294-5, S. 205.
- ↑ Wenzel R, Major D, Hesp K, Doble P: Determination of vitamin B12 in equine urine by liquid chromatography - inductively coupled plasma - mass spectrometry. J Trace Elem Med Biol. 2018 Dec;50:634–639, PMID 29773468.
- ↑ Kwak YB, Yu J, Im EJ, Jeong BS, Yoo HH: Study of cobalt doping control via various routes in thoroughbred horses. Drug Test Anal. 2022 Apr;14(4):718–723, PMID 34750992.
- ↑ Knoop A, Planitz P, Wüst B, Thevis M: Analysis of cobalt for human sports drug testing purposes using ICP- and LC-ICP-MS. Drug Test Anal. 2020 Nov;12(11-12):1666-1672, PMID 33142033.
- ↑ Cobalt requirement of beef cattle – feed intake and growth at different levels of cobalt supply. In: Journal of Animal Physiology and Animal Nutrition. 83. Jahrgang, Nr. 3, S. 121–131, doi:10.1046/j.1439-0396.2000.00258.x.
- ↑ Judith G. Voet, Donald Voet: Biochemistry. J. Wiley & Sons, New York 1995, ISBN 0-471-58651-X, S. 675.
- ↑ Understanding the Mechanism of B12-Dependent Methylmalonyl-CoA Mutase: Partial Proton Transfer in Action. In: Journal of the American Chemical Society. 121. Jahrgang, Nr. 40, S. 9388–9399, doi:10.1021/ja991649a.
- ↑ Michihiko Kobayashi: Cobalt proteins. In: European Journal of Biochemistry. 261. Jahrgang, Nr. 1, S. 1–9, doi:10.1046/j.1432-1327.1999.00186.x, PMID 10103026.
- ↑ C. Thomas: Spezielle Pathologie. Schattauer Verlag, 1996, ISBN 3-7945-2110-2, S. 179 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Expert Group on Vitamins and Minerals. 2002.
- ↑ Cardiology: When Beer Brought the Blues. In: The New York Times, Ausgabe vom 10. Januar 1967 (englisch).
- ↑ Wolfgang Jelkmann: The Disparate Roles of Cobalt in Erythropoiesis, and Doping Relevance. In: Open Journal of Hematology. Band 3, 2012, S. 3–6, doi:10.13055/ojhmt_3_1_6.121211.
- ↑ Arzneimittel Cassella. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. LXXIV.
- ↑ Vgl. auch W. Oergel: Erfahrungen mit Cobaltin forte bei der Behandlung hypochromer Anämien [Experiences with cobaltin forte in therapy of hypochromic anemia]. In: Medizinische. Band 21, Nr. 18, Mai 1953, S. 620–622.
- ↑ W. Steens, J. F. Loehr, G. von Foerster, A. Katzer: Chronische Kobaltvergiftung in der Endoprothetik, Der Orthopäde, Juli 2006.
- ↑ Implantate - Fluch und Segen eines künstlichen Gelenks. In: Deutschlandfunk Kultur, 25. Juni 2015.
- ↑ Cobalt. Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit, abgerufen am 7. September 2023.
- ↑ a b G.J.A. Speijers, E.I. Krajnc, J.M. Berkvens, M.J. van Logten: Acute oral toxicity of inorganic cobalt compounds in rats. In: Food and Chemical Toxicology. Band 20, Nr. 3, Juni 1982, S. 311–314, doi:10.1016/S0278-6915(82)80298-6.
- ↑ a b Heinrich Remy: Lehrbuch der Anorganischen Chemie. Bd. II, Akademische Verlagsgesellschaft Geest & Portig Leipzig 1961, S. 356–365.
- ↑ E. Merck: Komplexometrische Bestimmungen mit Titriplex. Darmstadt.
- ↑ a b Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 386 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1685.
- ↑ Cobalt dibromide. In: webelements.com. Abgerufen am 21. Juni 2017 (englisch).
- ↑ D. Nicholls: The Chemistry of Iron, Cobalt and Nickel: Comprehensive Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-4643-0, S. 1070 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ E. Romero, M. E. Mendoza, R. Escudero: Weak ferromagnetism in cobalt oxalate crystals. In: physica status solidi. 248, 2011, S. 1519, doi:10.1002/pssb.201046402.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons, 2003, ISBN 3-527-30385-5, S. 785 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ D. Nicholls: The Chemistry of Iron, Cobalt and Nickel Comprehensive Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-4643-0, S. 1072 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ C. Thomas: Spezielle Pathologie. Schattauer Verlag, 1996, ISBN 3-7945-2110-2, S. 179 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A.F. Gehlen: Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard. In: Neues allgemeines Journal der Chemie, Band 2. 1803 (books.google.com ( des vom 10. Februar 2018 im Internet Archive)).
- ↑ Jander/Blasius: Einführung in das anorganisch-chemische Praktikum. 14. Aufl. 1995.
- ↑ Panče Naumov, Subash Chandra Sahoo u. a.: Dynamic Single Crystals: Kinematic Analysis of Photoinduced Crystal Jumping (The Photosalient Effect). In: Angewandte Chemie. 125, 2013, S. 10174–10179, doi:10.1002/ange.201303757.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Flagge der Demokratischen Republik Kongo. Erstellt laut den Angaben der Staatsverfassung von 2006.
Flag of Canada introduced in 1965, using Pantone colours. This design replaced the Canadian Red Ensign design.
Flag of Australia, when congruence with this colour chart is required (i.e. when a "less bright" version is needed). See Flag of Australia.svg for main file information.
Verwendete Farbe: National flag | South African Government and Pantone Color Picker
| Grün | gerendert als RGB 0 119 73 | Pantone 3415 C |
| Gelb | gerendert als RGB 255 184 28 | Pantone 1235 C |
| Rot | gerendert als RGB 224 60 49 | Pantone 179 C |
| Blau | gerendert als RGB 0 20 137 | Pantone Reflex Blue C |
| Weiß | gerendert als RGB 255 255 255 | |
| Schwarz | gerendert als RGB 0 0 0 |
bendera Indonesia
Hexagonale dichteste Kugelpackung, schematisch gezeichnet
Cobalt(II) chloride hexahydrate
Autor/Urheber: Didier Descouens, Lizenz: CC BY-SA 4.0
Skutterudite and Nickeline
- Locality : Bou Azzer District, Tazenakht, Ouarzazate Province, Souss-Massa-Draâ Region, Morocco
- Size : (13x11cm)
Cobalt 60 decay
Zeitliche Entwicklung der weltweiten Cobaltförderung (in Tonnen pro Jahr)
Autor/Urheber: Д.Ильин: vectorization, Lizenz: CC0
Gamma spectrum of 60Co, observed with a germanium detector. x-axis gauged to energy.
Autor/Urheber: KarlScienceChem, Lizenz: CC BY-SA 4.0
Die Bedeutung der Verwendung von Ethin in einer [2+2+2]-Cobalt-Cycloaddition, insbesondere die direkte Nutzung von Ethin in anspruchsvollen organischen Reaktionen, wird hervorgehoben. Der Ansatz mit nicht weiter funktionalisiertem Ethin unterstreicht den bahnbrechenden Charakter dieses neuartigen Ansatzes, insbesondere bei der Weiterentwicklung synthetischer Methoden für die Totalsynthese von Strychnin. Die erste erfolgreiche Reaktion dieser Art mit Ethin gelang 1993 und vermied die Nachteile klassischer Dreifachbindungsmaterialien wie BTMSA.
Autor/Urheber: Alchemist-hp (talk) (www.pse-mendelejew.de), Lizenz: FAL
Reine (99,9 %) Kobalt-Chips, elektrolytisch raffiniert, sowie für den Größenvergleich ein reiner (99,8 % = 2N8) 1 cm3 Kobalt-Würfel
Autor/Urheber: Sbharris (Steven B. Harris), Lizenz: CC BY-SA 3.0
Methylcobalamine is a form of vitamin B-12. It is a dark red crystal which forms a cherry red transparent solution in water.
Autor/Urheber: Oguenther, Lizenz: CC BY-SA 3.0
Kobalt(II)-thiocyanat aus Cobalt(II)-chlorid und Kaliumthiocynat (oben in Aceton, unten in Wasser)
Autor/Urheber:
- Nissan_LEAF_got_thirsty.jpg: evgonetwork (eVgo Network). Original image was trimmed and retouched (lighting and color tones) by User:Mariordo
- derivative work: Mariordo (talk)
Nissan LEAF charging at the Freedom Station in Houston, TX. This is an eVgo Network station with both Level 2 and DC fast chargers.
Autor/Urheber: Oguenther, Lizenz: CC BY-SA 3.0
Amminocobalt(III)-komplexe: Hexaamminocobalt(III)-chlorid und Aquapentaamminocobalt(III)-chlorid
Struktur von Cobalamin (Vitamin B12)
Autor/Urheber: Kreuzschnabel, Lizenz: CC BY-SA 3.0
Olympus Li-Ion battery type LI-50B with ruler for size comparison
Anhydrous cobalt(II) chloride
Magnetization curves of 9 ferromagnetic substances; a plot of the flux density B as a function of magnetizing field H. They all show saturation, the levelling off of B with increasing H that is characteristic of ferromagnetic substances. The graph was traced from a 1917 electronics book, so the accuracy of the data may not be equal to modern measurements.
The substances are:
- standard sheet steel, annealed,
- silicon sheet steel, annealed, Si 2.5%,
- soft steel casting,
- tungsten steel,
- magnet steel,
- cast iron,
- nickel, 99%,
- cast cobalt,
- Magnetite, Fe2O3.




![Ethin in einer [2+2+2]-Cobalt-Cycloaddition](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e7/240205_Co-Reaction_deutsch.svg/500px-240205_Co-Reaction_deutsch.svg.png)






































