Kernrezeptoren

Kernrezeptoren (auch: nukleäre Rezeptoren (NR) oder ligandenaktivierte Transkriptionsfaktoren) sind spezielle Proteine, die im Zellkern von mehrzelligen Tieren vorkommen. Es handelt sich um Transkriptionsfaktoren, die erst durch die Bindung eines Liganden (meist Hormone) in der Lage sind, an DNA zu binden und die Transkription eines oder mehrerer Gene zu unterdrücken oder in Gang zu bringen. Kernrezeptoren sind das Ziel von Hormonen, deren Signal sie umsetzen, indem sie die Produktion bestimmter Proteine beeinflussen. Die Funktion als Transkriptionsfaktor kann nach der Bindung des Liganden durch weitere Bindungspartner modifiziert werden. Beim Menschen sind gerade 48 Kernrezeptoren bekannt,[1] jedoch ist nur bei einem Bruchteil von ihnen der Ligand identifiziert.[2][3]
Die nukleären Rezeptoren können entweder nach ihrem Wirkmechanismus oder nach ihrem Liganden eingeteilt werden. Da sich die phylogenetische Abstammung sowohl in der Aminosäuresequenz als auch im Wirkmechanismus wiederfindet, hat sich die folgende Einteilung etabliert.
Beim Wirkmechanismus wird unterschieden, ob sich der NR beim Zeitpunkt der Bindung des Liganden im Zytosol oder bereits im Zellkern, gebunden an DNA befindet, oder ob die DNA-Bindung als Monomer oder Dimer erfolgt.[3]
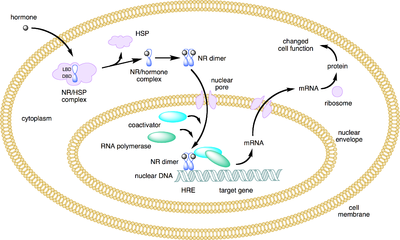
- Die klassischen Steroidrezeptoren (Typ 1) wie der Androgenrezeptor befinden sich im inaktiven Zustand an Hitzeschockproteine gebunden im Zytoplasma. Nach Bindung ihres Liganden wird das Hitzeschockprotein abgetrennt, der Rezeptor transloziert in den Zellkern und bindet als Dimer an die DNA, die immer eine palindromische Erkennungssequenz aufweist.
- Die Kernrezeptoren der Typen 2 und 4 befinden sich bei der Ligandenbindung bereits im Zellkern. Sie alle haben ein Zinkfinger-Strukturmotiv, das an die DNA-Basensequenz AGGTCA bindet. Dazu gehören:
- Thyroidhormonrezeptor-ähnliche Rezeptoren wie Peroxisom-Proliferator-aktivierte Rezeptoren oder Vitamin-D-Rezeptor
- Retinoid-X-Rezeptor-ähnliche Rezeptoren
- NGF1-b-ähnlich
- SF1-ähnlich
- GCNF-ähnlich und andere
Klassifizierung
Das folgende ist eine Klassifizierung von Kernrezeptoren nach Homologie:[4][5]
Unterfamilie 1: Thyroidhormonrezeptor-ähnliche
- Gruppe A: Thyroidhormonrezeptor (Schilddrüsenhormone)
- Gruppe B: Retinsäurenrezeptor (Vitamin A und verwandte Verbindungen)
- Gruppe C: Peroxisom-Proliferator-aktivierte Rezeptoren (Fettsäuren, prostaglandins)
- Gruppe D: Rev-ErbA (heme)
- Gruppe F: RAR-related Waise Rezeptoren (cholesterol, ATRA)
- Gruppe H: Leber X Rezeptoren-ähnliche (oxysterol)
- Gruppe I: Vitamin D Rezeptoren-ähnliche
Unterfamilie 2: Retinoid X Rezeptoren-ähnliche
- Gruppe A: Hepatocyte Kernfaktor-4 (HNF4) (Fettsäuren)
- Gruppe B: Retinoid X Rezeptoren (RXRα) (retinoids)
- Gruppe C: Testicular Rezeptoren
- Gruppe E: TLX/PNR
- Gruppe F: COUP/EAR
Unterfamilie 3: Estrogenrezeptor-ähnliche
- Gruppe A: Estrogenrezeptor (Sexualhormone: Estrogene)
- Gruppe B: Estrogen-verbunden Rezeptoren
- Gruppe C: 3-Ketosteroid Rezeptorens
- 1: Glucocorticoidrezeptoren (GR; NR3C1) (Cortisol)
- 2: Mineralocorticoidrezeptoren (MR; NR3C2) (Aldosterone)
- 3: Progesteronerezeptoren (PR; NR3C3, PGR) (Sexualhormone: Progesterone)
- 4: Androgenrezeptor (AR; NR3C4, AR) (Sexualhormone: Testosterone)
Unterfamilie 4: Nervenwachstumsfaktor IB-ähnliche
- Gruppe A: NGFIB/NURR1/NOR1
Unterfamilie 5: Steroidogenic-faktor-ähnliche
- Gruppe A: SF1/LRH1
- 1: Steroidogenic faktor 1 (SF1; NR5A1) (phospholipide)
- 2: Leber-Rezeptor homolog-1 (LRH-1; NR5A2)
Unterfamilie 6: Germ Cell Kernfaktor-ähnliche
- Gruppe A: GCNF
- 1: Germ cell nuclear factor (GCNF; NR6A1)
Unterfamilie 0: Verschiedenes
- Gruppe B: DAX/SHP
Literatur
- Bernhard Kleine: Hormone und Hormonsystem. Springer, Berlin 2010, ISBN 978-3-642-00901-3.
Weblinks
- Vincent Laudet: The IUPHAR Compendium of the Pharmacology and Classification of the Nuclear Receptor Superfamily 2006E (Nuclear Receptor Compendium). The International Union of Basic and Clinical Pharmacology, 2006, abgerufen am 8. April 2010.
- Nuclear Receptor Resource. Jack Vanden Heuvel, abgerufen am 8. April 2010.
Einzelnachweise
- ↑ Zhang Z, Burch PE, Cooney AJ, Lanz RB, Pereira FA, Wu J, Gibbs RA, Weinstock G, Wheeler DA: Genomic analysis of the nuclear receptor family: new insights into structure, regulation, and evolution from the rat genome. In: Genome Research. 14. Jahrgang, Nr. 4, April 2004, S. 580–90, doi:10.1101/gr.2160004, PMID 15059999, PMC 383302 (freier Volltext).
- ↑ GO-Terminus ligand-dependent nuclear receptor activity.
- ↑ a b Detlev Ganten, Klaus Ruckpaul: Molekularmedizinische Grundlagen von Endokrinopathien. Springer, Berlin 2001, ISBN 3-540-67788-7, S. 7 ff.
- ↑ Nuclear Receptors Nomenclature Committee: A unified nomenclature system for the nuclear receptor superfamily. In: Cell. 97. Jahrgang, Nr. 2, 1999, S. 161–3, doi:10.1016/S0092-8674(00)80726-6, PMID 10219237.
- ↑ Laudet V: Evolution of the nuclear receptor superfamily: early diversification from an ancestral orphan receptor. In: J. Mol. Endocrinol. 19. Jahrgang, Nr. 3, 1997, S. 207–26, doi:10.1677/jme.0.0190207, PMID 9460643.
Auf dieser Seite verwendete Medien
Created myself using CambridgeSoft BioDraw.Boghog2 10:14, 9 June 2007 (UTC) Mechanism nuclear receptor action. This figure depicts the mechanism of a class I nuclear receptor (NR) which, in the absence of ligand, is located in the cytosol. Hormone binding triggers dissociation of heat shock proteins (HSP), dimerization, and translocation to the nucleus where it binds to a specific sequence of DNA known as a hormone response element (HRE). The nuclear receptor DNA complex in turn recruits other proteins that are responsible for translation of downstream DNA into RNA and eventually protein which results in a change in cell function
Created myself using CambridgeSoft BioDraw. Mechanism nuclear receptor action. This figure depicts the mechanism of a class II nuclear receptor (NR) which, regardless of ligand binding status is located in the nucleus bound to DNA. For the purpose of illustration, the nuclear receptor shown here is the thyroid hormone receptor (TR) heterodimerized to the RXR. In the absence of ligand, the TR is bound to corepressor protein. Ligand binding to TR causes a dissociation of corepressor and recruitment of coactivator protein which in turn recruit additional proteins such as RNA polymerase that are responsible for transcription of downstream DNA into RNA and eventually protein which results in a change in cell function.

