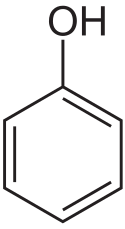
Phenol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H6O | |||||||||||||||||||||
| Kurzbeschreibung | farblose, durch Verunreinigungen oft rötlich gefärbte, charakteristisch durchdringend süßlich riechende, hygroskopische, nadelförmige Kristalle[2][3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 94,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest[2] | |||||||||||||||||||||
| Dichte | 1,07 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | 182 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert | 9,99[5] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex | 1,5408 (41 °C)[7] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Phenol oder Hydroxybenzol (veraltet auch Karbolsäure, älter Carbolsäure, oder kurz Karbol oder Carbol) ist eine aromatische organische Verbindung, die aus einer Phenylgruppe (–C6H5), die an eine Hydroxygruppe (–OH) gebunden ist besteht. Phenol bildet farblose, durch Verunreinigungen oft rötlich gefärbte, charakteristisch durchdringend süßlich riechende, hygroskopische, nadelförmige Kristalle und ist giftig.
Phenol ist eine wichtige Industriechemikalie und dient als Zwischenprodukt besonders zur Herstellung diverser Kunststoffe. Es kommt in der Natur in zahlreichen Pflanzen vor. Phenol ist der einfachste Vertreter der Phenole. Mit Basen bildet Phenol Salze, die Phenolate.
Nomenklatur
Der systematische IUPAC-Name lautet Benzenol. Die heutzutage bevorzugte IUPAC-Bezeichnung ist jedoch Phenol.[13]
Geschichte
Phenol wurde im Jahr 1834 vom Chemiker Friedlieb Ferdinand Runge bei der Destillation von Steinkohlenteer entdeckt; er bezeichnete die Substanz als „Carbolsäure“. Auguste Laurent entdeckte sie 1841 erneut und ermittelte die Summenformel als C6H6O. Charles Gerhardt nannte sie Phenol.[14] Der Name weist auf das Leuchtgas hin, welches neben Steinkohlenteer bei der Produktion von Koks entstand. Leuchtgas (Stadtgas) diente damals zur Beleuchtung der Städte (vgl. griechisch phainomai „leuchten“).
Joseph Lister setzte es 1865 – in zwei- („Karbolwasser“)[15] oder fünfprozentiger Lösung – als Antiseptikum bei der Wunddesinfektion ein; damals war die „Carbolsäure“ nahezu das einzig verfügbare Mittel gegen Wundinfektionen.[4] Wegen seiner hautirritierenden Nebenwirkung wurde es aber bald durch andere Antiseptika ersetzt. Wegen seiner bakteriziden Wirkung wurde es als Desinfektionsmittel eingesetzt. Zur Zeit der Russischen Grippe um 1890 wurden in England Gummiballons (Carbolic Smoke Balls) verkauft, die Karbolsäure enthielten, deren Dämpfe zum Schutz vor Infektionen mehrmals täglich eingeatmet werden sollten. Heute werden zur Desinfektion stattdessen Derivate des Phenols verwendet.[16]
In der Lebensmittelanalytik wurde Phenol zum Nachweis von Peroxidasen im Fleisch verwendet. Bei der Karbolprobe wurde 2 ml Fleischfiltrat mit einer 5%igen Phenollösung und 3 Tropfen einer 3%igen Wasserstoffperoxidlösung versetzt und die entstehende Farbe beurteilt.[17]
Phenol wird zusammen mit Formaldehyd zur Herstellung der Phenoplast-Kunstharze verwendet: Unter dem Warenzeichen Bakelit wurde Phenolharz zu Beginn des 20. Jahrhunderts als erster vollsynthetischer, industriell produzierter Kunststoff hergestellt.
Während des Holocausts ermordeten SS-Ärzte KZ-Häftlinge u. a. durch intrakardiale Phenolinjektionen.[18][19][20]
Zu den neueren bekannten Phenolderivaten gehört das 1977 entwickelte Narkosemittel Propofol.[21]
Vorkommen
Phenol kommt in der Natur in vielen Pflanzen vor. Nachgewiesen wurde es unter anderem in[22]
- Kräutern und Gewürzen, wie Majoran, Rooibos, Gewürzvanille, Polei-Minze, Estragon, Tee, Zimt, Echtem Süßholz, Echtem Johanniskraut, Winter-Bohnenkraut, Sesam, Baikal-Helmkraut, Spanischem Pfeffer, Wiesenklee, Färberdisteln, Kalmus, Gewöhnlichem Froschlöffel, Besen-Beifuß und der Weinraute.
- Gemüsen und Früchten, wie der Gemeinen Schafgarbe, Heidelbeeren/Amerikanischen Heidelbeeren, Gemüsespargel, Tomaten und Weißen Maulbeeren.
- Bäumen und Sträuchern, wie Waldkiefern, dem Sandelholzbaum, dem Tamarindenbaum, Zitrusfrüchten, Pinus elliottii, der Virginischen Zaubernuss, dem Japanischen Liguster, Myrica cerifera, Virginischem Tabak und Indischem Patschuli.
Gewinnung und Darstellung
Phenole sind nicht durch elektrophile aromatische Substitution darzustellen, da ein entsprechendes Sauerstoff-Elektrophil nicht zugänglich ist.
Industrielle Herstellung
Im industriellen Maßstab wird die Grundchemikalie Phenol durch das Cumolhydroperoxid-Verfahren, auch als Phenolsynthese nach Hock (Hock-Verfahren) bekannt, hergestellt:

Benzol und Propen werden zunächst durch eine Friedel-Crafts-Alkylierung im Sauren in Isopropylbenzol (Cumol) überführt. Cumol wird durch Luftsauerstoff zum Hydroperoxid oxidiert, welches durch saure Aufarbeitung unter Umlagerung zu Phenol und Aceton zerfällt.[4] Das gleichzeitige Entstehen zweier leicht trennbarer, wertvoller Produkte macht dieses Verfahren besonders wirtschaftlich.
Herstellung aus nachwachsenden Rohstoffen
Seit längerer Zeit wird an Möglichkeiten geforscht, Phenol aus nachwachsenden Rohstoffen und insbesondere aus Lignin herzustellen.[23] Dazu eignen sich verschiedene Pyrolysevarianten mit anschließender Produktaufbereitung.[24][25] Allerdings wird aktuell geschätzt, dass erst in den 2040er Jahren eine solche Phenolproduktion kommerzialisiert wird.[26]
Herstellung im Labor
Im Labormaßstab werden Phenole auch durch Verkochen von Diazoniumsalzen, welche durch die Diazotierung von aromatischen Aminoverbindungen – hier von Anilin – mit Salpetriger Säure in der Kälte entstehen, hergestellt:

Eine weitere Darstellungsmöglichkeit besteht im Zusammenschmelzen des Natriumsalzes der Benzolsulfonsäure mit Alkalihydroxid in einer nucleophilen aromatischen Substitution nach Additions-Eliminierungs-Mechanismus (ipso-Substitution):

Im Sinne einer radikalischen Substitution kann Benzol in der Fenton-Reaktion zu Phenol umgesetzt werden. Die Baeyer-Villiger-Oxidation von Acetophenon liefert Essigsäurephenylester, welches nach Verseifung Phenol freisetzt.
Eigenschaften

Physikalische Eigenschaften
Reines Phenol bildet bei Zimmertemperatur farblose Kristallnadeln, jedoch ist das kommerziell erhältliche Produkt i. d. R. durch geringe, aber intensiv gefärbte Verunreinigungen rosa bis rötlich-braun gefärbt.[27] Der Schmelzpunkt liegt bei 41 °C und der Siedepunkt bei 182 °C. Es besitzt einen charakteristischen, aromatischen, durchdringend süßlichen Geruch und einen brennend scharfen Geschmack.[2][3][28] Wegen der hydrophilen OH-Gruppe ist Phenol hygroskopisch. In Phenol löst sich begrenzt viel Wasser. Bei etwa 6 % Wasser ist das Gemisch bei 20 °C flüssig.[4] Phenol löst sich nur mäßig in Wasser. Zwischen den Lösungen mit hohem und niedrigem Phenolanteil besteht eine Mischungslücke.[29] Mit Wasser verflüssigtes Phenol wurde im medizinischen Bereich als Phenolum liquefactum bezeichnet.[30]
Chemische Eigenschaften
Die Hydroxygruppe des Phenols reagiert im Vergleich zu Alkoholen stärker sauer; daher ist Phenol eine schwache organische Säure. Die Ursache ist die Mesomeriestabilisierung der korrespondierenden Base des Phenolations. Die negative Ladung kann in den Ring delokalisiert werden.

Im Gegensatz zu Alkoholen gehen Phenole nur bei hohen Temperaturen und Anwesenheit spezieller Katalysatoren nukleophile Substitutionsreaktionen unter Ersatz der Hydroxygruppe durch andere Nukleophile ein.[31] Die Hydroxy-Funktion zeigt, besonders im deprotonierten Zustand, einen ausgeprägten +M-Effekt. Daneben zeigt sie einen −I-Effekt. Da dieser aber deutlich kleiner ist als der +M-Effekt, wird Phenol sehr leicht elektrophil angegriffen. Der Angriff erfolgt bevorzugt in ortho- und para-Position zur Hydroxygruppe. Wegen des elektronenschiebenden Charakters der Hydroxygruppe ist Phenol etwa tausendmal reaktiver als Benzol. Die Bevorzugung des ortho- bzw. para-Angriffs von Elektrophilen lässt sich einerseits durch Betrachtung der Grenzstrukturen des Phenolat-Anions verstehen. Die negative Ladung wird in den aromatischen Ring auf die ortho- und para-Positionen delokalisiert. Da Elektrophile bevorzugt elektronenreiche Positionen angreifen, kommt es zu der beobachteten Regioselektivität. Andererseits ist der bei der Substitution als Zwischenstufe entstehende σ-Komplex (Carbeniumion) in ortho- und para-Position mesomeriestabilisierter als in meta-Position, da mehr energiearme Grenzstrukturen möglich sind und die Delokalisierung der Elektronen somit ausgeprägter ist. Die Substitution in para-Position ist zusätzlich bevorzugt, da es dort nicht zu sterischen Wechselwirkungen des angreifenden Elektrophils mit den freien Elektronenpaaren des Sauerstoffs kommt.
Die Keto-Enol-Tautomerie liegt wegen der Ausbildung des thermodynamisch günstigen aromatischen Systems vollständig auf der Enol-Seite.
Eine technisch bedeutende nukleophile Substitutionsreaktion ist die Darstellung von Anilin aus Phenol bei 250 °C und Anwesenheit eines Oxid-Katalysators (Aluminium-, Silicium- oder Magnesiumoxid, auch Borsäure) als „Halcon-Prozess“.[32]
Phenol setzt sich durch katalytische Hydrierung zu Cyclohexanol um.
Verwendung

Phenol wird hauptsächlich als Ausgangsstoff zur Herstellung von Kunststoffen verwendet. Dabei spielt die Herstellung von Phenoplasten die wichtigste Rolle. Phenol wird auch zu Caprolactam umgesetzt, einem Stoff zur Herstellung von Polyamiden. Die Umsetzung zu Bisphenol A liefert einen wichtigen Ausgangsstoff zur Herstellung von Epoxidharzen.
Aus Phenol wird das Arzneimittel Acetylsalicylsäure hergestellt. In der Mikroskopie wird Phenol zur Konservierung und zur Gram-Färbung verwendet. Kosmetische Produkte dürfen in der EU und in Kanada kein Phenol mehr enthalten.[33][34][35][36]
Früher wurde eine Lösung von 22 Promille Phenol pro Liter Wasser als Desinfektionsmittel eingesetzt, sogenanntes Karbolwasser oder Karbollösung. Wegen der Giftigkeit und auftretenden Hautirritationen wurde Karbolwasser (etwa als Carbolspray)[37] bald nach der Entdeckung anderer Desinfektionsmittel nicht mehr verwendet. Von dieser Verwendung leitet sich die Bezeichnung von (jungen) Krankenschwestern als Karbolmäuschen ab.
Darüber hinaus wurde Phenol zur Inaktivierung von Krankheitserregern für die Impfstoffherstellung genutzt (Phenolvakzine).[38]
Das billig herzustellende Phenol wird verschiedenen industriellen Produkten beigemischt, teilweise als Konservierungsmittel mit ähnlichen Eigenschaften wie Formaldehyd und als Inhaltsstoff von Abbeizmitteln zur Entfernung von Epoxy- und PU-Beschichtungen in der Luftfahrtindustrie.[39]
Sicherheitshinweise
Phenol wirkt sowohl lokal als auch systemisch stark toxisch; bei dermaler Exposition besitzt es eine reizende bis ätzende Wirkung auf Schleimhäute, Haut und Augen. Die Augen können Schäden in Form einer Trübung der Hornhaut, Schwellungen und Verwachsung der Lider bis zur Erblindung erleiden. Hautkontakt führt zuerst zu Hautrötung, später zu einer Weißverfärbung; längere Einwirkungszeit verursacht eine Dunkelfärbung bis zur Bildung von Nekrosen.[2] Der Geschmack wird als brennend scharf beschrieben.[28]
Phenol wird vorwiegend über die Haut resorbiert, aber auch inhalative oder orale Aufnahme ist möglich. Im menschlichen Organismus schädigt die Substanz akut Nieren, Blut, Zentralnerven- und Herz-Kreislauf-System. Bei chronischer Exposition sind auch gastrointestinale und nervale Störungen, weiterhin Schädigung von Leber, Nieren und Hautveränderungen bekannt. Bei Inhalation wurden als Vergiftungssymptome Schwindel, Kopfschmerz und Störungen der Ohren, Erbrechen, Schlaflosigkeit und Nierenreizung beschrieben. Die Aufnahme hoher Mengen führte innerhalb weniger Stunden zu massiven Nierenfunktionsstörungen bis zu akutem Nierenversagen. Orale Aufnahme bewirkt Verätzungen im Mund, Rachen, Speiseröhre und Magen; weiterhin sind Schluckstörungen und Störungen im Magen-Darm-Trakt bekannt.[2]
Die Toxizität wird auf reaktive Metaboliten des Phenol zurückgeführt, die an die Desoxyribonukleinsäure (englisch abgekürzt DNA) und andere Makromoleküle binden und dabei Brüche in den Chromosomen und mutagene Effekte auslösen können. Eine orale Dosis ab 1 g kann vereinzelt für einen erwachsenen Menschen tödlich sein; individuell wurden aber auch wesentlich höhere Dosen überlebt.[2] Der orale LDLo-Wert für den Menschen liegt zwischen 140[12] und 1400 mg/kg Körpergewicht; bei Kindern beträgt die orale minimale letale Dosis 10 mg/kg Körpergewicht.[11][2]
Laut der Internationalen Agentur für Krebsforschung gibt es für die Bewertung der Karzinogenität von Phenol eine unzureichende Datenlage. Es wird vermutet, dass Phenol nicht krebserregend ist.[3]
Risikobewertung
Phenol wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Phenol waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und anderer gefahrenbezogener Bedenken sowie der möglichen Gefahr durch mutagene Eigenschaften. Die Neubewertung fand ab 2015 statt und wurde von Dänemark durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[40][41]
Historische Beschreibung
„Karbolsäure (Steinkohlenteerkreosot, acidum phenylicum, acidum carbolicum). Eine Substanz, die für die Farbenindustrie und Medizin (als Desinfektionsmittel) eine außerordentliche Bedeutung erlangt hat. Der Handelsname ist immer noch Karbolsäure, während der wissenschaftliche Name jetzt Phenol ist; diese Substanz besitzt zwar die Eigenschaften einer schwachen Säure und ist imstande, sich mit Basen zu verbinden, wird deshalb auch Phenylsäure oder Phensäure genannt, zugleich aber und in noch höherem Grade spielt sie die Rolle eines Alkohols, daher auch der Name Phenylalkohol, den man in Phenol gekürzt hat. Man gewinnt die Karbolsäure hauptsächlich aus dem Steinkohlenteer und dem Braunkohlenteer, im Holzteer sind nur äußerst geringe Mengen davon enthalten, denn das Kreosot des Holzteers besteht nicht, wie man eine Zeit lang glaubte, aus Phenol, sondern aus dem strukturell ähnlichen Kresol,[42] sowie noch einigen anderen Stoffen. Um die Karbolsäure zu gewinnen, behandelt man den zwischen 150 und 200 °C übergehenden Teil des Teers mit Natronlauge, welche sich mit der Karbolsäure und dem Kresol, das auch im Steinkohlenteer enthalten ist, verbindet, trennt diese Lösung von den übrigen Teerbestandteilen und zersetzt sie mit einer Säure. Man destilliert dann das abgeschiedene ölige Produkt und fängt das, was über 190 °C übergeht, besonders auf; letzteres wird als rohes Kresol, das, was unter 190 °C übergeht, als rohe Karbolsäure verkauft. Beide Substanzen sind in diesem Zustande noch braune, sehr übel riechende, ölige Flüssigkeiten. Diese rohe Karbolsäure (acidum carbolicum crudum) wird teils weiter gereinigt, teils wird sie zur Konservierung von Holz und zum Desinfizieren von Abtrittgruben verwendet.“
Weblinks
Einzelnachweise
- ↑ August Laurent: Ueber das Phenol (Phenyloxydhydrat, phenylige Säure). In: Journal für Praktische Chemie. 52, 1851, S. 279–282. doi:10.1002/prac.18510520125.
- ↑ a b c d e f g h i j k l m n o Eintrag zu Phenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c Phenol: general information. UK Health Security Agency, abgerufen am 17. Mai 2025 (britisches Englisch).
- ↑ a b c d Eintrag zu Phenol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Juni 2013.
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Phenol. In: Gefahrstoffinformationsssystem Chemikalien. Berufsgenossenschaft Rohstoffe und chemische Industrie, Berufsgenossenschaft Holz und Metall, 29. April 2024, abgerufen am 7. Mai 2024 (deutsch).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-422.
- ↑ Eintrag zu Phenol in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 108-95-2 bzw. Phenol), abgerufen am 2. November 2015.
- ↑ Stoffliste (MAK-Werte und TRK-Werte), Verordnung des Bundesministers für Arbeit über Grenzwerte für Arbeitsstoffe sowie über krebserzeugende und fortpflanzungsgefährdende (reproduktionstoxische) Arbeitsstoffe (Grenzwerteverordnung 2021 – GKV), Österreich, abgerufen am 27. August 2021.
- ↑ a b c W. B. Deichmann: Toxicology of Drugs and Chemicals. New York 1969, Academic Press, S. 463.
- ↑ a b R. Lefaux, O. H. Cleveland: Practical Toxicology of Plastics. Chemical Rubber Co., 1968, S. 329.
- ↑ Henri A Favre, Warren H Powell: Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Hrsg.: The Royal Society of Chemistry. Cambridge 2014, ISBN 978-0-85404-182-4, S. 416, 668.
- ↑ Max Bloch, in Günther Bugge, Das Buch der großen Chemiker, Band 2, Verlag Chemie, Berlin 1930, S. 92–114.
- ↑ Wörterbuch der Veterinärmedizin, 2. Auflage, S. 617
- ↑ Heinz Lüllmann, Klaus Mohr, Lutz Hein, Pharmakologie und Toxikologie, Georg Thieme, Stuttgart, 2010, S. 541 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Wörterbuch der Veterinärmedizin, 2. Auflage, S. 617
- ↑ Die SS-Ärzte. ( vom 4. März 2016 im Internet Archive) Website der KZ-Gedenkstätte Mauthausen. Abgerufen am 9. Juli 2019.
- ↑ Hans Halter: Die Mörder sind noch unter uns. NS-Ärzte - Von der Euthanasie. Bericht im Spiegel 25/1988, 20. Juni 1988, S. 112–122.
- ↑ Karin Orth: Das System der nationalsozialistischen Konzentrationslager. Eine politische Organisationsgeschichte. Hamburg 1999.
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 883.
- ↑ a b PHENOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Juli 2023.
- ↑ Joseph Zakzeski, Pieter C. A. Bruijnincx, Anna L. Jongerius & Bert M. Weckhuysen: The Catalytic Valorization of Lignin for the Production of Renewable Chemicals. In: Chemical Reviews. Band 110, Nr. 6, 2010, S. 3565–3567, doi:10.1021/cr900354u.
- ↑ Joy Esohe Omoriyekomwan, Arash Tahmasebi & Jianglong Yu: Production of phenol-rich bio-oil during catalytic fixed-bed and microwave pyrolysis of palm kernel shell. In: Bioresource Technology. Band 207, 2016, S. 188–196, doi:10.1016/j.biortech.2016.02.002.
- ↑ Dengle Duan, Hanwu Lei,Yunpu Wang, Roger Ruan, Yuhuan Liu, Lijun Ding, Yayun Zhang & Lang Liu: Renewable phenol production from lignin with acid pretreatment and ex-situ catalytic pyrolysis. In: Journal of Cleaner Production. Band 231, 2019, S. 331–340, doi:10.1016/j.jclepro.2019.05.206.
- ↑ Vinoth Kumar Ponnusamy, Dinh Duc Nguyen, Jeyaprakash Dharmaraja, Sutha Shobana, Rajesh Banu, Rijuta Ganesh Saratale, Soon Woong Chang & Gopalakrishnan Kumar: A review on lignin structure, pretreatments, fermentation reactions and biorefinery potential. In: Bioresource Technology. Band 271, 2019, S. 462–472, doi:10.1016/j.biortech.2018.09.070.
- ↑ Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack, Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt (Main), 2001.
- ↑ a b The Merck Index - Fifteenth Edition. Royal Society of Chemistry, 2013, ISBN 978-1-84973-670-1, S. 1347 (englisch).
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
- ↑ Arnold Willmes, Taschenbuch Chemische Substanzen, Harri Deutsch, Frankfurt (M.), 2007, S. 583.
- ↑ S. A. Lawrence: Amines: synthesis, properties and applications, Cambridge University Press, 2004, ISBN 978-0-521-78284-5, S. 80.
- ↑ Hans-Jürgen Arpe, Klaus Weissermel: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. 6. Auflage, Wiley-VCH, 2007, ISBN 978-3-527-31540-6, S. 418.
- ↑ Prohibited substances in cosmetic product (Annex II, #1175, Phenol) - European Commission. In: ec.europa.eu. Abgerufen am 6. Juli 2018 (englisch).
- ↑ CosIng - Cosmetics - GROWTH - European Commission. In: ec.europa.eu. Abgerufen am 6. Juli 2018 (englisch).
- ↑ Health Canada: Cosmetic Ingredient Hotlist - Canada.ca. In: www.canada.ca. 18. Juni 2004, abgerufen am 6. Juli 2018 (englisch).
- ↑ Health Canada: Cosmetic Ingredient Hotlist: Prohibited and Restricted Ingredients - Canada.ca. In: www.canada.ca. 18. Juni 2004, abgerufen am 6. Juli 2018 (englisch).
- ↑ Nicolai Guleke: Kriegschirurgie und Kriegschirurgen im Wandel der Zeiten. Vortrag gehalten am 19. Juni 1944 vor den Studierenden der Medizin an der Universität Jena. Gustav Fischer, Jena 1945, S. 14.
- ↑ J. P. McGettigan: Experimental rabies vaccines for humans. In: Expert Rev Vaccines (2010), Band 9, Heft 10, S. 1177–1186. doi:10.1586/erv.10.105. PMID 20923268. PMC 3072237 (freier Volltext).
- ↑ CH207 Aircraft paintstripper, phenolic, acid. Callington, 14. Oktober 2009, archiviert vom am 23. September 2015; abgerufen am 25. August 2015 (englisch).
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Phenol, abgerufen am 6. März 2022.
- ↑ Kresol ist Methylphenol.
- ↑ Karbolsäure. In: Merck’s Warenlexikon. 3. Auflage. 1884 ff., S. 250 f.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
(c) Forest & Kim Starr, CC BY 3.0
Origanum majorana (habit). Location: Maui, Kula Ace Hardware and Nursery
mesomeriestabilisiertes Phenolation
Autor/Urheber: Bartłomiej Bulicz, Lizenz: CC BY-SA 3.0
Kryształy fenolu w formie igieł
Struktur von Phenol