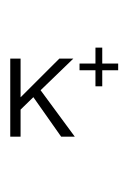Kaliumhexafluorosilicat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
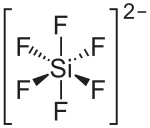 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumhexafluorosilicat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | K2[SiF6] | |||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 220,27 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Kaliumhexafluorosilicat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Hexafluorosilicate und das Kaliumsalz der Hexafluorokieselsäure.
Vorkommen
Kaliumhexafluorosilicat kommt natürlich in Form der Minerale Hieratit und Demartinit vor.[6]
Gewinnung und Darstellung
Kaliumhexafluorosilicat kann durch Reaktion von Hexafluoridokieselsäure mit Kaliumhydroxid oder Kaliumchlorid gewonnen werden.[7]
Eigenschaften
Kaliumhexafluorosilicat ist ein weißer Feststoff, der schwer löslich in Wasser ist. Er zersetzt sich bei Erhitzung oder in heißem Wasser[8], wobei Fluorwasserstoff und Siliciumtetrafluorid entstehen.[1] Er ist ohne Zersetzung schmelzbar unter Zusatz von Kaliumfluorid. Er besitzt eine kubische Kristallstruktur mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225). Es ist auch noch eine zweite Modifikation mit der Raumgruppe P63mc (Raumgruppen-Nr. 186) bekannt.[3][2]
Verwendung
Kaliumhexafluorosilicat wird bei der Herstellung von Porzellan und auch für die Konservierung von Holz verwendet. Es ist an der Herstellung von Keramik, Aluminium und Magnesiumschmelzen beteiligt und dient darüber hinaus als Zwischenprodukt bei der Herstellung von optischem Glas.[9]
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Kaliumhexafluorosilikat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ a b J. H. Loehlin: Redetermination of the structure of potassium hexafluorosilicate, K2SiF6. In: Acta Crystallographica Section C Crystal Structure Communications. Band 40, Nr. 3, 15. März 1984, S. 570–570, doi:10.1107/s0108270184004893.
- ↑ a b R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 524 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 324 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Alkalihexafluorosilikate(K) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 21. November 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ mineralienatlas.de: Mineralienatlas Lexikon - Hieratit, abgerufen am 21. November 2016
- ↑ Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3217 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ D. Menz, W. Wilde, L. Kolditz, K. Heide: Dynamisch thermische analyse der Zersetzung von K2SiF6. In: Journal of Fluorine Chemistry. 24 (3), 1984, S. 345–354, doi:10.1016/S0022-1139(00)81323-8.
- ↑ Datenblatt Potassium hexafluorosilicate, 99.999% (metals basis) bei AlfaAesar, abgerufen am 21. November 2016 (PDF) (JavaScript erforderlich).
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Struktur des K+-Ions
Struktur des Hexafluorosilicat-Ions
Die Zahl 2