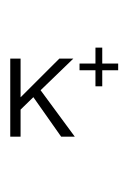Kaliumcarbid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||
| Name | Kaliumcarbid | |||||||||
| Andere Namen | Dikaliumacetylid | |||||||||
| Summenformel | K2C2 | |||||||||
| Kurzbeschreibung | gelber Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 102,22 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Kaliumcarbid (Dikaliumdicarbid) ist eine chemische Verbindung aus der Gruppe der Carbide. Neben dieser Verbindung sind mit KC8, KC16 und weitere Kaliumcarbide bekannt.[1]
Gewinnung und Darstellung
Kaliumcarbid kann durch Umsetzung von in flüssigem Ammoniak gelöstem Kalium mit Ethin und durch anschließendes Erhitzen des erhaltenen Hydrogenacetylides im Hochvakuum phasenrein dargestellt werden. Die erste Synthese von Natriumcarbid und Kaliumcarbid führte Henri Moissan Ende des 19. Jahrhunderts durch.[3] Abhängig von der Temperatur kann auch KHC2 entstehen.[1]
Durch Reaktion von Kalium mit Kohlenstoff kann die Verbindung nicht hergestellt werden.[4]
Kaliumcarbid kann auch durch Zersetzung von Kaliummethanolat bei 300 °C oder durch Reaktion von Kaliumcyanid mit Magnesium gewonnen werden.[1]
Eigenschaften

Kaliumcarbid ist ein gelber Feststoff[1], der sich bei Kontakt mit Wasser entzündet.[5] Die Verbindung kristallisiert tetragonal in der Raumgruppe I41/acd (Raumgruppen-Nr. 142) und kann als verzerrte Variante der Antifluorit-Struktur aufgefasst werden. Bei Temperaturen oberhalb Raumtemperatur (420 K) tritt in Analogie zu den Erdalkalimetallacetyliden eine reversible Phasenumwandlung (1. Ordnung) in eine kubische Hochtemperatur-Modifikation mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225) auf, die einer unverzerrten Antifluorit-Struktur mit fehlgeordneten C22–-Hanteln entspricht.[3]
Verwendung
Kaliumcarbid kann zur Herstellung von Ethinylsteroiden und 1,4-Dicarbonylverbindungen verwendet werden.[6]
Einzelnachweise
- ↑ a b c d e T. Y. Kosolapova: Carbides Properties, Production, and Applications. Springer Science & Business Media, 2012, ISBN 978-1-4684-8006-1, S. 64 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b S. Hemmersbach, B. Zibrowius, U. Ruschewitz: Na2C2 und K2C2: Synthese, Kristallstruktur und spektroskopische Eigenschaften. In: Zeitschrift für anorganische und allgemeine Chemie. 625, 1999, S. 1440, doi:10.1002/(SICI)1521-3749(199909)625:9<1440::AID-ZAAC1440>3.0.CO;2-R.
- ↑ Chris Woodford: Potassium. Marshall Cavendish, 2003, ISBN 978-0-7614-1463-6, S. 11 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ L. Bretherick: Bretherick's Handbook of Reactive Chemical Hazards. Elsevier, 2016, ISBN 978-1-4831-6250-8, S. 1996 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2001, ISBN 978-0-470-84289-8, Dipotassium Acetylide, doi:10.1002/047084289x.rd450/abstract.
Auf dieser Seite verwendete Medien
Autor/Urheber: Andif1, Lizenz: CC BY-SA 4.0
Unit cell of potassium carbide, K2C2. Created using Diamond 4. Structure data from https://dx.doi.org/10.1002/(SICI)1521-3749(199909)625:9%3C1440::AID-ZAAC1440%3E3.0.CO;2-R
Struktur des K+-Ions
Struktur des Acetylid-Anions
Die Zahl 2