Kaliumacetat
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
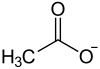 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Kaliumacetat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C2H3KO2 | |||||||||||||||||||||
| Kurzbeschreibung | farbloser, hygroskopischer Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 98,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Dichte | 1,57 g·cm−3 (25 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | gut wasserlöslich (2560 g·l−1 bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | −723,0 kJ/mol[5] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Kaliumacetat, CH3COOK, ist das Kaliumsalz der Essigsäure.
Eigenschaften
Kaliumacetat bildet farblose, hygroskopische Kristalle, die sich sehr gut (2560 g/l bei 20 °C) in Wasser lösen. Die Kristalle haben einen Schmelzpunkt von 292 °C und zersetzen sich ab ca. 440 °C. Es kommt in drei verschiedenen Kristallstrukturen vor: eine Form existiert von Raumtemperatur bis 75 °C, die zweite von 75 °C bis 155 °C, die dritte Form von 155 °C bis zum Schmelzpunkt.[6]
Gitterparameter der verschiedenen Modifikationen von Kaliumacetat[6]
| Temperaturbereich | Kristallsystem | a [Å] | b [Å] | c [Å] | β |
|---|---|---|---|---|---|
| bis 75 °C | monoklin | 18.21 | 23.30 | 4.05 | 100.8° |
| 75 °C bis 155 °C | monoklin | 9.31 | 5.82 | 4.03 | 99.2° |
| über 155 °C | orthorhombisch | 9.74 | 5.76 | 3.99 | - |
Verwendung
Kaliumacetat ist ein Lebensmittelzusatzstoff (E261) und dient der Säureregulation, d. h. der Einstellung des pH-Wertes (Pufferfunktion). Deshalb findet es Verwendung als Konservierungsmittel und Säuerungsmittel. Hochreines Kaliumacetat dient auch als Ausgangskomponente zur Medikamentenherstellung, z. B. für Penicillin-G-Kalium. Zudem wird Kaliumacetat zur Behandlung von Kaliummangel gegeben. Wegen seiner hygroskopischen Wirkung wird es als Feuchtigkeit entziehendes Mittel eingesetzt. In der Luftfahrt wird Kaliumacetat auch als biologisch abbaubares Mittel zur Flächenenteisung auf Flughäfen verwendet.
Herstellung
Kaliumacetat kann durch Salzbildungsreaktion aus Kaliumhydroxid und Essigsäure hergestellt werden.
Ebenso ist die Synthese aus Kaliumcarbonat und Essigsäure unter Entwicklung von Kohlendioxid möglich.
Einzelnachweise
- ↑ Eintrag zu E 261: Potassium acetates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- ↑ Eintrag zu POTASSIUM ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- ↑ a b c d e f Eintrag zu Kaliumacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ Eintrag zu Potassium acetate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ a b J. Hatibarua, G. S. Parry: "A crystallographic study of the acetates of potassium, rubidium and caesium" in Acta Cryst. 1972, B28, S. 3099; doi:10.1107/S0567740872007496.
Auf dieser Seite verwendete Medien
Struktur des Acetat-Ions
Struktur des K+-Ions

