Japanische Enzephalitis
| Klassifikation nach ICD-10 | |
|---|---|
| A83.0 | Japanische Enzephalitis |
| ICD-10 online (WHO-Version 2019) | |

Die Japanische Enzephalitis (Abkürzung: JE), auch Encephalitis japonica, ist eine durch Viren ausgelöste Tropenerkrankung, die vor allem in Ost- und Südostasien vorkommt. In den Endemiegebieten erkranken jährlich 30.000–50.000 Personen, vor allem Kinder. Erwachsene sind meist immun.
Erreger
| Japanische-Enzephalitis-Virus | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Japanese encephalitis virus | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| JEV | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|

Die Japanische Enzephalitis, auch Japanische B-Enzephalitis oder Russian autumn(al) encephalitis, wird durch das Japanische-Enzephalitis-Virus (englisch Japanese encephalitis virus, JEV; Spezies Orthoflavivirus japonicum) ausgelöst, ein Arbovirus (arthropod-borne virus), das wie der Erreger des Gelbfiebers (engl. Yellow fever virus, YFV) und des Denguefiebers (engl. Dengue virus, DENV) zur Familie Flaviviridae (Gattung Orthoflavivirus) gehört.[3][4] Bis September 2019 wurden fünf Genotypen des Virus identifiziert (JAOARS982, M28, Nakayama, SA(V) und SA-14).
Infektion
Die Japanische Enzephalitis ist eine Zoonose – das Erregerreservoir (Hauptwirte, Reservoirwirte) bilden Schweine und wildlebende Vögel (vor allem Reiher und andere Watvögel), seltener auch Pferde, Reptilien und Fledermäuse. Die Überträger (Vektor) sind Stechmücken der Gattungen Culex, Aedes und eventuell andere. Zu den wichtigsten zählen Culex tritaeniorhynchus (Reisfeldmücke) und Culex vishnui.
Das Infektionsrisiko für Touristen ist sehr gering (< 1/Million). Ein erhöhtes Infektionsrisiko besteht bei Langzeitaufenthalten in den Endemiegebieten vor allem auf dem Land, besonders am Ende der Regenzeit in den gemäßigten Gebieten und ganzjährig in den Tropen. Beim Infektionsrisiko besteht ein deutlicher Zusammenhang mit Reisanbau und Schweinezucht.
Epidemiologie
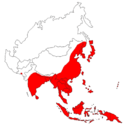
Die Japanische Enzephalitis ist in Asien weit verbreitet; hier leben etwa drei Milliarden Menschen in JEV-Endemiegebieten. In Japan selbst kommen, bedingt durch die systematische Durchimpfung der Haustiere, nur noch wenige Fälle vor. Hauptsächlich betroffen sind China, Indien, Sri Lanka, Nepal, Vietnam, die Philippinen und das nördliche Thailand. Jährlich werden in den Endemiegebieten 35.000 bis 50.000 Fälle mit mehr als 10.000 Toten bekannt, wobei die tatsächliche Anzahl der Erkrankungen deutlich höher liegen dürfte.
Symptomatik
In den meisten Fällen verläuft die Infektion mild oder sogar asymptomatisch. Bei 1 von 250 Erkrankten kommt es zu einem schweren Verlauf mit einer Gehirnentzündung (Enzephalitis). Nach einer Inkubationszeit von 5 bis 15 Tagen kommt es zu plötzlichem Fieber, Schüttelfrost, Kopfschmerzen und Muskelschmerzen (Myalgien). Bei Kindern kommt es oft zu Erbrechen und/oder Durchfall. Innerhalb kurzer Zeit treten Bewusstseinsstörungen auf. Verschiedene neurologische Symptome können auftreten. Die Letalität ist bei Krankheitsausbruch hoch (5–30 %) und die Krankheit hinterlässt oft bleibende Schäden.[5]
Diagnostik
Bei entsprechender Exposition kann die Verdachtsdiagnose aus dem klinischen Bild gestellt werden. Die weiterführende Diagnostik umfasst:
- Serologischer Antikörpernachweis (IgM-capture ELISA Test, der Virusnachweis mittels PCR ist nur in der ersten Krankheitswoche möglich)
- Blutbild: Leukozytose
- CT oder MRT
- Liquoruntersuchung: lymphozytäre Pleozytose bei normalem Glucosespiegel
Differentialdiagnosen stellen die zerebrale Malaria, eine bakterielle Meningitis, andere Virusinfektionen wie Enterovirus 71 oder andere dar.
Therapie
Da zurzeit keine spezifischen wirksamen Medikamente gegen JE verfügbar sind, ist die Therapie symptomatisch und beschränkt sich auf die Symptomlinderung. Sie umfasst die Unterstützung von lebenswichtigen Funktionen (Kreislauf, Atmung) und die Verhinderung von Sekundärinfektionen.
Vorbeugung
Die wichtigste vorbeugende Maßnahme ist die Vermeidung von Mückenstichen in der Dämmerung und nachts. Touristen sollten sich mit Repellentien, Mückennetzen und bedeckender Kleidung schützen. Bei längerem Aufenthalt in Endemiegebieten empfiehlt sich eine Schutzimpfung gegen JE, die nach zweimaliger Injektion (Tag 0 und Tag 28) einen sehr guten Schutz bietet. Die Dauer der Schutzwirkung ist bisher nicht bekannt, von der WHO werden derzeit Auffrischimpfungen nach 3 Jahren empfohlen.
Impfung
Bisher wurden weltweit zwei Impfstoffe japanischer Herkunft (v. a. Je-Vax Biken) verwendet, China benutzte chinesische Produkte. Seit 2009 ist in den USA und Europa ein neuer inaktivierter (nicht lebender) Impfstoff mit dem Stamm SA-14-14-2 IXIARO von Valneva (vorm. Intercell) erhältlich. Das Impfvirus wird auf Verozellen gezüchtet und nicht mehr in Mäusehirnen, wie bei den älteren Impfstoffen. Die neutralisierenden Antikörper, die gebildet werden, und ein Maßstab für den Schutz sind, sind mit den alten Impfstoffen vergleichbar gut. IXIARO ist zugelassen für die aktive Immunisierung gegen das Japanische Enzephalitis Virus bei Erwachsenen, Jugendlichen, Kindern und Säuglingen ab dem Alter von 2 Monaten und wird intramuskulär im Deltamuskel des Oberarmes appliziert (bei Säuglingen ist auch eine Impfung in die anterolaterale Oberschenkelmuskulatur möglich). Die Grundimmunisierung besteht aus zwei Impfdosen im Abstand von 28 Tagen; sie soll mindestens 1 Woche vor der Exposition abgeschlossen sein. Eine weitere Impfung nach 1–2 Jahren wird empfohlen. Die gemeldeten unerwünschten Wirkungen von IXIARO sind gering, am häufigsten lokale Schmerzen, Kopfweh, Muskelschmerzen, Müdigkeit. Die gefürchteten Reaktionen der alten Vakzinen (neurologische und allergische) wurden bisher nicht festgestellt. Weil die Anzahl der bisher geimpften Personen noch klein ist, können seltene unerwünschte Nebenwirkungen nicht ausgeschlossen werden. Zusatzstoffe in IXIARO sind neben Wasser NaCl, Dinatriumhydrogenphosphat, Kaliumdihydrogenphosphat und möglicherweise Spuren von Protaminsulfat und Formaldehyd aus dem Herstellungsprozess. Er enthält kein Thiomersal, keine Gelatine oder andere Stabilisatoren und Konservierungsmittel. In China wird ein Lebendimpfstoff mit dem Stamm SA 14-14-2 verwendet und in großen Impfaktionen mit gutem Erfolg verwendet. In Australien und Thailand wird demnächst ein chimärer Impfstoff ChimeriVax-Je zugelassen werden. DNA-Impfstoffe sind in Entwicklung, aber noch nicht marktreif.
Indikationen für eine Impfung
Die Weltgesundheitsorganisation (WHO) empfiehlt die Impfung Asienreisenden, die sich längere Zeit in Ländern aufhalten, in denen die Japanische Enzephalitis gehäuft auftritt.[6] Diese sind Bangladesch, China, Indien, Indonesien, Japan, Kambodscha, Nord- und Südkorea, Laos, Myanmar, Nepal, Teile Ozeaniens, die Philippinen, Indusdelta von Pakistan, Sri Lanka, Taiwan, Thailand und Vietnam. Insbesondere sind ländliche Regionen in mückenreichen Jahreszeiten betroffen.
Gegenanzeigen (Kontraindikation) zur Impfung
Personen mit akuten, behandlungsbedürftigen Krankheiten mit hohem Fieber, sollen nicht geimpft werden. Nicht geimpft werden dürfen außerdem Personen mit bekannter oder vermuteter schwerer Überempfindlichkeit gegen Bestandteile des verwendeten Impfstoffs, etwa Personen, bei denen anamnestisch bei diesem Impfstoff eine allergische Reaktion, hohes Fieber oder eine andere unerwünschte Reaktion aufgetreten ist. Hierzu gehören ein juckender Ausschlag am gesamten Körper, ein stark geschwollenes Gesicht oder Schwellungen, Atemnot und Wassereinlagerungen auch an Armen, Beinen oder Hals.
Bei folgenden Personen müssen Nutzen und Risiken dieser Schutzimpfung sorgfältig abgewogen werden:
- Schwangere und stillende Frauen
- Personen, die schon einmal an einer Allergie oder Nesselfieber litten
- Personen mit Immunstörungen
Literatur
- Scott B. Halstead, Julie Jacobson: Japanese encephalitis. In: Advances in Virus Research, Band 61, 2003, ISSN 0065-3527, S. 103–138, doi:10.1016/S0065-3527(03)61003-1.
- Scott B. Halstead, Julie Jacobson: Japanese encephalitis vaccines. In: Stanley A. Plotkin, Walter A. Orenstein, Paul A. Offit Vaccines. 5. Auflage. Saunders/Elsevier, Philadelphia PA 2008, ISBN 978-1-4160-3611-1.
- Marc Fischer, Nicole Lindsey, J. Erin Staples, Susan Hills: Japanese Encephalitis Vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP). In: Morbidity and Mortality Weekly Report. Recommendations and Reports, Band 59, Nr. RR-1, 12. März 2010, ISSN 1057-5987, S. 1–32; Digitalisat cdc.gov (PDF; 1,55 MB).
- Ernest A. Gould, T. Solomon: Pathogenic flaviviruses. In: The Lancet, Band 371, Nr. 9611, 2008, S. 500–509, doi:10.1016/S0140-6736(08)60238-X.
- Susan L. Hills, Anne C. Griggs, Marc Fischer: Japanese Encephalitis among travelers from non endemic countries, 1973–2008. In: The American Journal of Tropical Medicine and Hygiene, Band 82, Nr. 5, 2010, ISSN 0002-9637, S. 930–936, doi:10.4269/ajtmh.2010.09-0676.
Weblinks
- Robert Koch-Institut: Steckbriefe seltener und importierter Infektionskrankheiten vom 15. September 2011; rki.de (PDF) S. 24.
Einzelnachweise
- ↑ a b c d ICTV: ICTV Taxonomy history: Yellow fever virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- ↑ ICTV Master Species List 2018b.v2. MSL #34, März 2019
- ↑ ICTV: Taxonomy Browser.
- ↑ ICTV: Virus Metadata Resource (VMR).
- ↑ Martin Haditsch: Neue Impfstoffe gegen Meningokokken-Meningitis und Japanische Encephalitis. (PDF) Website des Auswärtigen Amts; abgerufen am 28. Januar 2014.
- ↑ Japanese encephalitis. Weltgesundheitsorganisation
Auf dieser Seite verwendete Medien
Distribution of Japanese Encephalitis, produced by the Centre for disease control
Autor/Urheber: Sang-Im Yun and Young-Min Lee, Lizenz: CC BY 4.0
Genome organization and gene expression of Japanese encephalitis virus (JEV). (A) Genome organization. The genetically well-characterized JEV strain, CNU/LP2, contains a single-stranded positive-sense RNA genome of 10,968 nucleotides in length, consisting of a methylated cap at the 5′ end, followed by a 95-nucleotide 5′ non-coding region (5′NCR), a 10,299-nucleotide open reading frame (ORF), and a 574-nucleotide 3′NCR [164,165]. (B) Gene expression. The single ORF encoded in the viral genome produces two precursor polyproteins, a full-length 3432-amino acid polyprotein (ppC-NS5) and its C-terminally truncated 1198-amino acid polyprotein (ppC-NS1′), the latter of which is expressed by a −1 ribosomal frameshift (FS) event that occurs between the codons 8 and 9 of NS2A, adding 52 extra amino acids to the C-terminus of NS1 (designated NS1′). Each of the two polyproteins is cleaved by host- and virus-encoded proteases to yield three structural (green) and at least seven nonstructural (orange) proteins. The flavivirus-conserved cleavage sites and the length of cleavage products are indicated. NS3 consists of an N-terminal serine protease (PRO) domain and a C-terminal RNA helicase (HEL) domain, and NS5 consists of an N-terminal methyltransferase (MET) domain and a C-terminal RNA-dependent RNA polymerase (RDRP) domain. Asterisks indicate four N-linked glycosylation sites (NXT/S) found in the pr portion of prM (Asn15), E (Asn154), and NS1/NS1′ (Asn130 and Asn207). (C) Polyprotein membrane topology. The membrane orientation of the 10 major JEV proteins is predicted on the endoplasmic reticulum (ER) membrane, based on previous work with other flaviviruses [142,166,167,168,169].
Autor/Urheber: Mamiossa, Lizenz: CC BY-SA 4.0
Imatge al microscopi electrònic de partícules víriques causants de JEV