Indoxyl
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Indoxyl | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H7NO | |||||||||||||||
| Kurzbeschreibung | hellgelbe Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 133,15 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | löslich in Wasser, Alkalien, Ethanol und Diethylether[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Indoxyl ist ein Derivat des Indols und wird als eine Farbstoff-Vorstufe bei der natürlichen und synthetischen Herstellung von Indigo verwendet.
Indoxyl entsteht bei der Hydrolyse des in Pflanzen vorkommenden Glykosids Indican (Indoxyl-β-D-glucosid) durch Gärung (siehe Indigogewinnung).
Herstellung
Grundlage der Indigosynthese bei den Chemiekonzernen BASF und der Hoechst AG war die Heumann-Synthese und deren Weiterentwicklung, die Heumann-Pfleger-Synthese. Bei der zweiten Heumann-Synthese wird aus Anthranilsäure Indoxyl gewonnen:

Eigenschaften
Im alkalischen Medium wird das wasserlösliche, gelbe Indoxyl durch den Sauerstoff der Luft zum wasserunlöslichen, dunkelblauen Farbstoff (Pigment) Indigo oxidiert. Dabei werden vier Elektronen (e−) und vier Protonen (H+) auf ein Sauerstoff-Molekül übertragen.

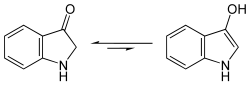
Indoxyl zeigt in wässriger Lösung eine gelbgrüne Fluoreszenz.[1] Indoxyl liegt im Gleichgewicht mit einer Enol-Form und einer Keto-Form (Keto-Enol-Tautomerie). Spektroskopische Befunde zeigen aber, dass bei Indoxyl dieses Gleichgewicht nahezu vollständig zur Keto-Form verschoben ist.[3]
Verwendung
Einige synthetische Indoxyl-Derivate finden Anwendung in der Biochemie:
- BCIP auch X-Phos (5-Brom-4-chlor-3-indoxylphosphat)
- X-Gal (5-Brom-4-chlor-3-indoxyl-β-D-galactopyranosid)
- X-Gluc (5-Brom-4-chlor-3-indolyl-β-D-glucuronsäure)
Siehe auch
Einzelnachweise
- ↑ a b c d Eintrag zu Indoxyl. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 3-Hydroxy-1H-indole im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 6. Juli 2020.
- ↑ Wittko Francke und Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag Stuttgart; 24. überarbeitete Auflage 2004, ISBN 3-7776-1221-9; S. 776.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
- Synthesis of Indoxyl (en)
- Synthese von Indoxyl (für die 2. Heumann'sche Indigosynthese) (de)
Indoxyl






