Indium(III)-fluorid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ In3+ _ F− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Indium(III)-fluorid | |||||||||||||||
| Andere Namen | Indiumtrifluorid | |||||||||||||||
| Verhältnisformel | F3In | |||||||||||||||
| Kurzbeschreibung | farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 171,82 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[2] | |||||||||||||||
| Dichte | 4,39 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | >1200 °C[2] | |||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser (0,4 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Brechungsindex | 1,453[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Indium(III)-fluorid ist eine anorganische chemische Verbindung des Indiums aus der Gruppe der Fluoride.
Gewinnung und Darstellung
Indium(III)-fluorid kann durch Pyrolyse von Ammoniumhexafluoroindat im Fluorstrom.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Indium(III)-oxid mit Fluor[1]
oder durch Reaktion von Indium(III)-chlorid mit Fluorwasserstoff bei 100 °C.[1]
Eigenschaften
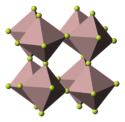
Indium(III)-fluorid ist ein farbloser Feststoff, der gegen kaltes und heißes Wasser beständig ist.[1] In kochendem Wasser hydrolysiert es zu Indiumoxidfluorid.[4] Indium(III)-fluorid löst sich (im Gegensatz zum Trihydrat) in Wasser sehr wenig, ist jedoch leicht löslich in verdünnten Säuren. Es wird von einem sehr langsamen Wasserstoff-Strom bei 300 °C zu (fast reinem) Indium(I,III)-fluorid reduziert, von einem raschen Wasserstoff Strom zum Metall.[1] Indium(III)-fluorid besitzt eine dem Vanadium(III)-fluorid analoge Kristallstruktur (trigonal, Raumgruppe R3c (Raumgruppen-Nr. 167), a = 5,4103 Å, c = 14,3775 Å[5]) mit nach allen Richtungen des Raumes hin eckenverknüpften Oktaedern von Fluoratomen.[6][7]
Verwendung
Indium(III)-fluorid wird in der Synthese von nicht-oxidischen Gläsern und Cyanhydrinen[8] sowie als Katalysator bei einigen chemischen Reaktionen eingesetzt.[9]
Einzelnachweise
- ↑ a b c d e f g Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 240.
- ↑ a b c d e f Datenblatt Indium(III) fluoride, anhydrous, 99.95% (metals basis) bei AlfaAesar, abgerufen am 24. September 2013 (PDF) (JavaScript erforderlich).
- ↑ Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 490 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J. J. Zuckerman: Inorganic Reactions and Methods, The Formation of Bonds to Hydrogen. John Wiley & Sons, 2009, ISBN 0-470-14536-6, S. 89 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. Hoppe, D. Kissel: Zur Kenntnis von AlF3 und InF3. In: Journal of Fluorine Chemistry, 1984, 24, S. 327–340 doi:10.1016/S0022-1139(00)81321-4
- ↑ William W. Porterfield: Inorganic Chemistry. Academic Press, 2013, ISBN 0-323-13894-2, S. 132 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dmitrii N. Khitarov, Boris Pavlovich Sobolev, Irina V. Alexeeva: The Rare Earth Trifluorides. Institut d'Estudis Catalans, 2001, ISBN 84-7283-610-X, S. 29 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt Indium(III) fluoride, ≥99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 24. September 2013 (PDF).
- ↑ Atta-ur-Rahman: Advances in Organic Synthesis: Modern Organofluorine Chemistry-Synthetic Aspects. Bentham Science Publishers, 2005, ISBN 1-60805-197-8, S. 192 (eingeschränkte Vorschau in der Google-Buchsuche).