Indirubin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Indirubin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C16H10N2O2 | |||||||||||||||||||||
| Kurzbeschreibung | roter Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 262,26 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | löslich in Ethanol, Diethylether und Aceton, unlöslich in Wasser, verdünnte Säuren und Laugen[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||

Indirubin, auch Indigorot, ist ein rotvioletter Farbstoff und ein Strukturisomer von Indigo (blau) bzw. von Isoindigo (braunrot).
Vorkommen
Unterschiedliche Spezies, zum Beispiel Isatis tinctoria (Färberwaid), Indigofera tinctoria oder einige Schneckenarten bilden natürliche Vorläufersubstanzen, aus denen die drei Isomeren oder deren Derivate entstehen. Die indigoiden Verbindungen selbst kommen in den lebenden Organismen nicht vor, sondern entstehen erst aus dem toten Material durch enzymatische oder saure Hydrolyse unter oxidativen Bedingungen. Neben Indigo entsteht Indirubin auch durch die Einwirkung bestimmter Bakterien auf das sogenannte metabolische Indikan oder Indoxylsulfat, das infolge eines gestörten Tryptophanabbaus bei Blaue-Windeln-Syndrom (Indicanurie) in größeren Mengen im Urin dieser Patienten entstehen kann und zu einer Violett- oder Blaufärbung des Urins führt.
Einige Vorläufersubstanzen, die alle Derivate des Indoxyls darstellen, sind im Reaktionsschema gezeigt. Als Zwischenstufen bei der Entstehung der indigoiden Farbstoffe treten Indoxylderivate mit freier Hydroxygruppe sowie Isatin-Derivate auf.
Synthese
Indirubin entstand zunächst nur als Nebenprodukt bei Versuchen, Indigo zu synthetisieren. Adolf von Baeyer und Emmerling[4] erhielten Indirubin in veränderlichen Anteilen neben Indigo, indem sie Isatin, Phosphortrichlorid und Essigsäurechlorid im zugeschmolzenen Glasrohr zusammen mit Phosphor erhitzten und anschließend wässrig aufarbeiteten. So wurde auch aus der Reaktion von 2-Chlor-3H-indol-3-on mit Ammoniumsulfid oder weißem Phosphor und anschließender wässriger Aufarbeitung[5] oder mit Zinkstaub in Eisessig[6] Indirubin als Nebenprodukt erhalten.
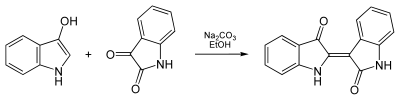
Erstmals gezielt wurde Indirubin von Baeyer aus einer ethanolischen Indoxyllösung, Isatin und Natriumcarbonat im Jahre 1881 synthetisiert.[7]
Verwendung
Im natürlichen Indigo bewirkt die Anwesenheit einer kleinen und veränderlichen Beimischung des roten Farbstoffs eine Variation in den Blautönen. Auch reines Indirubin wurde jedoch zum Färben von Textilien verwendet.[8] Die Anwendung in größerem Maßstab scheiterte aber an seiner geringen Farbechtheit.
Als wirksamer Bestandteil des natürlichen Indigo findet es auch seit Jahrhunderten Verwendung als Medikament, in der modernen Medizin wird es als Mittel gegen Krebs eingesetzt. Chronisch myeloische Leukämie (CML) wurde in China mit Danggui Longhui Wan behandelt, das aus zehn pflanzlichen Zutaten sowie Moschus besteht.[9] Die antileukämische Wirkung konnte auf eine einzige der pflanzlichen Zutaten, den Qingdai oder Indigo naturalis zurückgeführt werden. Im Weiteren konnte die antileukämische Eigenschaft einem einzigen Inhaltsstoff, dem Indirubin, zugeschrieben werden,[10][11] das im natürlichen Indigo in Mengen zwischen 0,05 und 0,3 % enthalten ist.[12][11] Auch in getrocknetem Pflanzenmaterial der Orchidaceae Calanthe discolor, mit dem in der traditionellen chinesischen Medizin Entzündungen und bakterielle Infektionen behandelt wurden, konnte Indirubin als Inhaltsstoff identifiziert werden.[13] Zwar zeigt es nur eine moderate Wirksamkeit, doch erregen seine im Vergleich zu anderen antileukämischen Mitteln sehr geringen Nebenwirkungen Interesse an seinem Wirkmechanismus, der ein anderer zu sein scheint als bei allen bis dato bekannten antileukämischen Wirkstoffen.
Befunde deuten darauf hin, dass der Antitumor-Wirkung von Indirubinderivaten ein komplexes Zusammenspiel mehrerer Teilmechanismen zugrunde liegt, unter Beteiligung von Interkalation und Redoxcycling, wobei der Hauptwirkmechanismus in der Hemmung von Enzymen besteht, die bei Ablauf des Zellteilungszyklus eine entscheidende Rolle spielen, sogenannte CDKs oder Cyclin-abhängige Kinasen. So sind Indirubin und einige seiner Derivate Inhibitoren des Enzymkomplexes CDK1/Cyclin B.[14][15]
Geschichte

Die Bezeichnung Indirubin tauchte erstmals 1855 auf. Isatan B, damals noch als Indican bezeichnet, wurde aus den Blättern des Färberwaids (Isatis tinctoria) isoliert und daraus Indirubin und Indigo gewonnen. Zitat: „Letztere Substanz ...“ (Indirubin) „... bildet sich stets bei der Zersetzung des Indicans durch Säuren, aber erst nach der Entstehung des Indigblaus und namentlich nach längerem Kochen der sauren Flüssigkeit, in welcher Indigblau aus Indican entstanden war“.[16] Eine Röntgenstrukturanalyse des Indirubins wurde 1961 publiziert.[17]
Einzelnachweise
- ↑ a b W. Müller (Hrsg.): Handbuch der Farbenchemie. Grundlagen, Technik, Anwendungen. Ecomed Verlagsgesellschaft, 3. Ergänzungslieferung 2003, ISBN 3-609-72700-4, S. 2. (Kapitel 13.6)
- ↑ a b Eintrag zu Indirubin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2H-Indol-2-one, 3-(1,3-dihydro-3-oxo-2H-indol-2-ylidene)-1,3-dihydro- im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 6. Juli 2020.
- ↑ A. Baeyer, A. Emmerling: Reduction des Isatins zu Indigblau... In: Chem. Ber. 1870, 3, S. 514–517.
- ↑ A. Baeyer: Synthese des Indigblaus... In: Chem. Ber. 1878, 11, S. 1296–1297.
- ↑ A. Baeyer: Über die Einwirkung des Fünffachchlorphosphors auf Isatin und auf verwandte Substanzen... In: Chem. Ber. 1879, 12, S. 456–461.
- ↑ A. Baeyer: Über die Verbindungen der Indigogruppe... In: Chem. Ber. 1881, 14, S. 1741–1750.
- ↑ Farbwerke vormals Meister Lucius & Brüning: Verfahren zur Darstellung von Derivaten der Indirubine. Patentschrift: DRP 283726, 1913.
- ↑ Chinesische Pharmakopöe (1995) Vol. 1
- ↑ C. Li, Y. Go, Z. Mao, K. Koyano, Y. Kai, N. Kanehisa, Q. Zhu, Z. Zhou, S. Wu: The Synthesis, Antileukemic Activitiy, and Crystal Structures of Indirubin Derivatives... In: Bull. Chem. Soc. Jpn. 1996, 69, S. 1621–1627.
- ↑ a b W. Tang, G. Eisenbrand: Chinese Drugs of Plant Origin: Chemistry, Pharmacology, and Use in Traditional and Modern Medicine. Springer, Heidelberg 1992, ISBN 0-387-19309-X.
- ↑ R. Han: Highlight on the Studies of Anticancer Drugs Derived from Plants in China... In: Stem Cells. 1994, 12, S. 53–63.
- ↑ M. Yoshikawa, T. Murakami, A. Kishi, T. Sakurama, H. Matsuda, M. Nomura, H. Matsuda, M. Kubo: Novel indole S,O-bisdesmoside, calanthoside, the precursor glycoside of tryptanthrin, indirubin, and isatin, with increasing skin blood flow promoting effects, from two Calanthe species (Orchidaceae)... In: Chemical and Pharmaceutical Bulletin. 1998, 46, S. 886–888.
- ↑ R. Hössel: Synthese von Derivaten des Indirubins und Untersuchungen zur Mechanismusaufklärung ihrer antineoplastischen Wirkung. Dissertation. Universität Kaiserslautern, 1999.
- ↑ R. Hössel u. a.: Indirubin, the active constituent of a Chinese antileukaemia medicine, inhibits cyclin-dependent kinases... In: Nat. Cell Biol. 1999, 1, PMID 10559866, S. 60–67.
- ↑ E. Schunk: Indigo. In: J. Liebig, H. Knopp (Hrsg.): Jahresbericht über die Fortschritte der reinen, pharmaceutischen und technischen Chemie, Physik, Mineralogie und Geologie. 1855, S. 659–665.
- ↑ P. H. Pandraud: Structure Cristalline de l'Indirubine. In: Acta Cryst. 14 (1961), S. 901–908.
Auf dieser Seite verwendete Medien
- Synthesis of Indigopurpurin from Indoxyl and Isatin (en)
- Synthese von Indigopurpurin ethanolischen Indoxyllösung, Isatin und Natriumcarbonat (de)
Indirubin_Strukturformel
Isatan B (Indigovorläufer im Färberwaid (Isatis tinctoria); Indoxyl-5-ketogluconat
Reaktion von Indoxylderivaten zu neuen Derivaten