Indigo
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Indigo | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C16H10N2O2 | |||||||||||||||||||||
| Kurzbeschreibung | dunkelblauer, geruchloser kristalliner Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 262,27 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Indigo (von altgriechisch ἰνδικόνindikón, deutsch ‚das Indische‘; nach dem Herkunftsgebiet Ostindien) ist eine tiefblaue, kristalline organisch-chemische Verbindung. Er ist ein organisches Pigment mit hoher Farbstärke und schwer löslich in Wasser. Indigo ist der Namensgeber für die Gruppe der Indigoiden Farbstoffe, deren chemische Struktur eng mit der des Indigo verwandt ist.
Der gleichnamige Farbton Indigo ist ebenfalls nach ihm benannt. Am ehesten lässt er sich als der letzte erkennbare Blauton, bevor es in ein bläuliches Violett übergeht, umschreiben. Indigo ist im Colour Index als Pigment unter der Bezeichnung C.I. Pigment Blue 66 und als Küpenfarbstoff unter C.I. Vat Blue 1 geführt.
Indigo ist eines der ältesten und bekanntesten Pigmente und wurde schon in prähistorischer Zeit zum Einfärben von Textilien verwendet. Früher wurde der Indigo aus Pflanzen wie den Blättern des Färberwaids oder aus der Indigopflanze gewonnen. Ab 1865 entwickelte Adolf von Baeyer verschiedene Synthesewege für Indigo und bestimmte seine chemische Struktur. Für seine Arbeiten zur Farbstoffchemie erhielt er 1905 den Nobelpreis für Chemie. Indigo spielte eine wichtige Rolle für die Weiterentwicklung der Organischen Chemie, besonders die Beziehung zwischen der Farbe und der Struktur des Moleküls und seiner Derivate wurde intensiv untersucht und trug so zur Entstehung einer allgemeinen Farbstofftheorie bei.
Mit der Entwicklung von industriellen Syntheseverfahren gegen Ende des 19. Jahrhunderts begann die großtechnische und kostengünstige Produktion von Indigo, worauf der Markt für natürlichen Indigo zusammenbrach. Heutzutage werden mehrere zehntausend Tonnen Indigo pro Jahr synthetisch produziert, der überwiegend zum Färben von Denim-Baumwollstoffen für die Herstellung von Blue Jeans verwendet wird.
Vorkommen
Indigo kann aus der indischen Indigopflanze (Indigofera tinctoria) oder dem europäischen Färberwaid (Isatis tinctoria) gewonnen werden.[5] Eine Reihe weiterer Pflanzen eignet sich zur Gewinnung von Indigo, darunter der Gewöhnliche Teufelsabbiss (Succisa pratensis), die Indigolupine (Baptisia australis), der Färberoleander (Wrightia tinctoria) oder der Färberschwalbenwurz (Marsdenia tinctoria). In China wurde der Chinesische Waid (Isatis indigotica) verwendet.[6] In Amerika wurde der Bastardindigo (Amorpha fruticosa) und in Japan der Färber-Knöterich (Polygonum tinctorium, syn. Persicaria tinctoria) für das Blaufärben benutzt.
Im Vergleich zu Färberwaid liefert Indigo die dreißigfache Farbstoffmenge, so dass dessen Anbau in Europa im 17. Jahrhundert unrentabel wurde.[7] Indigo wird heute noch in Brasilien und El Salvador kultiviert. Man nutzt die farbstoffreichen Arten Indigofera arrecta und Indigofera sumatrana.
Die UNESCO fördert verschiedene Projekte zur Anpflanzung von Indigo-haltigen Pflanzen, unter anderem im Jordantal und am Aralsee.[8][9]
- Färberwaid
- Indigopflanze
- Färberhülse
- Indigolupine
- Japanischer Indigo
- Gewöhnlicher Teufelsabbiss
Geschichte

Seit dem Altertum gehört Indigo zu den gebräuchlichsten und am häufigsten verwendeten Farbmitteln. Vor dem Beginn der synthetischen Produktion wurde er aus verschiedenen indigohaltigen Pflanzen gewonnen. Letztere werden häufig mit dem artspezifischen Epitheton tinctoria bezeichnet, einem lateinischen Wort für das Färben.[10]
In Europa diente bis zum 17. Jahrhundert der Färberwaid, Isatis tinctoria, aus der Familie der Kreuzblütengewächse zum Blaufärben.
Er stammt ursprünglich aus Vorderasien, wurde aber bereits in vorchristlicher Zeit in Europa als Färbepflanze kultiviert.
Das Färben mit Indigo bildet die Grundlage für Jahrhunderte alte Textiltraditionen in ganz Westafrika. Der von den Tuareg-Nomaden der Sahara getragene, mit Indigo gefärbte Tagelmust symbolisiert Reichtum und Gesundheit. Wegen der dortigen wasserarmen Färbeverfahren ist der Indigo nicht sehr abriebfest und dringt in die Haut des Trägers ein, weshalb die Tuareg als die „blauen Männer der Wüste“ bezeichnet werden. Die Yoruba, Mandinka und Hausa färben ihre Kleidung ebenfalls mit Indigo.[11]
Altertum bis Spätmittelalter
Die Nutzung von Indigo lässt sich in 6000 Jahre alten Baumwollstoffen aus dem präkeramischen Werk von Huaca Prieta de Chicama an der Nordküste Perus in Spuren nachweisen[12] In Ägypten wurden Mumien aus der fünften Dynastie des Alten Reichs gefunden, etwa 4400 Jahre vor der Gegenwart, die in Indigo-gefärbte Mumienbänder eingewickelt waren.[13] Japan und südostasiatische Länder nutzen seit Jahrhunderten Indigo als Farbstoff. Das Farbmittel war weiterhin in Mesopotamien, im Iran und in Afrika bekannt.
Pflanzen zur Gewinnung von Indigo wurden vor allem in Indien angebaut. Der Indigo wurde über Barbarikon am Indus nach Ägypten verschifft. Von dort gelangte er nach Griechenland und Italien, wo er als Luxusprodukt angesehen wurde.[11]
Caesar berichtete um 50 v. Chr. in De bello Gallico, dass sich die Kelten vor kriegerischen Auseinandersetzungen mit Färberwaid einrieben, um ihre Haut blau zu färben.[14][15] Der römische Gelehrte Plinius der Ältere beschrieb Indigo um 77 n. Chr. in seinem Werk Naturalis historia. Laut Plinius genoss Indigo in der antiken Welt das höchste Ansehen nach Purpur. Er gab als Herkunftsland Indien an, was sich im lateinischen Wort Indicum ausdrückt, von dem sich die heutige Bezeichnung Indigo ableitet. Ein anderer Begriff für den Farbstoff ist Anil, der sich vom arabischen Begriff für Blau, an-Nil, ableitet und sich als Bestandteil von Namen wie Anilin wiederfindet. Karl der Große regelte im 8. Jahrhundert den Anbau von Färberwaid zur Indigogewinnung in seiner Landgüterverordnung Capitulare de villis vel curtis imperii.[16][17]
In Europa war der Farbstoff aus der Indigo-Pflanze bis zum 12. Jahrhundert selten, er wurde nur in kleinen Mengen über Syrien und Alexandria aus Indien importiert.[18] Bis zum 17. Jahrhundert wurde Färberwaid zur Indigogewinnung in England, Frankreich und Deutschland angebaut. In Deutschland lag das größte Anbaugebiet in Thüringen, wobei ungefähr 3750 Hektar mit der Pflanze bestellt waren.[6]
Frühe Neuzeit

Mit der europäischen Entdeckung des Seewegs nach Indien durch Vasco da Gama begann der direkte Import von indischem Indigo (genannt auch „der gerechte Indig, welcher in indianischer Röhre wächst“[19]) nach Europa durch portugiesische Seefahrer. Die niederländischen Kaufmannskompanien gründeten 1602 die Niederländische Ostindien-Kompanie und steigerten in der Folgezeit die Indigoeinfuhr aus Indien und Indonesien weiter.[6] Spanien begann zu dieser Zeit mit dem Anbau in Guatemala und Venezuela, Frankreich ließ den Indigo in San Domingo anbauen und England begann um 1700 mit dem Anbau in Carolina. Da der Indigogehalt des Färberwaids nur etwa 3–4 % der Indigofera-Pflanze betrug, verdrängte der Indigo aus dem tropischen Indigofera tinctoria, trotz protektionistischer Einfuhrbestimmungen diesen schließlich.[20]
Nach der Niederlage im amerikanischen Unabhängigkeitskrieg 1783 und dem damit verbundenen Verlust der nordamerikanischen Anbauflächen verstärkte England den Indigoanbau in Bengalen. Besonders ehemalige Mitarbeiter der East India Company, sogenannte Pflanzer, begannen mit der Kommerzialisierung des Indigoanbaus in Bihar und Bengalen. Durch betrügerische Verträge und überhöhte Zinssätze für die Beschaffung des Saatguts erzielten die Pflanzer große Gewinne, während die Bauern nur geringen Profit erwirtschafteten. Diese Umstände führten 1859–1862 zu den Indigo-Unruhen, der ersten Bauernbewegung in Bengalen und Bihar gegen die ausbeuterischen Methoden der europäischen Pflanzer. Die Unruhen endeten mit der Abschaffung der Anbaupflicht für Indigo, dennoch stellte der Indigofera-Anbau in Indien weiterhin einen enormen Industriezweig dar, der sich überwiegend in britischem Besitz befand. Waffenröcke, Matrosenuniformen und die blaue Arbeitskleidung der Arbeiter wurden mit diesem Farbstoff gefärbt. Allein in Bihar waren rund 1,5 Millionen Menschen mit dem Indigo-Anbau beschäftigt.[21] Im Jahr 1897 betrug die Anbaufläche in Indien etwa 7000 Quadratkilometer und zu dieser Zeit wurden pro Jahr rund 8000 Tonnen reinen Indigos im Wert von 100 Millionen Mark produziert.[20]
Chemische Synthese gegen Ende des 19. Jahrhunderts
Mit der ersten erfolgreichen Synthese des Farbstoffs Mauvein 1856 durch William Henry Perkin begann ein Wettbewerb in Wissenschaft und Industrie um die Entwicklung neuer Teerfarben. Die Synthese von Indigo, dem „König der Farbstoffe“, gelang 1878 dem deutschen Chemiker Adolf von Baeyer, der 1883 dessen chemische Struktur aufklärte. Die Chemiefirmen BASF und Farbwerke vorm. Meister, Lucius & Brüning, die späteren Farbwerke Hoechst, verständigten sich 1880 gemeinsam darauf, die Syntheserouten von Baeyer zu einem technischen Verfahren zu entwickeln. Die Synthesewege von Baeyer eigneten sich jedoch nicht für die industrielle Produktion, da die benötigten Rohmaterialien zur damaligen Zeit nicht kostengünstig herzustellen waren.[20]
Eine bedeutende Erfindung für die Küpenfärberei mit Indigo gelang Paul Schützenberger 1873 mit der Einführung von Natriumdithionit als Reduktionsmittel.[22] Mit dem von der BASF ab 1906 großtechnisch hergestellten Reduktionsmittel war es möglich, Leuko-Indigo in einfacher Form herzustellen.
1881 nahm die BASF die Produktion von „Kleinen Indigo“ auf, bei der ein Vorprodukt des synthetischen Indigos direkt auf der Textilfaser zu Indigo reduziert wurde.[20] Wegen geringer Marktakzeptanz stellte die BASF das Verfahren jedoch kurze Zeit später wieder ein. Eine im Jahr 1890 von Karl Heumann entwickelte Synthese, ausgehend von N, die sogenannte 1. Heumann-Synthese, schien erfolgversprechender. Doch da die Ausbeuten bei diesem Verfahren sehr niedrig waren, stellte die BASF im Jahr 1893 diese Verfahrensentwicklung wieder ein.[20]
Die schlechten Ausbeuten der ersten Heumann-Synthese konnte durch Verwendung von Anthranilsäure als Ausgangsmaterial verbessert werden. Durch die zufällige Entdeckung der katalytischen Oxidation des Naphthalins mit Oleum unter Zusatz von Quecksilbersulfat zu Phthalsäure durch Eugen Sapper stand der BASF das notwendige Rohmaterial für die Synthese der Anthranilsäure zur Verfügung. Das anfallende Schwefeldioxid konnte im von Rudolf Knietsch bei der BASF zur industriellen Reife entwickelten Kontaktverfahren wieder aufgearbeitet werden. Nach dieser Synthesevariante brachte die BASF den ersten synthetischen Indigo im Juli 1897 unter Einsatz hoher Investitionen auf den Markt.[20]
1901 fand Johannes Pfleger bei der Degussa eine Variante der Heumann-Synthese, die der Degussa und den Farbwerken Hoechst ebenfalls die Kommerzialisierung des Indigos erlaubte. Infolge der Konkurrenz zwischen den Chemieunternehmen fiel der Preis für Indigo pro Kilogramm von etwa 20 auf 4 Reichsmark. 1904 schlossen BASF und die Farbwerke Hoechst die „Indigo-Konvention“, ein Kartell zur Ausschaltung des Wettbewerbs, die einen Marktpreis von 8 Reichsmark pro Kilogramm festlegte.[23] Mit dem Beginn der industriellen Herstellung verlor der natürliche Indigo innerhalb weniger Jahre große Marktanteile. 1914 hatte der natürliche Indigo nur noch einen Anteil von 4 % am Weltmarkt.[6]
Der Erste Weltkrieg und die damit verbundene Seeblockade, die Deutschland keinen Export erlaubte, führte zu einem kurzer Anstieg der pflanzlichen Indigo-Produktion. Nach dem Weltkrieg verdrängte die synthetische Herstellung von Indigo die Gewinnung aus Pflanzenmaterial völlig. Der synthetische Indigo bot eine höhere und konstante Reinheit und war daher leichter anwendbar. Außerdem waren die Färber nicht mehr auf den Ausgang der Färberpflanzenernte angewiesen.
Nach dem Ersten Weltkrieg

Durch neu entwickelte synthetische blaue Farbstoffe wie Indanthren verlor Indigo zunehmend Marktanteile. Erst die Verbreitung der Jeansmode seit Mitte der 1960er-Jahre sorgte für eine erneute Nachfrage nach Indigo. Im Jahr 2011 verbrauchte die Färbung von Jeansstoffen mehr als 95 % der jährlich produzierten etwa 50.000 Tonnen synthetischen Indigos.[24] Er gehört damit zu den meistangewendeten Pigmenten für die Textilfärbung, mit dem pro Jahr über eine Milliarde Blue Jeans gefärbt werden.[25]
Die Forschung auf dem Gebiet der Indigoherstellung und -anwendung konzentriert sich heutzutage auf die Entwicklung wasserarmer Färbeverfahren oder die elektrochemische Reduktion zum Leuko-Indigo sowie die Verwendung von Wasser als Lösungsmittel für die Synthese und die Umkristallisation von Indigo.[26][27][28]
Herstellung
Gewinnung aus Färberpflanzen
Die Färberpflanzen enthalten kein Indigo, sondern eine Vorstufe, das Indikan, ein Glycosid des Indoxyls.
Diese wird zunächst durch Gärung unter Abspaltung des Zuckerrestes in Indoxyl, ein Derivat des Indols, umgewandelt.
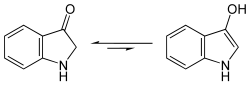
- Strukturformel von Indoxyl, Gleichgewicht zwischen Keto- und Enolform
Durch anschließende Oxidation an der Luft entsteht aus dem gelben Indoxyl der blaue Indigo.

Die traditionelle Gewinnung in Indien erfolgte in sogenannten Indigoterien. Die Gewinnung erfolgt in zwei höhenversetzten Becken. Die frisch geerntete Indigopflanze wurde in einem ersten, höher gelegenen Becken geschichtet und mit Wasser übergossen. Die Pflanzenteile wurden mit Steinen und Balken beschwert, um sie vollständig unter Wasser zu halten. In diesem Becken setzte bei entsprechend hohen Umgebungstemperaturen die Vergärung des Indikans zu Indoxyl ein.[6] Nach Beendigung der Gärung wurde das indoxylhaltige Wasser in ein tiefer gelegenes Becken abgelassen und dort mechanisch belüftet. Die Arbeiter stiegen dazu in das Becken und schlugen mit Latten oder Ähnlichem auf die wässrige Lösung ein, um Luft einzubringen. Das durch Oxidation entstehende Indigo wurde abfiltriert und eingekocht. Anschließend erfolgten die Portionierung und die abschließende Trocknung an Luft.[6] Die Reinheit des so gewonnenen Indigos lag zwischen 15 und 70 %. Diese wurde durch fraktionierte Fällung aus Schwefelsäure erhöht.[2] Neben organischen Verunreinigungen enthält das natürliche Indigo anorganische Bestandteile wie Kieselsäure, Phosphorsäure, Tonerde und viele weitere in Spuren.
Die Biosynthese der Indigovorläufer in höheren Pflanzen wurde mit Hilfe der Isotopenmarkierung erforscht und erfolgt wahrscheinlich über den Shikimisäureweg:
Dabei wird Shikimat (1) in mehreren Stufen zu Chorismat (2) umgewandelt. Durch die Anthranilatsynthase wird diese zum Anthranilat (3) umgebildet. Das Enzym Anthranilat-Phosphoribosyltransferase (EC 2.4.2.18) katalysiert die Reaktion zum N-(5-Phospho-D-ribosyl)-anthranilat,[29][30] das wiederum durch die Phosphoribosylanthranilat-Isomerase (EC 5.3.1.24) zum 1-(o-Carboxyphenylamino)-1-desoxribulose-5-phosphat (4) reagiert. Durch Ringschluss unter Decarboxylierung erhält man das Indol-Derivat 5, das schließlich in die Aminosäure Tryptophan (6) überführt wird.[31] Die Bildung von Indoxyl (7) aus Tryptophan, bei der die Enzyme Trypthophanase und Dioxygenase eine Rolle spielen, konnte bislang nicht in allen Einzelheiten geklärt werden.[30]
Synthesen nach Adolf von Baeyer
Adolf von Baeyers erste vollsynthetische Herstellung von Indigo erfolgte durch Reduktion von Isatin, welches er zuvor als Abbauprodukt des Indigo identifiziert hatte.[32] Ausgehend von Phenylessigsäure gelangte er in mehreren Schritten zum Oxindol, das er weiter zum Isatin oxidierte. Über die Chlorierung des Isatins mit Phosphorpentachlorid zum Isatinchlorid und anschließender Reduktion mit Zink in Essigsäure gelangte er zum Indigo.
Eine von Baeyer und Drewsen entwickelte Syntheseroute (Baeyer-Drewsen-Reaktion) führte über die Aldoladdition von ortho-Nitrobenzaldehyd und Aceton über die Zwischenstufe des o-Nitrophenylmilchsäureketons zum Indigo.[33] Diese Syntheseroute ist einfach und nützlich für die Darstellung von Indigo und vieler seiner Derivate im Labormaßstab.
Beide Syntheserouten ließen sich nicht kostengünstig in einen industriellen Prozess überführen.
Baeyer entwickelte eine weitere Syntheseroute, die von Zimtsäure ausging. Die Nitrierung der veresterten Zimtsäure ergibt nach der Esterhydrolyse die o-Nitrozimtsäure. Durch Bromierung und zweifache Dehydrobromierung erhält man die o-Nitrophenylpropiolsäure, die sich durch Kochen mit Alkali in das Isatin und anschließender Reduktion in Indigo überführen lässt.[34]
Heinrich Caro, Forschungsleiter der BASF und enger Freund Baeyers entdeckte, dass die isolierbare Zwischenstufe o-Nitrophenylpropiolsäure sich unter milden alkalischen Bedingungen mit Natriumxanthogenat direkt auf der Faser zu Indigo umsetzen ließ. Dieses sogenannte „Kleine Indigo“ stellte die BASF einige Jahre her, jedoch ohne großen Markterfolg.[20]
Synthesen nach Karl Heumann
Im Jahr 1890 entwickelte der Zürcher Chemiker Karl Heumann eine neue Syntheseroute, ausgehend von N-Phenylglycin (1. Heumann-Synthese). Der Chemiekonzern BASF und die Farbwerke Hoechst patentierten und entwickelten das Verfahren weiter. Die Versuchsreihe mit Phenylglycin wurde von der BASF im Jahr 1893 wieder eingestellt, da die Indigoausbeute sehr niedrig war.[20]
Später entwickelte Heumann einen weiteren Syntheseweg, auf dessen Basis BASF 1897 den ersten synthetischen Indigo auf den Markt bringen konnte.[35] Durch die Umsetzung von Anthranilsäure mit Chloressigsäure gelangte Heumann zur Phenylglycin-o-carbonsäure. Wird diese Substanz in einer inerten Atmosphäre mit Kaliumhydroxid auf 200 °C erhitzt, bildet sich 2-Indoxylcarbonsäure. Dieses Material decarboxyliert leicht zu Indoxyl, das an Luft zu Indigo oxidiert (2. Heumann-Synthese).[20]

- 2. Heumann-Synthese (Anthranilsäure (1), Chloressigsäure (2), Phenylglycin-o-carbonsäure (3), 2-Indoxylcarbonsäure (4), Indoxyl (5), Indigo (6))
Industrielle Produktion

Ein zerbrochenes Thermometer führte zufällig zu der Erkenntnis, dass Quecksilbersulfat sich als Katalysator für die Oxidation des bei der Teerfarbstoffindustrie in großen Mengen anfallenden Naphthalins zu Phthalsäure eignete. Durch Reaktion mit Ammoniak ließ sich die Phthalsäure in das Säureamid überführen. Mittels anschließender Hofmann-Umlagerung gelangte die BASF zu Anthranilsäure, die im großtechnischen Maßstab als Ausgangsstoff für die Heumann-Synthese benötigt wurde.

- Herstellung von Anthranilsäure mittels Hofmann-Umlagerung des Phthalimids
Mittels der 2. Heumann-Synthese konnte die Anthranilsäure zu Indigo in Ausbeuten von 70 bis 90 % verarbeitet werden. Ab 1897 stellte die BASF synthetischen Indigo großtechnisch nach diesem Verfahren her.[32]
1901 gelang der Degussa mit einem Verfahren von Johannes Pfleger, mittels Natriumamid, welches im Castner-Kellner-Verfahren zur Herstellung von Natriumcyanid hergestellt wurde, und einer Alkalischmelze N-Phenylglycin bei einer Temperatur von etwa 200 °C Indigo in hohen Ausbeuten zu erhalten (Heumann-Pfleger-Synthese). Das Natriumamid dient dabei als wasserentziehendes Mittel.[20] Dieses Verfahren wurde gemeinsam mit den Farbwerken Hoechst vermarktet:
Nach diesem Verfahren produziert die BASF seit 1926 Indigo.
Die BASF entwickelte 1905 eine Verfahrensvariante der Heumann-Pfleger-Synthese, bei der das teure Natriumamid durch billigeres Calciumoxid ersetzt wurde. Das Verfahren wurde auf eine früher entwickelte Syntheseroute übertragen. Dabei wird Anilin mit Ethylenchlorhydrin zu 2-Anilinoethanol umgesetzt, das sich in einer Natriumhydroxid-Kaliumhydroxid-Calciumoxidschmelze bei Temperaturen von etwa 280 °C bei befriedigenden Ausbeuten zu Indoxyl umsetzt.[36] Nach diesem Verfahren produzierte die BASF von 1909 bis 1924.
Seit 1924 basierte die Indigosynthese der BASF auf Phenylglycinnitril, das aus Anilin hergestellt wurde.[20] In allen Fällen entsteht Indoxyl, das durch Luftsauerstoff zu Indigo oxidiert. Die naheliegende Vermutung, dass die Bildung von Indigo durch basenkatalysierte Kondensation zwischen Isatin und Indoxyl abläuft, konnte durch mechanistische Untersuchungen ausgeschlossen werden. Die Oxidation von Indoxyl in basischer Lösung erfolgt wahrscheinlich über ein radikalisches Zwischenprodukt. Ob die Bildung über die Kupplung von zwei Indoxylradikalen oder der Kupplung eines Indoxylradikals und eines Indoxylanions verläuft, konnte experimentell nicht eindeutig geklärt werden.[37]
Mikrobiologische Synthese
Schon in den 1920er-Jahren wurde beobachtet, dass Bodenbakterien Indigo aus Indol synthetisieren können.[38] Mittlerweile sind eine Reihe mikrobieller Indigoproduzenten wie Pseudomonas putida bekannt, die aus aromatischen Kohlenwasserstoffen wie Naphthalin, Cumol oder Styrol Indigo bilden können. Das für die Indigobildung verantwortliche Enzymsystem besteht aus einem oder mehreren Enzymen, typischerweise Monooxygenasen, Dioxygenasen oder Hydroxylasen.[39]
Die größten Probleme der mikrobiologischen Route sind die hohe Verdünnung des Indigos und der Aufwand für die Abtrennung der beträchtlichen Menge organischen Materials. Bislang konnte eine mikrobiologische Syntheseroute daher nicht kommerzialisiert werden.[2]
Handelsformen
Große europäische Produzenten von Indigo sind DyStar, ursprünglich ein Gemeinschaftsunternehmen von Bayer, Hoechst und BASF und seit 2010 in chinesisch-indischem Besitz, sowie Archroma, ein Spin-Off des Schweizer Konzerns Clariant. Im asiatischen Raum gibt es eine Vielzahl von Herstellern, unter anderem TaiFeng Chemical Industrial, Zhejiang Runtu oder Bodal Chemicals. Indigo ist in nichtreduzierter oder in vorreduzierter Form erhältlich. Die nichtreduzierten Qualitäten sind als Granulat, Pulver oder alkalische Paste erhältlich. Typische Handelsformen der Paste enthalten 20 bis 30 % Indigo. Die vorreduzierten Lösungen sind in Konzentration von 20 bis 60 % erhältlich.[40]
Eigenschaften
Physikalische Eigenschaften
Indigo besitzt einen recht hohen Schmelzpunkt von etwa 390–392 °C und sublimiert bei einer Temperatur von 170 °C.[2] Er ist schlecht löslich in Wasser, Ethanol und Diethylether. Dies begründet sich darin, dass Indigo im festen Zustand ein Wasserstoffbrücken-Polymer bildet.[41] Zudem ist es schlecht löslich in pflanzlichen Ölen wie Leinöl.[42]
Röntgenstrukturanalysen haben gezeigt, dass dabei jedes Indigomolekül an vier umgebende Moleküle gebunden ist.[43] Indigo kristallisiert monoklin in der Raumgruppe P21/c (Nr. 14) mit den Gitterparametern a = 924 pm; b = 577 pm; c = 1222 pm und β = 117,0°, Z = 2.[44]
Das Infrarotspektrum lässt sich mittels ATR-Infrarotspektroskopie ermitteln. Charakteristisch ist die Streckschwingung der Carbonylgruppe bei einer Wellenzahl von 1623 cm−1. Eine intensive Bande bei 1065 cm−1 wird der Vibration des fünfgliedrigen Rings zugeschrieben.[45]
Molekulare Eigenschaften

Indigo besitzt eine planare Struktur mit einer C2h-Symmetrie.[47] Die photochemische Stabilität von Indigo ist auf intramolekulare Wasserstoffbrückenbindungen zwischen den benachbarten Carbonyl- und sekundären Aminogruppen zurückzuführen. Diese stabilisieren das Molekül in einer planaren trans-Konfiguration und inhibieren so eine photochemische cis-trans-Isomerisierung.[48]
Die Farbigkeit eines Moleküls ergibt sich aus dessen Fähigkeit zur Absorption elektromagnetischer Strahlung. Wenn diese im Bereich des sichtbaren Lichts erfolgt, erscheint der Stoff farbig. Als Farbe wird immer die Komplementärfarbe zur Farbe des absorbierten Lichts wahrgenommen. Die Bedingung für Farbigkeit ist daher das Vorkommen von Elektronen, die durch sichtbares Licht angeregt werden. Nach der Farbstofftheorie nach Witt besteht ein Farbstoff aus einem Chromophor (altgriechisch χρῶμαchrṓma, deutsch ‚Farbe‘, altgriechisch φορόςphorós, deutsch ‚tragend‘), zum Beispiel einem delokalisierten π-Elektronensystem, das die Farbigkeit möglich macht sowie einem Auxochrom (von altgriechisch αὐξεῖνauxein, deutsch ‚wachsen‘ und altgriechisch χρῶμαchrṓma, deutsch ‚Farbe‘), etwa ein Elektronendonator mit einem +M-Effekt, der das Absorptionsmaximum des Chromophors in den längerwelligen Bereich des Spektrums verschiebt. Indigo weist zwei konjugierte Carbonylgruppen als Chromophor auf. Aufgrund dieses Strukturelements gehört Indigo zur Gruppe der Carbonylfarbstoffe.[49]
Die Absorption elektromagnetischer Strahlung bedingt einen Elektronenübergang vom höchsten besetzten Molekülorbital (HOMO) ins niedrigste unbesetzte Molekülorbital (LUMO). Falls keine auxochrome Gruppe vorhanden ist, ist die Energiedifferenz zwischen HOMO und LUMO relativ groß und die Absorption durch den π → π*-Übergang erfolgt im nicht sichtbaren Bereich.[46] Das freie Elektronenpaar der sekundären Aminogruppe des Indigos dient als Elektronendonator und tritt in Wechselwirkung mit dem π-System des Chromophors. Dadurch bilden sich drei neue Molekülorbitale π1, π2 und π*3, wobei die Energiedifferenz zwischen HOMO und LUMO geringer wird. Der π2 → π*3-Übergang erfolgt dadurch beim Indigo durch Licht im orangen Bereich. Indigo erscheint daher blau.
Chemische Eigenschaften

Die Elementaranalyse des Indigo liefert eine empirische Summenformel von C8H5NO. Durch kryoskopische Messungen ergibt sich eine Molekülformel von C16H10N2O2. Indigo ist ein sehr licht- und temperaturstabiles Molekül. Bei höheren Temperaturen von etwa 460 °C lagert es sich unter Bruch der Bindungen zwischen den Carbonylgruppen und der zentralen Kohlenstoff-Kohlenstoff-Doppelbindung zum Dibenzonaphthyridindion um.[50]
Im Alkalischen zerfällt das Molekül bei höheren Temperaturen in Verbindungen wie Anilin und Anthranilsäure. In konzentrierter Schwefelsäure erfolgt die Sulfonierung zum Indigokarmin. Oxidation mit Kaliumpermanganat liefert Isatin.[2]
Indigo lässt sich im schwach sauren und alkalischen Bereich leicht reduzieren. Die Leuko-Form liegt unterhalb eines pH-Werts von 5,5 in der Keto-Form vor. Im Bereich zwischen 5,5 und 11 liegt das Mono-Enolat und ab einem pH-Wert von 11 das Di-Enolat vor.[51]
Mit Chlorsulfonsäure bildet die Leuko-Form Natriumsalze der Schwefelsäureester, sogenannte Indigosole. Die Indigosole sind wasserlöslich und eignen sich zur Färbung von Wolle, wobei diese anschließend mit salpetriger Säure oxidiert werden, wobei gleichzeitig eine Verseifung stattfindet.[52] Als Mono-Chelatligand bildet Indigo mit Palladium- und Platinsalzen lösliche Metall-Komplexe, die weder intra- noch intermolekulare Wasserstoffbrücken aufweisen.[53]
Verwendung
Küpenfärbung

Indigo wird unter anderem wegen seiner ausgezeichneten Lichtstabilität zum Färben verwendet. Die Verbindung wird stark von Baumwollfasern absorbiert und ist sehr waschecht.[54] Indigo selbst ist fast wasserunlöslich und muss vor dem Färben durch Reduktion, etwa unter Verwendung von Natriumdithionit, in das wasserlösliche Leuko-Indigo (von griechisch leukós: weiß, glänzend) überführt werden, die sogenannte Verküpung.
Vor der Verwendung von Natriumdithionit bestand die sogenannte Gärungsküpe traditionell aus einem gärfähigen Material wie Sirup oder anderen kohlenhydrathaltigen Substanzen sowie einem alkalischen Zusatz, etwa Kalk oder Urin. Die Kohlenhydrate dienten als Reduktionsmittel.[55] Später wurden weitere Reduktionsmittel wie Arsensulfide, Eisen(II)-sulfat oder Zinkstaub eingesetzt.[20]
Zum Färben wird der Baumwollstoff danach in die wässrige Küpe-Lösung mit der reduzierten, farblosen Leukoform gelegt. Die lösliche Komponente zieht auf die Faser auf und beim Trocknen an der Luft entsteht durch Oxidation wieder Indigo. Dementsprechend entsteht die Blaufärbung erst nach Sauerstoffkontakt. Der Indigo bildet keine chemische Bindung mit der Faser aus, sondern haftet daran über Adhäsionskräfte.[6]
Dieser Vorgang wird als Küpenfärberei bezeichnet, und so auch bei anderen Textilfarbstoffen angewandt. Früher wurden zur Oxidation des Farbstoffs die Stoffe auf einer Wiese in die Sonne gelegt, wo der Indigo durch eine Rasenbleiche oxidiert wurde. In der Textilindustrie ist der synthetisch hergestellte Indigo als Küpenfarbstoff weit verbreitet.[56][57] Größtenteils wird Indigo zum Färben von Denim-Stoffen benötigt.
Andere Textilfärbemethoden

In England entwickelten die Färber im 18. und 19. Jahrhundert zwei weitere Methoden der Indigofärberei. Die erste Methode ist als „Pencil Blue“ bekannt. Zur Stabilisierung wurde dazu Arsentrisulfid und ein Verdickungsmittel zum Leuko-Indigo gegeben. Die Arsenverbindung verzögerte die Oxidation des Indigos, so dass dieser mittels Stiften oder Pinseln auf Textilien aufgetragen werden konnte.[58]
Bei der zweiten Methode wurde der unlösliche Indigo direkt auf den Stoff gedruckt und danach mittels Eisen(II)-sulfat reduziert. Danach erfolgte wieder die Oxidation mit Luft. Diese sogenannte „Chinablau“-Prozess erzeugte klare Designs.[58] Gegen Ende des 19. Jahrhunderts entwickelte John Bracewell den Glucoseprozess, der das direkte Bedrucken mit Indigo erlaubte.[59]
Der Blaudruck ist eine traditionelle Textildrucktechnik sowie der Name für den dunkelblauen Stoff mit weißen Mustern, der mit dieser Drucktechnik hergestellt wird. Es handelt sich um einen Reservedruck, bei dem der Stoff mit einer Schutzmasse bedruckt wird, um weiß zu bleiben. Nach dem Bedrucken mit der Schutzmasse wird der Stoff mit Indigo gefärbt.[60]
Traditionelle Chinesische Medizin
In der traditionellen chinesischen Medizin wird Indigo Naturalis in Kombination mit arsenhaltigem Realgar bei der Behandlung der Promyelozytenleukämie verwendet.[61] Des Weiteren wird Indigo Naturalis gegen Schuppenflechte eingesetzt.[62] Der aktive Wirkstoff der Indigo-Naturalis-Zubereitungen scheint allerdings Indirubin zu sein, der als Inhibitor von Cyclin-abhängigen Kinasen wirkt.[63] Banlangen, ein traditionelles chinesisches Heilmittel, wird zum Beispiel aus den Wurzeln des Färberwaids oder der Indigopflanze hergestellt und bei Rachen- und Kehlkopfentzündungen sowie einer Vielzahl anderer Krankheiten verabreicht.
Andere Anwendungen
Die Maya stellten das Pigment Maya-Blau seit etwa 800 nach Christus her. Das Pigment wurde als Verbundstoff aus Palygorskit und Indigo identifiziert, der wahrscheinlich aus den Blättern einer einheimischen Indigofera-Art stammt.[64] Ein aktuelles Rezept zur Herstellung von Maya-Blau wurde 1993 veröffentlicht.[65]
Für den technischen Einsatzbereich lässt sich Indigo in Form dünner organischer Filme für den Bau von Solarzellen verwenden.[66] Forschungen haben gezeigt, dass Indigo in Feldeffekttransistoren eingesetzt werden kann. Ein dünner Film aus teilkristallinem Indigo ist ein Halbleiter mit einer Bandlücke von 1,7 eV und damit ein potenzielles Material für die organische Elektronik.[67][68]
Indigo wurde eher selten bis etwa zum Ende des 17. Jahrhunderts in der Ölmalerei verwendet.[69] Eines der berühmtesten Beispiele ist Vermeers Werk „Christus bei Maria und Martha“, bei dem sowohl der blaue Mantel Christi als auch der Rock von Maria mit Indigo gemalt sind.[70]
Indigo kann zur Messung der Ozonkonzentration in der Luft verwendet werden. Dazu wird Chromatographie-Papier mit Indigo getränkt. Durch den Kontakt mit dem Ozon in der Luft bildet sich Isatin. Dieses wird nach Elution photometrisch bestimmt.[71] Ein weiteres Reaktionsprodukt ist das Isatosäureanhydrid.[72] Auch indigoide Farbstoffe lassen sich zum Ozonnachweis einsetzen.
In Japan wurde Indigo Naturalis in der traditionellen Medizin als entzündungshemmende Substanz eingesetzt. Die Samurai trugen mit Indigo gefärbte Kleidung, um Wunden und Verletzungen zu heilen. Aufgrund der vermuteten positiven gesundheitlichen Wirkung sind indigogefärbte Decken und Bekleidung traditionelle Geschenke für Neugeborene, um diese vor Krankheiten schützen.[73] Römische und griechische Heilmittel enthielten zum Teil Indigo.[74]
Indigoide Farbstoffe
Indigoide Farbstoffe sind strukturell dem Indigo verwandte Stoffe. Dazu zählen etwa die Varianten, die durch Veränderung des Indigo-Grundgerüsts entstehen, zum Beispiel durch Ersatz der sekundären Aminogruppe durch andere Elektronendonatoren wie Selen, Schwefel oder Sauerstoff. Die Tabelle zeigt den Vergleich der langwelligsten Absorptionsbande dieser Verbindungen im Vergleich zu Indigo (λmax. bei 606 nm).
| Name | Grundstruktur | X | λmax (nm) (in Ethanol)[41] |
|---|---|---|---|
| Indigo |  | NH | 606 |
| Selenindigo | Se | 562 | |
| Thioindigo | S | 543 | |
| Oxindigo | O | 432 |
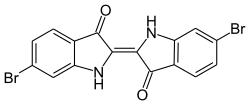
Durch die Synthese von Strukturisomeren oder der Derivatisierung des Benzolrings ergeben sich weitere Möglichkeiten der Farbvariation. So ist das Strukturisomer Indirubin ein rotvioletter und Indigokarmin (5,5′-Indigodisulfonsäure-Dinatriumsalz) ein blauer Farbstoff. Ringsubstituierte Derivate des Indigos lassen sich auf verschiedenen Wegen synthetisieren. Die Verwendung von Brom-substituiertem Nitrobenzaldehyd in der klassischen Synthese nach Baeyer führt zur Bildung von Purpur (6,6′-Dibromindigo), einem antiken Farbstoff, der aus Purpurschnecken gewonnen wurde.[75] Dessen Struktur wurde 1909 von Paul Friedlaender aufgeklärt.[76] Weitere Beispiele indigoider Farbstoffe sind 5,5′,7,7′-Tetrabromindigo (Brillantindigo B) oder 2-(5-Bromindol)-5-brom-2′-thionaphthenindigo (Cibaviolet 3B).[77] Viele verschiedene indigoide Farbstoffe wie Thioindigo oder Tetrachlorindigo sind kommerziell erhältlich. Im Vergleich zu Indigo ist die ökonomische Bedeutung der Derivate jedoch eher gering.[2]
Toxikologie und Umweltaspekte
Indigo hat eine geringe Toxizität bei Säugetieren. Der LD50-Wert bei der Maus liegt bei 32 g/kg.[78] Es gibt keine Anzeichen für eine Sensibilisierung beim Menschen nach wiederholten Hautanwendungen.[79] Fütterungsversuche an Ratten und Hunden mit bis zu 3 Gew.% Indigo im Futter zeigten keine gravierenden nachteiligen gesundheitlichen Folgen.[2]
Die in der Produktion von Indigo eingesetzten Chemikalien wie Anilin, Formaldehyd oder Cyanwasserstoff sind zum Teil toxisch und umweltgefährdend und werden daher ausschließlich in geschlossenen Systemen gehandhabt.[2] Indigo hat aufgrund seiner geringen Löslichkeit keine nachteiligen Auswirkungen auf Belebtschlammsysteme in biologischen Abwasserbehandlungsanlagen, aber die biologische Abbaurate ist gering. Zur Entfernung des Pigments eignen sich Ultrafiltrationsanlagen vor der Einleitung in die Kläranlage.[80] Nicht umgesetzte Rohstoffe wie Anilin oder Anthranilsäure sind leicht biologisch abbaubar. Zur Verringerung der Salzfracht beim eigentlichen Färbeprozess werden vorreduzierte Applikationen angeboten, welche den Einsatz von Natriumdithionit als Reduktionsmittel unnötig machen. In den letzten Jahren hat sich daher eine neue Handelsform für Indigo etabliert. Dabei wird eine Indigosuspension mit Wasserstoff katalytisch zur Leuko-Form reduziert und als vorreduzierte, konzentrierte Indigo-Flüssigmarke vermarktet.[81]
Literatur
- Elmar Steingruber: Indigo and indigo colorants. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2004, doi:10.1002/14356007.a14 149.pub2.
- Renate Kaiser-Alexnat: Indigo. Der König der Farbstoffe. In: Südostasien Magazin. Band 3, 2008, S. 110–121, (PDF; 3,3 MB), (Sonderdruck).
- Helmut Schmidt: Indigo. 100 Jahre industrielle Synthese. In: Chemie in unserer Zeit. Band 3, 1997, S. 121–128, doi:10.1002/ciuz.19970310304.
- Paul Rys, Heinrich Zollinger: Farbstoffchemie – Ein Leitfaden. 3. neubearbeitete Auflage, Wiley-VCH, Weinheim 1982, ISBN 3-527-25964-3.
- H. Schweppe: Indigo and Woad. In: E. West Fitzhugh (Hrsg.): Artists' Pigments. A Handbook of Their History and Characteristics. Band 3, Oxford University Press, 1997, S. 81–107.
Weblinks
- Anbau von Indigofera und die traditionelle Gewinnung von Indigo in Indien (9:47 min.) auf YouTube.
- Indigo bei ColourLex
Einzelnachweise
- ↑ a b c Eintrag zu Indigo in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ a b c d e f g h Elmar Steingruber: Indigo and indigo colorants. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2004, doi:10.1002/14356007.a14 149.pub2.
- ↑ Sicherheitsdatenblatt bei Carl Roth.
- ↑ a b Eintrag zu Indigo. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Mai 2014.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, S. 477, ISBN 978-3-906390-29-1.
- ↑ a b c d e f g Renate Kaiser-Alexnat: Indigo – Der König der Farbstoffe. In: Südostasien Magazin. 3/2008; S. 110–121, ISBN 978-3-7375-9664-0.
- ↑ Christian-Herbert Fischer: Historische organische Farbstoffe. In: Spektrum der Wissenschaft. Oktober 1997, S. 104.
- ↑ Women break barriers, empower themselves in indigo cultivation | Jordan Times. In: jordantimes.com. 7. Mai 2017, abgerufen am 26. August 2024 (englisch).
- ↑ Abdukadir Ergashev u. a.: Abiotechnology of Indigofera tinctoria L. on the saline land of Aral Sea Basin and producing of the natural plant indigo pigment for the industry. In: Journal of Chemistry and Chemical Engineering. 8.7, 2014, S. 707–716, online (PDF; 0,9 MB) auf sgp.uz.
- ↑ R. Hegnauer, M. Hegnauer: Chemotaxonomie der Pflanzen. Band XI: Leguminosae. Birkhäuser, Basel / Boston / Berlin 1994, ISBN 978-3-0348-9392-3, S. 1047.
- ↑ a b Colleen E. Kriger: Cloth in West African History. Altamira Press, New York 2006, ISBN 978-0-7591-0421-1, S. 120–124.
- ↑ Jeffrey C. Splitstoser, Tom D. Dillehay, Jan Wouters, Ana Claro: Early pre-Hispanic use of indigo blue in Peru. In: Science Advances. Band 2, 2016, S. e1501623; doi:10.1126/sciadv.1501623.
- ↑ W. Conard Fernelius, Edgar E. Renfrew: Indigo. In: Journal of Chemical Education. Band 60, 1983, S. 633, doi:10.1021/ed060p633.
- ↑ Gaius Iulius Caesar, De bello Gallico 5,14,2 (online).
- ↑ M. Van der Veen, A. R. Hall, J. May: Woad and the Britons Painted Blue. In: Oxford Journal of Archaeology. Band 12, Nr. 3, 1993, S. 367–371; doi: 10.1111/j.1468-0092.1993.tb00340.x.
- ↑ Margarete Bruns: Von Azurit, Indigo und Anilin. Zur Geschichte der blauen Farbe. In: Emil Ernst Ploß: Ein Buch von alten Farben. Technologie der Textifarben im Mittelalter mit einem Ausblick auf die festen Farben. 6. Auflage, Impuls Verlag, München 1989, ISBN 978-3-89164-060-9, S. 14–20.
- ↑ Reinhard Schneider: Capitulare de villis. In: Handwörterbuch zur deutschen Rechtsgeschichte. Band 1, 2. Auflage, Schmidt, Berlin, ISBN 978-3-503-07912-4, S. 809–811.
- ↑ Robin J. H. Clark, Christopher J. Cooksey, Marcus A. M. Daniels, Robert Withnall: Indigo, woad, and Tyrian Purple: important vat dyes from antiquity to the present. In: Endeavour. Neue Serie, Band 17/4, 1993, 192, S. 191–199; doi:10.1016/0160-9327(93)90062-8.
- ↑ Wilhelm Hassenstein, Hermann Virl: Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, S. 108 (Indig, indicum oder Waidtsblau und Waidblum).
- ↑ a b c d e f g h i j k l Helmut Schmidt: Indigo – 100 Jahre industrielle Synthese. In: Chemie in unserer Zeit. Band 31, 1997, S. 121–128; doi:10.1002/ciuz.19970310304.
- ↑ David Paterson: Concerning Indigo, Natural and Artificial. In: Oil and Colourman's Journal. Band 28, Nr. 357 und 358, August 1905.
- ↑ Sabine Struckmeier: Die Textilfärberei vom Spätmittelalter bis zur Frühen Neuzeit. Waxmann, Münster 2011, ISBN 978-3-8309-2527-9, S. 177–178.
- ↑ Werner Abelshauser: Die BASF: Eine Unternehmensgeschichte. 2. Auflage, Beck, München 2003, ISBN 3-406-49526-5, S. 132.
- ↑ Lauren Wolf: What's That Stuff? Blue Jeans. In: Chemical & Engineering News. 24. Oktober 2011, Band 89, Number 43, S. 44.
- ↑ A. D. Kinghorn, H. Falk, J. Kobayashi: Progress in the Chemistry of Organic Natural Products. Band 99, Springer-Verlag, Heidelberg / New York 2014, ISBN 978-3-319-04899-4, S. 88.
- ↑ Wrangler Adopts the Denim Industry’s First ‘Dry-Dyeing’ Process. In: triplepundit.com. 21. September 2018, abgerufen am 26. August 2024.
- ↑ John Mowbray: Electrochemical indigo machine debuts in Pakistan | Dyes & Chemicals News | News. In: ecotextile.com. 15. Januar 2019, abgerufen am 26. August 2024 (englisch).
- ↑ M. Josef Taublaender, Florian Glöcklhofer, Martina Marchetti-Deschmann, Miriam M. Unterlass: Inside Cover: Green and Rapid Hydrothermal Crystallization and Synthesis of Fully Conjugated Aromatic Compounds. In: Angewandte Chemie International Edition. Band 57, 2018, S. 12180; doi:10.1002/anie.201808280.
- ↑ Eintrag in der Enzyme nomenclature database für Anthranilat-Phosphoribosyltransferase.
- ↑ a b A. D. Kinghorn, H. Falk, J. Kobayashi: Progress in the Chemistry of Organic Natural Products. Band 99. Springer-Verlag, Heidelberg / New York 2016, ISBN 978-3-319-34645-8, S. 82.
- ↑ Eintrag in der Enzyme nomenclature database für Phosphoribosylanthranilat-Isomerase.
- ↑ a b Arne Andersen: Historische Technikfolgenabschätzung am Beispiel des Metallhüttenwesens und der Chemieindustrie 1850–1933 (== Zeitschrift Fur Unternehmensgeschichte – Beihefte. Band 90). Steiner, Stuttgart 1996, S. 238.
- ↑ Adolf Baeyer, Viggo Drewsen: Darstellung von Indigblau aus Orthonitrobenzaldehyd. In: Berichte der deutschen chemischen Gesellschaft. Band 15, 1882, S. 2856–2864; doi:10.1002/cber.188201502274.
- ↑ Fritz Mayer: Chemie der organischen Farbstoffe. Springer-Verlag, Berlin, Heidelberg 1921, ISBN 978-3-662-05490-1, S. 199 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Werner Abelshauser: Die BASF. Eine Unternehmensgeschichte, München 2002, S. 74 f.
- ↑ BASF-Patent DE 171172, angemeldet am 23. Januar 1904.
- ↑ Glen Allan Russell, Gerd Kaupp: Reactions of resonance stabilized carbanions. XXXI. Oxidation of carbanions. 4. Oxidation of indoxyl to indigo in basic solution. In: Journal of the American Chemical Society. Band 91, 1969, S. 3851–3859; doi:10.1021/ja01042a028.
- ↑ P. H. H. Gray: The Formation of Indigotin from Indol by Soil Bacteria. In: Proceedings of the Royal Society B: Biological Sciences. Band 102, 1928, S. 263–281; doi:10.1098/rspb.1928.0003.
- ↑ B. Bhushan, S.K. Samanta, R.K. Jain: Indigo production by naphthalene-degrading bacteria. In: Letters in Applied Microbiology. Band 31, 2000, S. 5; doi:10.1046/j.1472-765x.2000.00754.x.
- ↑ Klaus Hunger: Industrial Dyes: Chemistry, Properties, Applications. Wiley-VCH, Weinheim 2003, ISBN 3-527-30426-6, S. 231.
- ↑ a b Paul Rys, Heinrich Zollinger: Farbstoffchemie. Ein Leitfaden. 3. neubearbeitete Auflage, Wiley-VCH, Weinheim 1982, ISBN 3-527-25964-3, S. 136 f.
- ↑ S. Sattar: Lake Pigments and Thin-Layer Chromatography of Natural Dyes: Paired Experiments for Nonmajors. In: Journal of Chemical Education. 101.11, 2024, S. 4983–4988, doi:10.1021/acs.jchemed.4c00752.
- ↑ H. v. Eller In: Bulletin de la Société Chimique de France . Band 106, 1955, S. 1426.
- ↑ Peter Süsse, Manfred Steins, Vladimir Kupcik: Indigo: Crystal structure refinement based on synchrotron data. In: Zeitschrift für Kristallographie – Crystalline Materials. Band 184, 1988, S. 269–273; doi:10.1524/zkri.1988.184.14.269.
- ↑ Anna Baran, Andrea Fiedler, Hartwig Schulz, Malgorzata Baranska: In situ Raman and IR spectroscopic analysis of indigo dye. In: Analytical Methods. Band 2, 2010, S. 1372; doi:10.1039/c0ay00311e.
- ↑ a b Stefan Bienz, Laurent Bigler, Thomas Fox, Herbert Meier: Spektroskopische Methoden in der organischen Chemie. 9. Auflage, Thieme, Stuttgart / New York 2016, ISBN 978-3-13-576109-1.
- ↑ Vu Thi Ngan, G. Gopakumar, Tran Thanh Hue, Minh Tho Nguyen: The triplet state of indigo: Electronic structure calculations. In: Chemical Physics Letters. Band 449, 2007, S. 11–17; doi:10.1016/j.cplett.2007.10.015.
- ↑ J. Seixas de Melo, A. P. Moura, M. J. Melo: Photophysical and spectroscopic studies of indigo derivatives in their keto and leuco forms. In: The Journal of Physical Chemistry A. Band 108, Nr. 34, 2004, S. 6975–6981; doi:10.1021/jp040753y.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Ausgabe 5, Thieme, Stuttgart / New York 2005, ISBN 978-3-13-541505-5, S. 728–734.
- ↑ Günter Haucke, Gerhard Graness: Thermal Isomerization of Indigo. In: Angewandte Chemie International Edition in English. Band 34, 1995, S. 67; doi:10.1002/anie.199500671.
- ↑ G. A. Baig: Dyeing nylon with indigo in various pH regions. In: AUTEX Research Journal. Band 10, 2010, S. 21–25.
- ↑ F. Weiss: Die Indigosole und ihre Verwendung. In: Die Küpenfarbstoffe und ihre Verwendung in der Färberei und im Zeugdruck. Springer-Verlag, Wien 1953, ISBN 978-3-7091-7827-0, S. 313–364.
- ↑ Wolfgang Beck, Christoph Schmidt, Rolf Wienold, Manfred Steimann, Barbara Wagner: Indigo-Metal Complexes: Synthesis and Structure of PdII and PtII Compounds Containing the Anions of Indigo and Octahydroindigo as Mono- and Bis-Chelate Ligands. In: Angewandte Chemie International Edition in English. Band 28, 1989, S. 1529–1531; doi:10.1002/anie.198915291.
- ↑ Izumi Iwakura, Atushi Yabushita, Takayoshi Kobayashi: Why is Indigo Photostable over Extremely Long Periods?. In: Chemistry Letters. Band 38, 2009, S. 1020; doi:10.1246/cl.2009.1020.
- ↑ Laksanawadee Saikhao, Jantip Setthayanond, Thitinun Karpkird, Thomas Bechtold, Potjanart Suwanruji: Green reducing agents for indigo dyeing on cotton fabrics. In: Journal of Cleaner Production. Band 197, 2018, S. 106–113; doi:10.1016/j.jclepro.2018.06.199.
- ↑ K. G. Gilbert nee Stoker, D. T. Cooke: Dyes from plants: Past usage, present understanding and potential. In: Plant Growth Regulation. Band 34, Nr. 1, 2001, S. 57–69; doi:10.1023/A:1013374618870.
- ↑ D. S. Balan, R. T. Monteiro: Decolorization of textile indigo dye by ligninolytic fungi. In: Journal of Biotechnology. Band 89, Nr. 2–3, 2001, S. 141–145; PMID 11500207.
- ↑ a b P. C. Floud: The English Contribution to the Early History of Indigo Printing. In: Journal of the Society of Dyers and Colourists. Band 76, 1960, S. 344–349; doi:10.1111/j.1478-4408.1960.tb02382.x.
- ↑ Patent US409906: Process of printing dark blue colors.
- ↑ Bundesweites Verzeichnis Immaterielles Kulturerbe | Deutsche UNESCO-Kommission. In: unesco.de. Abgerufen am 26. August 2024.
- ↑ L. Wang, G.-B. Zhou, P. Liu, J.-H. Song, Y. Liang, X.-J. Yan, F. Xu, B.-S. Wang, J.-H. Mao, Z.-X. Shen, S.-J. Chen, Z. Chen: Dissection of mechanisms of Chinese medicinal formula Realgar-Indigo naturalis as an effective treatment for promyelocytic leukemia. In: Proceedings of the National Academy of Sciences. Band 105, 2008, S. 4826–4831; doi:10.1073/pnas.0712365105.
- ↑ John Koo, Sumaira Arain: Traditional Chinese Medicine for the Treatment of Dermatologic Disorders. In: Archives of Dermatology. Band 134, 1998, S. 1388–1393. doi:10.1001/archderm.134.11.1388.
- ↑ Ralph Hoessel, Sophie Leclerc, Jane A. Endicott, Martin E. M. Nobel, Alison Lawrie, Paul Tunnah, Maryse Leost, Eve Damiens, Dominique Marie, Doris Marko, Ellen Niederberger, Weici Tang, Gerhard Eisenbrand, Laurent Meijer: Indirubin, the active constituent of a Chinese antileukaemia medicine, inhibits cyclin-dependent kinases. In: Nature Cell Biology. Band 1, 1999, S. 60–67; doi:10.1038/9035.
- ↑ Antonio Doménech-Carbó, Sigrid Holmwood, Francesca Di Turo, Noemí Montoya, Francisco Manuel Valle-Algarra, Howell G.M. Edwards, María Teresa Doménech-Carbó: Composition and Color of Maya Blue: Reexamination of Literature Data Based On the Dehydroindigo Model. In: The Journal of Physical Chemistry C. Band 123, 2018, S. 770–782; doi:10.1021/acs.jpcc.8b08448.
- ↑ Constantino Reyes-Valerio: De Bonampak al Templo Mayor. In: El azul maya en Mesoamerica. Siglo XXI Editores, Mexico DF 1993, S. 157. Azul Maya – Maya Blue Pigment. (englisch).
- ↑ K. Uehara, K. Takagishi, M. Tanaka: The Al/Indigo/Au photovoltaic cell. In: Solar Cells. Band 22, 1987, S. 295–301; doi:10.1016/0379-6787(87)90059-7.
- ↑ Roswitha Harrer: Indigo auf Speicherchips. In: Chemie in unserer Zeit. Band 46, 2012, S. 136; doi:10.1002/ciuz.201290032.
- ↑ Mihai Irimia-Vladu, Eric D. Głowacki, Pavel A. Troshin, Günther Schwabegger, Lucia Leonat, Diana K. Susarova, Olga Krystal, Mujeeb Ullah, Yasin Kanbur, Marius A. Bodea, Vladimir F. Razumov, Helmut Sitter, Siegfried Bauer, Niyazi Serdar Sariciftci: Indigo – A Natural Pigment for High Performance Ambipolar Organic Field Effect Transistors and Circuits. In: Advanced Materials. Band 24, 2012, S. 375–380; doi:10.1002/adma.201102619.
- ↑ H. Schweppe: Indigo and Woad. In: E. W. FitzHugh (Hrsg.): Artists’ Pigments. A Handbook of Their History and Characteristics. Band 3, Oxford University Press, Oxford 1997, S. 81–107 ([Artists Pigments: A Handbook of their History and Characteristics Digitalisat]).
- ↑ Vermeer, Christ in the House of Martha and Mary - ColourLex. In: colourlex.com. 18. März 2015, abgerufen am 26. August 2024 (englisch).
- ↑ P. Remler, W. Kosmus: Integrale Langzeitmethode zur Bestimmung von Ozon in der Atmosphäre. In: Fresenius' Zeitschrift für analytische Chemie. Band 329, 1988, S. 871–874; doi:10.1007/BF00471974.
- ↑ Daniel Grosjean, Paul M. Whitmore, Glen R. Cass, James R. Druzik: Ozone fading of natural organic colorants: mechanisms and products of the reaction of ozone with indigos. In: Environmental Science & Technology. Band 22, 1988, S. 292–298; doi:10.1021/es00168a009.
- ↑ Samurai Blue: A History of Indigo
- ↑ Rebecca Futo Kennedy, Molly Jones-Lewis: The Routledge Handbook of Identity and the Environment in the Classical and Medieval Worlds. Routledge, New York 2016, ISBN 978-0-415-73805-7, S. 155–161.
- ↑ Gundula Voß, Hans Gerlach: Regioselektiver Brom/Lithium-Austausch bei 2,5-Dibrom-1-nitrobenzol. – Eine einfache Synthese von 4-Brom-2-nitrobenzaldehyd und 6,6′-Dibromindigo. In: Chemische Berichte. Band 122, 1989, S. 1199–1201; doi:10.1002/cber.19891220628.
- ↑ Paul Friedländer: Über den Farbstoff des antiken Purpurs aus murex brandaris. In: Berichte der deutschen chemischen Gesellschaft. Band 42, 1909, S. 765–770; doi:10.1002/cber.190904201122.
- ↑ E. Grandmougin, P. Seyder: Über Indigo. V: Über halogenierte Indigo und Derivate. In: Berichte der deutschen chemischen Gesellschaft. Band 47, 1914, S. 2365–2373; doi:10.1002/cber.191404702154.
- ↑ Datenblatt Indigo (C.I. 73000) synth. (PDF) bei Carl Roth, abgerufen am 3. November 2019.
- ↑ Anne Vuorema: Reduction and Analysis Methods of Indigo. University of Turku, 2008, ISBN 978-951-29-3781-3, S. 14.
- ↑ Abraham Reife, Harold S. Freeman: Environmental Chemistry of Dyes and Pigments. John Wiley and Sons, New York 1996, ISBN 0-471-58927-6, S. 208–209.
- ↑ Patentanmeldung DE19831291: Concentrated leuco-indigo solution, especially for dyeing cotton warp yarn for blue denim, contains leuco-indigo in the form of a mixture of salts of at least two alkali metal hydroxidesl. Angemeldet am 13. Juli 1998, veröffentlicht am 20. Februar 2000, Anmelder: BASF AG, Erfinder: Manfred Gäng, Rudolf Krüger, Peter Miederer.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Autor/Urheber: DiplomBastler alias Torge Anders, Lizenz: CC BY-SA 3.0
Bild zur Prüfung der Farbdarstellung (Gammakorrektur der Farbkanäle) des Anzeigegeräts ("Bildschirm"). Eine Beschreibung, wie man das Bild verwendet, ist Hilfe:Farbdarstellung. Eine Beschreibung der Wirkungsweise des Bildes findet sich hier. Es existiert auch eine vektorisierte Version des Bildes, die jedoch, wie *alle* Vektorformate, *nicht* zur Kalibrierung geeignet ist. Näheres dazu siehe Vorlage_Diskussion:Hinweis_Farbdarstellung#Vektorgrafik_kann_hier_nicht_funktionieren. Bitte daher diese Raster-Version hier nicht durch eine Vektor-Version ersetzen.
The planting and manufacture of Indigo in Allahabad, India in 1877.
Indigo Synthese aus Anilin nach Heumann
chemical structure C.I. Acid Blue 74, Indigo carmine
Indigo Synthese aus Anthranilsäure nach Heumann,
Autor/Urheber: Michael Merle 01:25, 22. Sep 2004 (CEST), Lizenz: CC BY-SA 3.0
Indigo in seiner Leukoform
(Originaltext: Das Bild zeigt ca. zwei Spatelspitzen Indigo gelöst in etwa 150 mL Küpe. Das kleine Bild zeigt die blinde Küpe, die zum Lösen verwendet wurde (sie hat eine leichte Gelbfärbung). Man beachte dass der Indigo an der Glaswand des Erlenmeyerkolbens und der Oberfläche der Küpe sofort vom Luftsauerstoff oxidiert wird.)
Chromolithograph, "Indigo factory, Bengal," (1867) from William Simpson's 'India: Ancient and Modern'. Bengal was the world's largest producer of indigo in the 19th century.
Pantalón vaquero
Autor/Urheber: Geolina163, Lizenz: CC BY-SA 4.0
Dieses Medium (Foto/Audio/Video) zeigt das im Verzeichnis der Österreichischen UNESCO-Kommission
angeführte Immaterielle Kulturerbe
Indigo synthesis by A. v. Baeyer, starting from Cinnamic acid, via o-Nitro cinnamic acid, bromination, dehydropromination to o-Nitro propiolic acid, ring closure to Isantin by alkaline treatment and reduction to Indigo
Chemical Structure of Indican
Indoxyl
Indigoproduktion BASF um 1890
2 Isatin -> Indigo
Adolf von Baeyer, Nobel Prize in Chemistry 1905
Autor/Urheber: Stefan.lefnaer, Lizenz: CC BY-SA 4.0
Habitus
Taxon: Färber-Waid, Isatis tinctoria (s. str.) (sensu Fischer et al. EfÖLS 2008 ISBN 978-3-85474-187-9)
Fundort: Neue Donau, Wien-Floridsdorf - ca. 160 m ü. A.
synthesis of Anthranilic acid
Indigo synthesis from Nitrobenzaldehyde
Thermal Isomerization of Indigo to Dibenzonaphthyridindione
chromophoric system of Indigo
Baptisia tinctoria (L.) R.Br. - Yellow wild indigo, Yellow false indigo, Horsefly weed, Yellow broom, Rattleweed
Indigo; Indigo dye
allg. Indigostruktur
chemical H-bridged structure of Indigo
Biosynthesis of Indigo Precursors (Shikimi acid path)
Autor/Urheber: , Lizenz: CC0
Gewöhnlicher Teufelsabbiss (Succisa pratensis) an einem Randstreifen der Rheinbahn in der Schwetzinger Hardt mit binnendünenartiger Vegetation
Autor/Urheber: Kurt Stüber [1], Lizenz: CC BY-SA 3.0
Species: Indigofera tinctoria
Family: Fabaceae
schematic energy diagram for the bathochromic shift of the Indigo chromophore
Reduction of Indigo to Leuco-Indigo
Autor/Urheber: Kenlo Nasahara, Lizenz: CC BY-SA 4.0
Persicaria tinctoria, Tsukuba Botanical Garden, 2016/10/10