Impetigo contagiosa
| Klassifikation nach ICD-10 | |
|---|---|
| L01.0 | Impetigo contagiosa |
| ICD-10 online (WHO-Version 2019) | |
Die Impetigo contagiosa (von lateinisch impetigo, meist ein schuppender[1] oder nässender Hautausschlag‘; von impetere „angreifen“, „anfallen“; und von contagiosus „ansteckend“) ist eine hochinfektiöse bakterielle Hauterkrankung mit einem Häufigkeitsgipfel bei Kindern und Neugeborenen. Synonym werden die Begriffe Impetigo vulgaris, auch „Grindblasen“, „Grindflechte“, „Eitergrind“, „Eiterflechte“, „Borkenflechte“, „Schmierflechte“, „Schleppe“, „Schleppschiss“ oder „Schleppeiter“ verwendet.
Ursache
Ursache der Infektion sind Bakterien, die sich mit spezifischen Pathogenitätsfaktoren in der Haut ausbreiten und Gewebe zerstören können. Sowohl bei der großblasigen Form (bullöse Impetigo) als auch bei der kleinblasigen Form ist überwiegend Staphylococcus aureus anzutreffen. Bei beiden Formen, vor allem aber der kleinblasigen Form, kann nicht selten auch Streptococcus pyogenes (Streptokokken der Gruppe A) Auslöser der Hauterkrankung sein. Außerdem sind Mischinfektionen möglich.[2]
Am häufigsten sind Kinder betroffen, da sich die Erkrankung durch Schmierinfektion in Gemeinschaftseinrichtungen (Schulen, Kindergärten) oder unter Geschwistern epidemieartig ausbreiten kann. Eine Impetigo wird jedoch auch in allen anderen Altersgruppen beobachtet, besonders auch bei Patienten mit atopischem Ekzem, da durch Mikrotraumen beim Kratzen der Haut die Erreger sehr leicht in tiefe Hautschichten eindringen können.
Erkrankungsbild

Grundsätzlich wird zwischen einer kleinblasigen und einer großblasigen Variante der Impetigo contagiosa unterschieden. Beide Formen beginnen überwiegend im Gesicht zunächst mit roten Flecken (Makulae), die rasch in mit wasserklarer Flüssigkeit gefüllte Bläschen übergehen. Die Bläschen sind jeweils von einem schmalen Entzündungshof umgeben.[2]
Kleinblasige Impetigo contagiosa
Bei der kleinblasigen Impetigo contagiosa sind die Bläschen häufig nicht zu sehen. Die Wände der Bläschen sind sehr dünn, so dass sie schnell platzen. Der Blasengrund ist durch Exsudation stark nässend. Trocknet die Flüssigkeit, bilden sich charakteristische honiggelbe Krusten auf gerötetem Untergrund.[2]
Großblasige Impetigo contagiosa
Bei der großblasigen Impetigo contagiosa sind zahlreiche Bläschen vorhanden. Sie sind zunächst ebenfalls mit wasserklarer Flüssigkeit gefüllt, die aber im Verlauf zunächst weißlich-grau und dann rahmig-eitrig eintrübt.[2] Bei Platzen oder Aufkratzen der Bläschen entstehen gerötete, erodierte Flächen, die feucht glänzen. Im Gegensatz zur kleinblasigen Impetigo contagiosa bilden sich kaum stärkere Verkrustungen.[3]
Therapie
Laut derzeitigen Behandlungsleitlinien der Deutschen Dermatologischen Gesellschaft ist eine systemische Antibiotikatherapie in ernsten Fällen vorgesehen.[4] Hygienische Maßnahmen haben einen wichtigen Stellenwert bei der Behandlung: Die Vermeidung des Kratzens der betroffenen Hautstellen, regelmäßiges Händewaschen sowie regelmäßiges heißes Waschen der am Körper anliegenden Bekleidung und der Handtücher dämmen die Infektion ein und verhindern weitere Ansteckungen. Die Fingernägel der Betroffenen sollten kurzgeschnitten werden, damit die Möglichkeit des Kratzens und somit einer Weiterverbreitung reduziert wird. Das Verbinden bzw. Abdecken und Vermeiden von Kratzen fördert die spontane Heilungstendenz der Erkrankung.
Die Lokaltherapie kann mit antibiotikahaltigen Salben (Fusidinsäure, Mupirocin, Retapamulin[5][6]) unterstützt werden. Desinfizierende Lösungen, Bäder und Umschläge können ergänzend eingesetzt werden. Nur fortgeschrittene Fälle machen eine systemische Behandlung mit Antibiotika (z. B. mit Cephalosporinen) erforderlich.
Verlauf
Die Inkubationszeit beträgt zwischen zwei und zehn Tagen, unter Umständen auch länger. Die Erkrankung ist so lange infektiös, bis die offenen, eitrigen Hautstellen abgeheilt sind.
Bei konsequent angewandter Therapie heilt die Impetigo contagiosa in der Regel folgenlos aus. Die Hautschuppen und -krusten lösen sich von der gesunden Haut, so dass sie entweder abfallen oder von Hand entfernt werden können. Selten greifen die Erreger auf tiefere Hautschichten über und verursachen Nagelbett-, Nagelfalzentzündungen oder Abszesse. Gemeinschaftseinrichtungen wie Kindergärten oder Schulen dürfen vom Patienten erst nach Abheilen der infizierten Hautstellen wieder besucht werden.
Bei etwa 5 % der Patienten tritt nach dem Infekt (nur bei der kleinblasigen Form) eine Entzündungsreaktion der Niere auf (Poststreptokokken-Glomerulonephritis). Diese heilt meistens folgenlos aus.
Rechtliche Anmerkungen
Wegen der Ansteckungsgefahr sei darauf hingewiesen, dass eine Behandlung der Impetigo contagiosa in Deutschland laut § 24 Infektionsschutzgesetz (IfSG)[7] i. V. m. § 34 Abs. 1 IfSG „insoweit im Rahmen der berufsmäßigen Ausübung der Heilkunde nur Ärzten gestattet ist“,[7] was bedeutet, dass Heilpraktiker oder andere Gesundheitsberufe eine Behandlung nicht durchführen dürfen.
Außerdem bestehen besondere Regeln für Erkrankte in Gemeinschaftseinrichtungen laut § 34 IfSG, um eine Verbreitung zu verhindern. Die Leitungen von Gemeinschaftseinrichtungen haben nach Absatz 6 in Verbindung mit Absatz 1 das zuständige Gesundheitsamt unverzüglich zu benachrichtigen, wenn in ihrer Einrichtung betreute Personen oder Beschäftigte an Impetigo contagiosa (ansteckende Borkenflechte) erkrankt oder dessen verdächtig sind.[8]
Impetigo contagiosa ist keine meldepflichtige Krankheit[9] im Sinne des § 6 IfSG.
Abbildungen
- Staphylokokkeninfektion (Impetigo) der Nase
- Staphylokokkeninfektion der Ohrmuschel
- Eingetrocknete Impetigoblasen
- Staphylokokken auf einem Nährboden
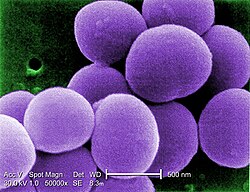
- Staphylokokken unter dem Elektronenmikroskop
Literatur
- M. L. O’Dell: Skin and wound infections: an overview. In: Am Fam Physician. 1998 May 15;57(10), S. 2424–2432. Review. PMID 9614412
- D. L. Stulberg, M. A. Penrod, R. A. Blatny: Common bacterial skin infections. In: Am Fam Physician. 2002 Jul 1;66(1), S. 119–124. Review. PMID 12126026
Einzelnachweise
- ↑ Paul Richter: Beiträge zur Geschichte des Aussatzes. In: Sudhoffs Archiv. Band 4, 1911, S. 323–352; hier: S. 335–337 und 340 f.
- ↑ a b c d Otto Braun-Falco, Helmut Heinrich Wolff: Dermatologie und Venerologie. 2005, ISBN 3-540-40525-9, S. 94.
- ↑ Otto Braun-Falco, Helmut Heinrich Wolff: Dermatologie und Venerologie. 2005, ISBN 3-540-40525-9, S. 95.
- ↑ http://www.awmf.org/leitlinien/detail/ll/013-038.html
- ↑ R. Jones, T. Fritsche, H. Sader, J. Ross: Activity of retapamulin (SB-275833), a novel pleuromutilin, against selected resistant gram-positive cocci. In: Antimicrob Agents Chemother. Band 50, Nr. 7, 2006, S. 2583–25836, doi:10.1128/AAC.01432-05, PMID 16801451, PMC 1489758 (freier Volltext).
- ↑ European Medicines Agency - Find medicine - Altargo. Abgerufen am 8. Februar 2012.
- ↑ a b § 24 Behandlung übertragbarer Krankheiten. Abgerufen am 8. Februar 2012.
- ↑ Streptococcus pyogenes-Infektionen. In: RKI-Ratgeber. Robert Koch-Institut, 1. Februar 2024, abgerufen am 20. Oktober 2024 (Benachrichtigungspflicht gemäß IfSG).
- ↑ Streptococcus pyogenes-Infektionen. In: RKI-Ratgeber. Robert Koch-Institut, 1. Februar 2024, abgerufen am 20. Oktober 2024 (Meldepflicht gemäß IfSG).
Auf dieser Seite verwendete Medien
Under a very high magnification of 50,000x, this scanning electron micrograph (SEM) shows a strain of Staphylococcus aureus bacteria taken from a vancomycin intermediate resistant culture (VISA).
Under SEM, one can not tell the difference between bacteria that are susceptible, or multidrug resistant, but with transmission electron microscopy (TEM), VISA isolates exhibit a thickening in the cell wall that may attribute to their reduced susceptibility to vancomycin . See PHIL 11158 for a black and white version of this image. VISA and VRSA are specific types of antimicrobial-resistant staph bacteria. While most staph bacteria are susceptible to the antimicrobial agent vancomycin some have developed resistance. VISA and VRSA cannot be successfully treated with vancomycin because these organisms are no longer susceptibile to vancomycin. However, to date, all VISA and VRSA isolates have been susceptible to other Food and Drug Administration (FDA) approved drugs.
How do VISA and VRSA get their names?
Staph bacteria are classified as VISA or VRSA based on laboratory tests. Laboratories perform tests to determine if staph bacteria are resistant to antimicrobial agents that might be used for treatment of infections. For vancomycin and other antimicrobial agents, laboratories determine how much of the agent it requires to inhibit the growth of the organism in a test tube. The result of the test is usually expressed as a minimum inhibitory concentration (MIC) or the minimum amount of antimicrobial agent that inhibits bacterial growth in the test tube. Therefore, staph bacteria are classified as VISA if the MIC for vancomycin is 4-8µg/ml, and classified as VRSA if the vancomycin MIC is >16µg/ml.
Skin lesions that proved to be impetigo. Impetigo is usually caused by Group A Streptococcus sp. or Staphylococcus aureus bacteria. Note how the maculopapular lesions resemble syphilis, which is caused by the Gram-negative Treponema pallidum spirochete.
Autor/Urheber: Nathan Reading on Flickr Nathan R. on twitter, Lizenz: CC BY 2.0
Staphylococcus aureus growing on Columbia horse blood agar
(c) Evanherk in der Wikipedia auf Niederländisch, CC BY-SA 3.0
krentenbaard op elleboog, eigen opname
Autor/Urheber: Klaus D. Peter, Wiehl, Germany, Lizenz: CC BY 3.0 de
Grindflechte oder Eiterflechte, Abtrocknungsstadium einer kleinblasigen Hautveränderung an der Nase. Staphylokokkus aureus wurde durch Kultur nachgewiesen.
Autor/Urheber: Klaus D. Peter, Wiehl, Germany, Lizenz: CC BY 3.0 de
Grindflechte oder Eiterflechte. Staphylokokkus aureus wurde durch Kultur nachgewiesen.