Iminodiacetonitril
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Iminodiacetonitril | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H5N3 | |||||||||||||||
| Kurzbeschreibung | weißes Kristallpulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 95,11 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Iminodiacetonitril (IDAN) ist ein wasserlösliches Dinitril mit einer sekundären Aminogruppe, das auch als Disubstitutionsprodukt durch Ersatz von zwei Wasserstoffatomen am Ammoniakmolekül durch –CH2CN-Gruppen aufgefasst werden kann.
IDAN findet unter anderem als Zwischenprodukt für den Chelatliganden Diethylentriamin (DETA) und das Totalherbizid Glyphosat Verwendung.
Herstellung
Hexamethylentetramin als Reaktand
Die Synthese von Iminoacetonitril aus Hexamethylentetramin (als Quelle für die eigentlichen Reaktanden Formaldehyd und Ammoniak) und Cyanwasserstoff wurde bereits 1894 beschrieben.[3]
Die Reaktion erfordert unter den gewählten Bedingungen mehrtägige Reaktionszeiten und nutzt nur drei der vier Stickstoffatome des Hexamethylentetramins. Die Variante nach Dubsky mit der Zugabe von Salzsäure, um entstehenden Ammoniak zu binden, mit Reaktionszeiten über 24 Stunden und einer Ausbeute von ca. 63 %, stellt keine wesentliche Verfahrensverbesserung dar.[5]
Die mangelnde Atomökonomie beim stöchiometrischen Einsatz von Hexamethylentetramin geht eine Prozessvariante an, bei dem der Reaktion Glycolnitril (HOCH2CN) zugesetzt wird.[6]
In diesem als Kontiprozess ausgelegten Verfahren wird eine wässrige Lösung der Reaktanden in einem Rohrreaktor bei 120–140 °C und einer Verweilzeit von etwa 2–3 Minuten zu praktisch quantitativem Umsatz gebracht.
Eine neuere Variante des Batch-Prozesses mit Hexamethylentetramin, 50%iger Formalin-Lösung und Cyanwasserstoff bei einem pH von 5,5 und 75 °C für zwei Stunden fällt beim Abkühlen IDAN in einer Ausbeute von 79 % aus.[7] Nach Erhöhung des pH-Werts auf 7 wird das Filtrat für weitere zwei Stunden bei 75 °C gehalten, wobei Nebenprodukte, wie Glycolnitril, Aminoacetonitril und Ammoniumsalze in IDAN überführt werden. Insgesamt wird so eine Gesamtausbeute an Iminodiacetonitril von 97 % erzielt.
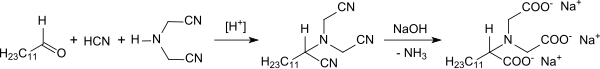
Formaldehyd, Cyanwasserstoff und Ammoniak als Reaktanden
Bei der Umsetzung von Kaliumcyanid mit wässriger Formaldehyd-Lösung wurde neben Glycolnitril die Bildung geringer Mengen von Iminodiacetonitril und Nitrilotriacetonitril gefunden.[8] Der für die Bildung von IDAN erforderliche Ammoniak stammt aus der Hydrolyse des Glycolnitrils zu Glycolsäure. Die Gesamtreaktion

verläuft jedoch nicht einheitlich. Wegen der komplexen Zusammensetzung der bei der Reaktion von Formaldehyd, Cyanwasserstoff und Ammoniak erhaltenen Produkte wurde der Einfluss der Prozessparameter Einsatzverhältnis der Reaktanden, Reaktionstemperatur, pH-Wert, Reaktionsdauer, sowie Batch-Prozess gegenüber Konti-Prozess intensiv untersucht und in vielen Verfahrenspatenten dokumentiert.

Bei einem Einsatzverhältnis von NH3:HCHO:HCN = 2:3:3, 0 bis 25 °C Reaktionstemperatur und einem pH-Wert von 5,5 bis 6,5 wird eine IDAN-Ausbeute von maximal 65 % bei einer Reaktionsdauer von ca. 20 Stunden erhalten.[4]
Auch bei einer Prozessvariante mit stöchiometrischen Mengen der Reaktanden, pH zwischen 3,5 und 5,5, einer Temperatur von 30 bis 65 °C und dem Ersatz von Ammoniak durch Ammoniumsalze, wie z. B. Ammoniumnitrat oder Ammoniumacetat werden nicht mehr als 74 % IDAN-Ausbeute erzielt.[9]
Statt wässriger Lösungen der (aufwendig) gereinigten Reaktanden können auch der ungereinigte Gasstrom aus dem HCN-Reaktor mit dem ebenfalls ungereinigten Gasstrom aus dem Formaldehyd-Reaktor zusammen mit Ammoniak und angesäuertem Wasser in einen reaktiven Gaswäscher bei 65 bis 70 °C zur Reaktion gebracht werden, wobei IDAN-Ausbeuten bis 85 %, allerdings bei Reaktionszeiten von über 10 Stunden erzielt werden können.[10]
IDAN-Synthesen aus Zwischenprodukten der Reaktion von HCHO, HCN und NH3
Aminoacetonitril und Glycolnitril reagieren innerhalb 15 Minuten bei 140 °C zu Iminodiacetonitril in einer Ausbeute von 78 %.[11]
In Abwesenheit von Glycolnitril kann Aminoacetonitril (AAN) durch Variation der Prozessparameter Temperatur, Reaktionszeit und Ammoniakmenge zu einem Aminonitrilgemisch aus AAN und IDAN in weiten Grenzen von 5 bis 70 Gewichtsprozent IDAN umgesetzt werden.[12]
Die Umsetzung von Glycolnitril mit Ammoniak bei einem pH-Wert von 5,5 bis 6 und 70 °C liefert in einem Batch-Prozess IDAN in einer Ausbeute von bis 81 %, im Konti-Prozess werden Glycolnitril-Umsätze von über 90 % erzielt. Neben dem Disubstitutionsprodukt IDAN werden als Nebenprodukte außer dem Monosubstitutionsprodukt Aminoacetonitril das Trisubstitutionsprodukt Nitrilotriacetonitril (NTAN) und das Kondensationsprodukt Methylen-bis-[iminodiacetonitril] (MBIDAN) gebildet.[13]
Eigenschaften
Iminodiacetonitril ist ein kristalliner Feststoff, der als weißes Pulver oder in langen, farblosen Nadeln[11] anfällt. Die Verbindung ist gesundheitsschädlich und kann schwere Haut- und Augenreizungen verursachen.
Anwendungen
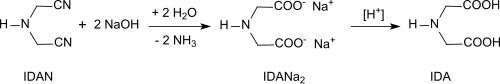
Die Hydrolyse der beiden Nitrilgruppen des Iminodiacetonitrils mit z. B. 20%iger Natronlauge bei 50 °C und anschließendes Ansäuern erzeugt den Komplexbildner Iminodiessigsäure (IDA).[6][7]
Hydrierung einer Lösung von IDAN in Tetrahydrofuran in Gegenwart Raney-Cobalt bei 180 bar und 120 °C liefert Diethylentriamin (DETA).[14]

Der Zusatz stark anionischer Ionenaustauscher vermindert die Hydrolyse von IDAN bei höheren Temperaturen, wobei DETA-Selektivitäten von bis zu 95 % erzielt werden können.[15]
Langkettige Glycin-N,N-diessigsäurederivate auf der Basis von IDAN weisen drei Carboxygruppen auf und eignen sich als bioabbaubare Komplexbildner für Erdalkalimetall- und Schwermetall-Ionen.[16]
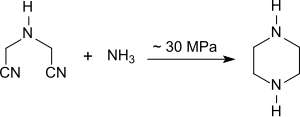
Iminodiacetonitril kann bei ca. 100 °C und ca. 300 atm Druck innerhalb von 4 Stunden in Gegenwart von Ammoniak und einem Nickel-Katalysator mit einer Ausbeute von 85 % in Piperazin überführt werden.[17]
Die Reaktion von IDAN mit Formaldehyd bei stark saurem pH-Wert (ca. 1) und 50 °C erzeugt gezielt das als Nebenprodukt bei der IDAN-Synthese anfallende Methylen-bis-[iminodiacetonitril] (MBIDAN) in Ausbeuten bis 81 %.[18]

IDAN reagiert mit Hydroxylamin in 88%iger Ausbeute zum Di-Amidoxim, das als effektiver Komplexbildner zur Entfernung von Metallverunreinigungen bei Reinigungsprozessen in der Halbleiterfertigung eingesetzt werden kann.[19]

Ein alternativer Syntheseweg zum Anthelmintikum Praziquantel[20]
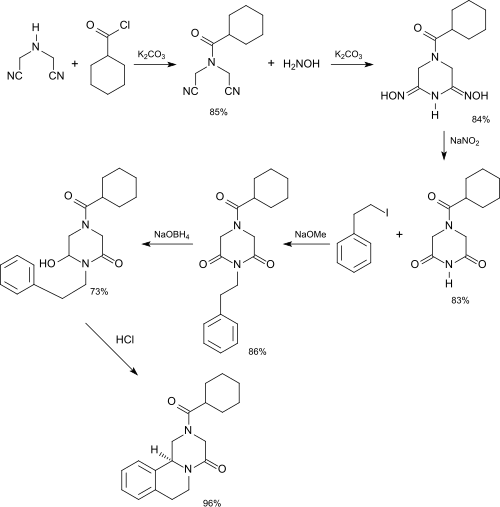
geht aus von IDAN und führt über sechs Stufen in 35 % Gesamtausbeute zum Zielprodukt.
Die quantitativ wichtigste Anwendung von Iminodiacetonitril liegt in der so genannten IDAN-Route – auch als HCN-Prozess bezeichnet – zu einem Schlüsselintermediat N-Phosphonomethyliminodiessigsäure (PMIDA)[21] des Totalherbizids Glyphosat (Roundup®).[22]

Bei Verfügbarkeit von preisgünstigem Cyanwasserstoff nach dem Andrussow-Verfahren und dem Einsatz der katalytischen Luftoxidation des PMIDA zu Glyphosat ist die IDAN-Route gegenüber den Alternativrouten DEA-Prozess (ausgehend von Ethylenoxid) und insbesondere gegenüber dem älteren Glycin-Prozess (ausgehend von Monochloressigsäure bzw. Paraformaldehyd) wirtschaftlich interessant.
Einzelnachweise
- ↑ a b c d e Eintrag zu Iminodiacetonitrile bei TCI Europe, abgerufen am 10. Februar 2016.
- ↑ a b c Datenblatt Iminodiacetonitrile bei Alfa Aesar, abgerufen am 14. August 2020 (Seite nicht mehr abrufbar).
- ↑ a b W. Eschweiler: Ueber einige Acetonitrile. In: Justus Liebigs Ann. Chem. Band 278, Nr. 2, 1894, S. 229–239, doi:10.1002/jlac.18942780207.
- ↑ a b Patent US2794044: Synthesis of iminoacetonitrile. Angemeldet am 30. August 1955, veröffentlicht am 28. Mai 1957, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: W.R. Miller.
- ↑ J.V. Dubsky: Zur Kenntnis der Diketo-piperazine, XI. Mitteilung: E. Dingemanse: 3,5-diketo-1-benzyl-[hexahydro-1.4-diazin]. In: Ber. dtsch. chem. Ges. Band 54, Nr. 10, 1921, S. 2659–2667, doi:10.1002/cber.19210541014.
- ↑ a b Patent US3904668: Process for preparing iminodiacetonitrile and alkali metal iminodiacetates. Angemeldet am 15. November 1973, veröffentlicht am 9. September 1975, Anmelder: W.R. Grace & Co., Erfinder: R.R. Gaudette, J.E. Philbrook, J.C. Thunberg.
- ↑ a b Patent EP0413673B2: Process for the preparation of iminodiacetonitrile. Angemeldet am 13. August 1990, veröffentlicht am 20. November 1996, Anmelder: Monsanto Company, Erfinder: K.E. Koenig, P.A. Morrison, G.A. Lanser, R.B. Weisenfeld.
- ↑ K. Polstorff, H. Meyer: Über die Einwirkung von Cyankalium auf Formaldehyd. In: Ber. dtsch. chem. Ges. Band 45, Nr. 2, 1912, S. 1905–1912, doi:10.1002/cber.19120450263.
- ↑ Patent US4661614: Process for the preparation of iminodiacetonitrile. Angemeldet am 6. März 1986, veröffentlicht am 28. April 1987, Anmelder: Monsanto Company, Erfinder: J.T. Most, T.J. Richard.
- ↑ Patent US4895971: Process for the production of iminodiacetonitrile. Angemeldet am 31. Oktober 1988, veröffentlicht am 23. Januar 1990, Anmelder: W.R. Grace & Co.-Conn., Erfinder: J.-L. Su, M.B. Sherwin.
- ↑ a b Patent US2511487: Synthesis of iminodiacetonitrile. Angemeldet am 8. August 1946, veröffentlicht am 13. Juni 1950, Anmelder: E.I. du Pont de Nemours & Company, Erfinder: H.T. Thompson.
- ↑ Patent US8153845B2: Method for producing aminonitriles. Angemeldet am 28. Februar 2008, veröffentlicht am 10. April 2012, Anmelder: BASF SE, Erfinder: A. Oftring, K. Dahmen, T. Hahn, R. Hugo, K. Baumann, J.-P. Melder.
- ↑ Patent US5187301: Preparation of iminoacetonitrile from glycolonitrile. Angemeldet am 11. Oktober 1990, veröffentlicht am 16. Februar 1993, Anmelder: W.R. Grace & Co.-Conn., Erfinder: B.A. Cullen, B.A. Parker.
- ↑ Patent US7880035B2: Method for producing ethyleneamines. Angemeldet am 28. Februar 2008, veröffentlicht am 1. Februar 2011, Anmelder: BASF SE, Erfinder: A. Oftring, K. Dahmen, T. Hahn, R. Hugo, K. Baumann, J.-P. Melder.
- ↑ Patent EP2684862A1: Method for preparing N-(2-aminoethyl)ethane-1,2-diamine. Angemeldet am 1. April 2012, veröffentlicht am 15. Januar 2014, Anmelder: Wanhua Chemical Group Co., Ltd., Ningbo Wanhua Polyurethanes Co., Ltd., Erfinder: F. Li, Y. Li, K. Ding, W. Zhao, X. Yu, W. Hua.
- ↑ Patent US6420593B2: Method for producing long-chain glycine-N,N-diacetic acid derivatives. Angemeldet am 8. Juni 2001, veröffentlicht am 16. Juli 2002, Anmelder: BASF AG, Erfinder: R. Rahm, T. Greindl, A. Oftring, G. Oetter, J. Detering, G. Braun.
- ↑ Patent US2809196: Synthesis of piperazine. Angemeldet am 30. August 1955, veröffentlicht am 8. Oktober 1957, Anmelder: E.I. du Pont de Nemours & Co., Erfinder: W.R. Miller.
- ↑ Patent US3532735: Preparation of methylenebisiminodiacetonitrile. Angemeldet am 7. Oktober 1968, veröffentlicht am 6. Oktober 1970, Anmelder: W.R. Grace & Co., Erfinder: C.R. Morgan.
- ↑ Patent US7838483B2: Process of purification of amidoxime containing cleaning solutions and their use. Angemeldet am 29. Oktober 2008, veröffentlicht am 23. November 2010, Anmelder: EKC Technology, Inc., Erfinder: W.M. Lee, C.C.Y. Chen.
- ↑ Patent US4523013: 4-Acyl-2,6-dioxo-1-phenethyl piperozines. Angemeldet am 31. Januar 1983, veröffentlicht am 11. Juni 1985, Anmelder: Sanofi S.A., Erfinder: D. Fréhel, J.-P. Maffrand.
- ↑ Patent US4724103: Process for preparing N,N-diacetic acid aminomethylenephosphonic acid. Angemeldet am 5. Dezember 1984, veröffentlicht am 9. Februar 1988, Anmelder: Monsanto Co., Erfinder: M.J. Gentilcore.
- ↑ J. Tian, H. Shi, X. Li, Y. Yin, L. Chen: Coupling mass balance analysis and multi-criteria ranking to assess the commercial-scale synthetic alternatives: a case study on glyphosate. In: Green Chemistry. Band 14, 2012, S. 1990–2000, doi:10.1039/C2GC35349K.
Auf dieser Seite verwendete Medien
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Bildung langkettiger Glycin-N,N-diessigsäurederivate
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Synthese von Praziquantel über IDAN
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Umsetzung von IDAN mit Hydroxylamin zu Amidoxim
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Bildung von Iminodiessigsäure aus Iminodiacetonitril
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Produktgemisch bei IDAN-Synthese
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Bildung von Piperazin aus IDAN
Structure of Iminodiacetonitrile
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Diethylentriamin (DETA) aus Iminidiacetonitril (IDAN)
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
IDAN-Synthese aus Formaldehyd+Ammoniak+Cyanwasserstoff
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Glyphosat-Synthese über IDAN-Route











