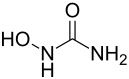
Hydroxycarbamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Hydroxycarbamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CH4N2O2 | ||||||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | L01XX05 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | Ribonukleotidreduktase-Hemmer | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 76,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Hydroxycarbamid (INN), auch Hydroxyharnstoff oder Hydroxyurea, ist ein Zytostatikum, das zur Behandlung insbesondere von malignen Bluterkrankungen (Leukämien, Myeloproliferative Neoplasien) eingesetzt wird. Es ist auch für die Behandlung der Sichelzellkrankheit zugelassen.
Wirkungsmechanismus
Die Wirkung der Substanz beruht auf der Hemmung des Enzyms Ribonukleotidreduktase, welche die Ribose zur Desoxyribose reduziert. Diese verläuft über einen radikalischen Mechanismus, der die Bildung eines Tyrosinradikals im aktiven Zentrum des Enzyms erfordert. Das stabile Tyrosinradikal entsteht durch ein nahegelegenes Eisenzentrum, welches aus zwei Fe3+ besteht. Hydroxyharnstoff komplexiert das Eisen und bewirkt die Reduktion des Eisens zum Fe2+, wodurch die DNA-Synthesekapazität der jeweiligen Zelle deutlich eingeschränkt wird.[3]
Hydroxyharnstoff ist außerdem ein Ureaseinhibitor.[4]
Pharmakokinetik
Nach oraler Gabe wird Hydroxycarbamid schnell aus dem Magen-Darm-Trakt resorbiert. Die genaue Bioverfügbarkeit ist nicht bekannt, scheint aber hoch zu sein (kein wesentlicher Unterschied in den Spiegeln bei oraler versus i.v. Gabe). Die maximale Serumkonzentration wird etwa 2 Stunden nach Einnahme erreicht. Da das Molekül relativ klein ist, diffundiert Hydroxycarbamid gut in verschiedene Körperkompartimente. Bei höheren Blutspiegeln wird auch die Blut-Hirn-Schranke überwunden und es erfolgt ein Übertritt in den Liquor. Die Substanz dringt auch in Aszites, Pleuraergüsse und in die Muttermilch ein. Der Mechanismus der Biotransformation bzw. Metabolisierung ist nicht genau bekannt. Eine Metabolisierung über das Cytochrom P450-System erfolgt nicht. Die Substanz wird in unveränderter Form überwiegend über die Nieren ausgeschieden.
Medizinische Anwendung
Bei myeloproliferativen Erkrankungen
Hydroxycarbamid findet Anwendung zur zytoreduktiven Therapie bei myeloproliferativen Erkrankungen (Chronische myeloische Leukämie (CML), Polycythaemia vera, Essentielle Thrombozythämie, Osteomyelofibrose). Die Anwendung bei CML ist nach der Einführung von Imatinib (Glivec) stark zurückgegangen, aber in bestimmten Situationen kann der Einsatz von Hydroxycarbamid weiterhin sinnvoll sein. Bei Polycythaemia vera ist zunächst der regelmäßige Aderlass meist die Behandlungsmethode der Wahl, bei deutlich erhöhten Leukozytenzahlen oder Thrombozytenzahlen kann der Einsatz von Hydroxycarbamid jedoch sinnvoll sein. Auch hier ist die Verwendung von Hydroxycarbamid seit Zulassung von Ruxolitinib (Jakavi) im Jahr 2012 zurückgegangen. Ein klassisches Einsatzgebiet ist auch die essentielle Thrombozythämie, hier konkurriert die Substanz mit dem Medikament Anagrelid (Xagrid). Die Osteomyelofibrose ist ebenfalls ein typisches Einsatzfeld.
Sichelzellkrankheit
Durch die europäische Arzneimittelbehörde EMA wurde die Substanz auch zur Behandlung der Sichelzellkrankheit zugelassen.[5] Am 29. Juni 2007 erhielt die Firma Addmedica (Paris) die Genehmigung für das Inverkehrbringen von Hydroxycarbamid (Siklos) für diese Indikation.[6] Bei Patienten mit Sichelzellkrankheit kommt es gelegentlich zu mitunter lebensbedrohlichen und schmerzhaften vaso-okklusiven Krisen, d. h. Gefäßverschlüssen durch Zusammenklumpung von Sichelzellen. Hydroxycarbamid steigert die Synthese des fetalen Hämoglobins (HbF), das bei Erwachsenen üblicherweise nur noch in Spuren produziert wird. Ein prozentual erhöhter intraerythrozytärer Anteil von HbF wirkt einer Aggregation des Sichelzellhämoglobins (HbS) entgegen. In mehreren klinischen Studien konnte die Wirksamkeit im Rahmen vaso-okklusiver Krisen gezeigt werden.[7]
Antiretrovirale Therapie bei HIV-Infektion
Eine Reihe von klinischen Studien hat die Kombination von Hydroxycarbamid mit antiretroviralen Substanzen zur Therapie der HIV-Infektion untersucht. Dabei zeigten sich uneinheitliche Ergebnisse.[8][9][10] Eine Anwendung sollte daher nur innerhalb von kontrollierten klinischen Studien erfolgen. Eine Zulassung für die Behandlung der HIV-Infektion hat die Substanz nicht.
Off-Label-Use
Hinweise zur Anwendung von Hydroxycarbamid bei chronischer myelomonozytärer Leukämie (CMML) gemäß §30 Abs. 2 AM-RL.[11]
Nebenwirkungen
Mögliche Nebenwirkungen sind zum Beispiel: Benommenheit, Übelkeit, Erbrechen (selten), Diarrhoe, Verstopfung, Mundschleimhautentzündung (selten), Appetitverlust, Haarausfall, Hautausschlag, Leberwerterhöhung (meist vorübergehend). Die medizinisch bedeutsamste Nebenwirkung ist die dämpfende Wirkung nicht nur auf die Bluterkrankung, sondern auch auf die gesunde Blutbildung (Myelosuppression). Diese Wirkung limitiert meist die Dosis, die gegeben werden kann. Eine wichtige Nebenwirkung ist auch die Erhöhung des Harnsäurespiegels im Blut. Bei entsprechend prädisponierten Patienten kann es dadurch zur Verschlechterung der Nierenfunktion oder sogar zum Gichtanfall kommen. Die Frage, ob Hydroxycarbamid ein leukämogenes Potential hat, d. h. ob bei einer Behandlung ein erhöhtes Risiko besteht, später an einer Leukämie zu erkranken, wird kontrovers diskutiert. Wahrscheinlich ist von einem geringen Risiko auszugehen.[12] Es wurde außerdem über vereinzelte Fälle von Patienten mit Spinaliomen (Plattenepithelkarzinomen der Haut) nach Hydroxycarbamid-Therapie berichtet.[13]
Anwendung in der Schwangerschaft
Hydroxycarbamid ist im Tierversuch eindeutig genotoxisch und embryotoxisch. Frauen, die eine Schwangerschaft planen, sollten Hydroxycarbamid nach Rücksprache mit dem behandelnden Arzt absetzen.
Handelsnamen
Litalir (D, A, CH), Siklos (A), Syrea (D), Hydrea (D, A), Xromi (EU)[14]
Einzelnachweise
- ↑ a b c d e Datenblatt Hydroxyurea bei Alfa Aesar, abgerufen am 28. April 2017 (Seite nicht mehr abrufbar).
- ↑ Eintrag zu Hydroxyurea in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Schubert-Zsilavecz, Manfred., Roth, Hermann J.: Medizinische Chemie: Targets - Arzneistoffe - chemische Biologie. 2., völlig neu bearb. und erw. Auflage. Dt. Apotheker-Verl, Stuttgart 2010, ISBN 978-3-7692-5002-2.
- ↑ Glen R. Gale: Inhibition of urease by hydroxyurea. In: Biochemical Pharmacology. Band 14, Nr. 5, Mai 1965, S. 693–698, doi:10.1016/0006-2952(65)90086-9.
- ↑ hydroxycarbamide. (PDF, 66 kB) European Medicines Agency, 2014, archiviert vom (nicht mehr online verfügbar) am 19. März 2018; abgerufen am 17. Juni 2024 (englisch).
- ↑ European Medicines Agency – Find medicine – Siklos. Abgerufen am 7. September 2012.
- ↑ M. H. Steinberg, F. Barton, O. Castro, C. H. Pegelow, S. K. Ballas, A. Kutlar, E. Orringer, R. Bellevue, N. Olivieri, J. Eckman, M. Varma, G. Ramirez, B. Adler, W. Smith, T. Carlos, K. Ataga, L. DeCastro, C. Bigelow, Y. Saunthararajah, M. Telfer, E. Vichinsky, S. Claster, S. Shurin, K. Bridges, M. Waclawiw, D. Bonds, M. Terrin: Effect of hydroxyurea on mortality and morbidity in adult sickle cell anemia: risks and benefits up to 9 years of treatment. In: JAMA. 289(13), 2003, S. 1645–1651. PMID 12672732.
- ↑ I. Frank, R. J. Bosch, S. Fiscus, F. Valentine, C. Flexner, Y. Segal, P. Ruan, R. Gulick, K. Wood, S. Estep, L. Fox, T. Nevin, M. Stevens, J. J. Eron Jr; ACTG 307 Protocol Team: Activity, safety, and immunological effects of hydroxyurea added to didanosine in antiretroviral-naive and experienced HIV type 1-infected subjects: a randomized, placebo-controlled trial, ACTG 307. In: AIDS Res Hum Retroviruses. 20(9), 2004, S. 916–926. PMID 15597521.
- ↑ S. Swindells, C. J. Cohen, D. S. Berger, K. T. Tashima, Q. Liao, B. F. Pobiner, J. W. Snidow, G. E. Pakes, J. E. Hernandez; NZTA4008 Study Team: Abacavir, efavirenz, didanosine, with or without hydroxyurea, in HIV-infected adults failing initial nucleoside/protease inhibitor-containing regimens. In: BMC Infect Dis. 5(1), 2005, S. 23. PMID 15819974.
- ↑ F. Lori, A. Foli, A. Groff, L. Lova, L. Whitman, N. Bakare, R. B. Pollard, J. Lisziewicz: Optimal suppression of HIV replication by low-dose hydroxyurea through the combination of antiviral and cytostatic ('virostatic') mechanisms. In: AIDS. 19(11), 2005, S. 1173–1181. PMID 15990570.
- ↑ Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL) (PDF; 68 kB). Beschluss des G-BA vom 12. Februar 2013.
- ↑ Essentielle Thrombozythämie (ET): Leukämogenes Risiko nach Behandlung mit Hydroxycarbamid. In: Der Arzneimittelbrief. 5, 1998, S. 39 weblink.
- ↑ Spinaliome unter Hydroxycarbamid ("Aus der UAW-Datenbank"). In: Deutsches Ärzteblatt. Jg. 99, Heft 19, 10. Mai 2002. weblink.
- ↑ Xromi | European Medicines Agency (EMA). 8. Juli 2019, abgerufen am 13. Februar 2025 (englisch).
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Structure of 1-hydroxyurea

