Hydrazin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hydrazin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
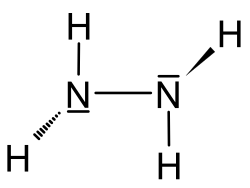
| Summenformel | N2H4 | ||||||||||||||||||
| Kurzbeschreibung | farblose, klare Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 32,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig[1] | ||||||||||||||||||
| Dichte | 1,01 g·cm−3 (20 °C)[1], bzw. 1,00 g·cm−3 (25 °C) | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit | mischbar mit Wasser[1] | ||||||||||||||||||
| Brechungsindex | 1,47 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: krebserzeugend (CMR)[6] | ||||||||||||||||||
| MAK | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Hydrazin ist eine sehr giftige anorganische chemische Verbindung aus Stickstoff und Wasserstoff mit der Summenformel N2H4. Es ist eine farblose, ölige, ähnlich wie Ammoniak riechende, an Luft rauchende Flüssigkeit. Hydrazin verbrennt mit einer kaum sichtbaren Flamme. In den Handel kommt es meist als wässrige Lösung oder als Hydrazinhydrat (H2N–NH2 · H2O).
Geschichte
Im Jahr 1875 stellte der deutsche Chemiker Emil Fischer erstmals Phenylhydrazin her und führte damit den Namen Hydrazin ein.[8] Unsubstituiertes Hydrazin entdeckte 1887 der deutsche Chemiker Theodor Curtius.[9] Die Reindarstellung gelang 1894 dem niederländischen Chemiker Cornelis Adriaan Lobry van Troostenburg de Bruyn.[10][11]
Herstellung
Technisch
Technisch gibt es mehrere Wege zur Synthese von Hydrazin:[12]
- Raschig-Synthese: Oxidation von Ammoniak (NH3) mit Natriumhypochlorit.
- Ammoniaklösung und Hypochloritionen reagieren rasch zu Chloramin und Hydroxidionen.
- Mit hohem Druck wird Ammoniakgas im Überschuss in die Lösung gepresst, dabei erwärmt sich diese auf ca. 400 K, und es erfolgt die Weiterreaktion zu Hydrazin.
- Bayer-Prozess: Oxidation von Ammoniak mit Natriumhypochlorit in Gegenwart von Aceton.
- Hydrazin bildet mit Aceton ein Ketazin, das Kondensationsprodukt eines Ketons mit Hydrazin.
- Das Ketazin lässt sich bei 8–12 bar und 180 °C zu Hydrazin hydrolysieren.
- Pechiney-Ugine-Kuhlmann-Prozess: Das technisch verstärkt angewandte Verfahren besteht in der Oxidation von Ammoniak mit Wasserstoffperoxid (H2O2) in Anwesenheit von Methylethylketon als Ketazinbildner sowie Acetamid und Natriumdihydrogenphosphat als Aktivatoren.
- Das Ammoniak-Wasserstoffperoxid-Gemisch reagiert mit dem Keton zu einem Ketazin und Wasser.
- Das erhaltene Ketazin kann wie beim Bayer-Prozess durch Hydrolyse leicht in Hydrazin überführt werden.
- Die Vorteile gegenüber dem Raschig- und Bayer-Prozess sind ein geringerer Energieverbrauch und das Fehlen anfallender Chloride.
Im Labor
- Durch Einleiten von Chlor in eine 20%ige Harnstofflösung und anschließender Zugabe von 20%iger Natronlauge. Die Ausbeute liegt bei etwa 50 %.
- Der mechanistische Ablauf ist derselbe wie der der Hofmann-Umlagerung: Zuerst Bildung des Amidat-Ions durch Deprotonierung, dann elektrophile Halogenierung des Amidat-Ions, gefolgt von der zweiten Deprotonierung. Das Chloramidation zerfällt spontan zum Acylnitren und einem Chloridion. Das Acylnitren lagert sich zum Isocyanat um, welches unter Addition von Wasser die unbeständige Carbamidsäure liefert, die dann zu Kohlendioxid und Hydrazin zerfällt. Das entstandene Kohlendioxid wird unter Bildung von Natriumcarbonat von der Natronlauge aufgenommen.
- Harnstoff, Chlor und Natriumhydroxidlösung reagieren zu Hydrazin, Natriumcarbonat und Natriumchlorid.
- Das Monohydrat kann ebenfalls aus trockenem Hydraziniumsulfat und Kaliumhydroxid durch Zugabe von Wasser und anschließender Destillation in einer Ausbeute von 25 % der Theorie erhalten werden:
- Zu 99,5 % wasserfreies Hydrazin entsteht bei der fraktionierten Destillation des Monohydrats mit Natriumhydroxid im Stickstoffstrom.
- Eine weitere Möglichkeit zur Herstellung trockenen Hydrazins ist die Freisetzung von Hydrazin aus Hydrazinium-Salzen durch Zugabe der stärkeren Base Ammoniak als Säurebinder:[13]
Eigenschaften
Reines Hydrazin[14] kann beim Erhitzen explosionsartig zu Ammoniak und Stickstoff disproportionieren. Die Reaktion verläuft mit einer Reaktionsenthalpie von −123,3 kJ·mol−1 bzw. −4128 kJ·kg−1 stark exotherm.[15]
Konzentrierte Lösungen sind in Verbindung mit Oxidationsmitteln hochexplosiv, teilweise hypergol. Hydrazin kann auch katalytisch zersetzt werden; dies wird in der Technik angewandt, z. B. in Korrektur- oder Nottriebwerken.
Die Verbindung bildet mit Wasser ein Azeotrop mit einem Hydrazin-Gehalt von 58,5 %, das bei 120,5 °C siedet.[16]
Säure-/Baseverhalten
Hydrazin ist eine zweiwertige Base (pKb1 = 6,07; pKb2 = 15), jedoch schwächer als Ammoniak (pKb = 4,75). Es reagiert als zweiwertige Base mit Säuren zu zwei Reihen von Hydraziniumsalzen (Name analog zum Ammonium) mit der allgemeinen Zusammensetzung [H2N–NH3]+X− und [H3N–NH3]2+2X−. Mit Salzsäure bildet sich Hydraziniummonochlorid ([H2N–NH3]Cl) und Hydraziniumdichlorid ([H3N–NH3]Cl2). Mit Schwefelsäure bildet sich Hydraziniumsulfat ([H3N–NH3]SO4) und Dihydraziniumsulfat ([H2N-NH3]2SO4).
Gegenüber sehr starken Basen (pKb ≪ 0) fungiert Hydrazin auch als Säure. So kann durch Reaktion von Natriumhydrid oder Natriumamid mit Hydrazin äußerst oxidationsempfindliches Natriumhydrazid erhalten werden, in welchem Hydrazid-Anionen vorliegen (N2H3−). Umgekehrt reagieren Hydrazid-Ionen mit Wasser praktisch vollständig zu Hydroxid-Ionen und Hydrazin.
Verwendung
Energielieferant (Brennstoff, Antriebsmittel)
Raketentreibstoff
Aufgrund seiner hochreaktiven Eigenschaften verwendet man Hydrazin vor allem als Raketentreibstoff, der mit den Oxidatoren Distickstofftetroxid oder Salpetersäure eine hypergole Treibstoffkombination bildet. Hydrazin wird nicht nur pur, sondern auch gemischt zusammen mit 1,1-Dimethylhydrazin mit den oben genannten Oxidatoren verwendet. Bekannte Gemische mit verschiedener Konzentration der beiden Bestandteile zueinander sind Aerozin 50 und UH 25.
Brennstoffzellen

Hydrazin kann in geeigneten Brennstoffzellen, den Hydrazin-Brennstoffzellen, zur elektrochemischen Stromerzeugung genutzt werden. Die Speicherung des flüssigen Hydrazinhydrats kann im Vergleich zum gasförmigen Wasserstoff in beliebig geformten Tanks erfolgen, da diese für geringere Drücke ausgelegt werden können. Aufgrund der Giftigkeit des Hydrazins ist die Anwendung von Hydrazin-Brennstoffzellen nur noch in Sonderbereichen wie der Raumfahrt oder beim Militär denkbar.
Monotreibmittel für Schubdüsen, Notenergieaggregate und Auftauchsysteme
Hydrazin wird in Korrekturtriebwerken verwendet, wo es katalytisch in einer stark exothermen Reaktion in gasförmigen Stickstoff und Wasserstoff zersetzt wird, zum Beispiel auch bei den Voyager-Sonden.[17][18] Nach Firmenangaben aus dem Jahr 2018 arbeiten über 500 hydrazinbetriebene Schubdüsen im Weltraum, und auch in der Ariane 5 kommen sie zum Einsatz.[19]
In der General Dynamics F-16 wird Hydrazin als Treibstoff für ein Notenergieaggregat mitgeführt.[20][21]
In U-Booten, z. B. in der U-Boot-Klasse 214, wird ein Hydrazinzersetzer als integrale Komponente eines Rettungssystems verwendet, das RESUS (REscue system for SUbmarineS) genannt wird, und das mit Hilfe des durch Hydrazinzersetzung entstandenen Gasdrucks auch dann ein Auftauchen des U-Boots ermöglicht, wenn andere Systeme versagt haben.[22]
Chemie
Korrosionsinhibitor
Verdünnte Hydrazin-Lösungen werden auch als Reagenzien im Labor sowie zur Deoxigenierung (Befreiung von Sauerstoff) von Kesselspeisewasser in Dampfkraftwerken eingesetzt. Die Verwendung erfolgt sowohl für die Entfernung des Restsauerstoffes nach Speisewasserentgasung, zum Schutz gegen mögliche geringe Sauerstoffeinbrüche im Bereich des Kondensators wie auch für die katalytische Sauerstoffentfernung aus dem Zusatzwasser. Der Vorteil von Hydrazin ist, dass nur Stickstoff und Wasser bei dieser Reaktion entstehen.[23] Neben der Deoxigenierung wird auch eine Anhebung des pH-Wertes im Wasser-Dampf-Kreislauf erreicht.
Reduktionsmittel
In der chemischen Synthese wird Hydrazin vor allem als starkes Nukleophil (sogenannter alpha-Effekt) und als Reduktionsmittel von Carbonylgruppen (Wolff-Kishner-Reaktion) oder als Wasserstoff-Quelle in der katalytischen Hydrierung[24] verwendet.
Umweltgefahren

Hydrazin wird als lagerbarer Treibstoff in vielen Raketen, Satelliten und Raumsonden verwendet. Dies kann zu einer erheblichen Umweltgefahr führen, wenn ein Raketenstart misslingt. Hat ein Satellit bereits eine Umlaufbahn erreicht, ist es aufgrund der hohen Geschwindigkeit von mindestens acht Kilometern pro Sekunde und der ungünstigen aerodynamischen Verhältnisse bei den kugelförmigen Tanks praktisch ausgeschlossen, dass diese auf den Erdboden aufschlagen, da sie aufgrund der hohen kinetischen Energie in der Atmosphäre verglühen. Das Hydrazin zersetzt sich dabei.
Bei der Challenger-Katastrophe 1986 wurde keine Hydrazin-Kontamination festgestellt. Nach einer erfolgreichen Shuttle-Landung war stets eine der ersten Sicherheitsmaßnahmen, den stehenden Orbiter auf austretendes Hydrazin zu untersuchen. Erst wenn dieser Test negativ ausfiel, durften sich weitere Hilfsfahrzeuge, etwa zur Kühlung, dem Shuttle nähern.
Bei der Columbia-Katastrophe im Jahre 2003 wurde vor einer möglichen Hydrazin-Kontamination von der NASA in den Medien gewarnt, und tatsächlich wurde im Jahr 2011 in einem texanischen See ein weitgehend intakter Hydrazin-Tank der Columbia gefunden.[25]
Auch bei Abstürzen von Kampfjets des Types F-16 wird regelmäßig vor den Gefahren des mitgeführten Hydrazins gewarnt[26] sowie das umliegende Grund- und Trinkwasser auf etwaige Kontaminierungen getestet[27] und teilweise geringfügige Mengen gemessen.[28]
Der Abschuss des US-amerikanischen USA-193-Satelliten 2008 wurde in den Medien mit der Gefährdung durch das an Bord befindliche Hydrazin begründet.
Sicherheitshinweise
Hydrazin ist sehr giftig, im Tierversuch krebserzeugend und wirkt hochtoxisch auf Wasserorganismen. Hydrazin wird auch über die Haut resorbiert. Hydrazin hat eine Akzeptanzkonzentration von 1,7 ppb und eine Toleranzkonzentration von 17 ppb nach TRGS 910.[1]
Die Verwendung von Hydrazin in Wasser-Dampf-Systemen (Dampfkesselanlagen und Fernwärmesystemen) unterliegt bereits seit 1991 strengen Vorschriften, die in der TRGS 608[29] definiert sind. So ist z. B. die direkte Trinkwassererwärmung bei Fernwärmesystemen, die mit Hydrazin konditioniert sind, nicht zulässig, sondern es muss ein Zweikreissystem installiert werden.
Hydrazin ist seit Juni 2011 wegen des Verdachts auf krebserregender Wirkung in die SVHC-Kandidatenliste (Liste besonders besorgniserregender Stoffe) aufgenommen. Dies hat zunächst nur Auswirkungen auf besondere Informationspflichten in der Lieferkette.
Siehe auch
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k l m n Eintrag zu Hydrazin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Charles E. Mortimer: Chemie – Das Basiswissen der Chemie. Thieme 2003, ISBN 3-13-484308-0.
- ↑ CRC Handbook of Chemistry and Physics, Ed. D.R. Lide, CRC Press, Boca Raton, FL, 2005.
- ↑ a b Datenblatt Hydrazine, anhydrous bei Sigma-Aldrich, abgerufen am 12. Mai 2016 (PDF).
- ↑ Eintrag zu Hydrazin in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 302-01-2 bzw. Hydrazin), abgerufen am 2. November 2015.
- ↑ E. Fischer: Ueber aromatische Hydrazinverbindungen in B. dt. chem. Ges. 8 (1875) 589–594.
- ↑ T. Curtius: in B. dt. chem. Ges. 20 (1887) 1632.
- ↑ C. A. Lobry de Bruyn: in Recueil des travaux chimiques des Pays-Bas 13 (1894) 433.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 36 pdf.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- ↑ G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry, 2nd ed., Vol. 1, Academic Press 1963, S. 469–472.
- ↑ Hydrazin weist eine dynamische Viskosität von 0,9·10−3 Pa·s auf.
- ↑ Davis, D.D.; Wedlich, R.C.; Martin, N.B.: Transition Metal Catalysis of the Heterogeneous Decomposition of Hydrazine: Adiabatic Kinetics by Accelerating Rate Calorimetry in Thermochim. Acta 175 (1991) 175–188, doi:10.1016/0040-6031(91)80064-P.
- ↑ Eintrag zu Hydrazin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- ↑ Vierter Satz der Symphonie. In: Der Spiegel. Nr. 35/1989, 28. August 1989, S. 190–195 (online).
- ↑ 20N Monopropellant Hydrazine Thruster. ArianeGroup, abgerufen am 5. Februar 2020.
- ↑ Chemical Monopropellant Thruster Family. (PDF) In: Hydrazine Thrusters. Ariane Group, 2018, abgerufen am 22. Juni 2019 (englisch).
- ↑ Hilfe bei Flugunfällen. (PDF) General Flugsicherheit in der Bundeswehr, 2017, S. 5, abgerufen am 20. November 2022.
- ↑ Why is Hydrazine used to power the F-16's EPU? In: aviation.stackexchange.com. Abgerufen am 21. März 2022.
- ↑ RESUS - Rescue Systems for Submarines. In: Orbital Propulsion Centre, Lampoldshausen, Germany > Submarine Recovery and Rescue Systems. ArianeGroup GmbH, Taufkirchen, abgerufen am 22. Juni 2019 (englisch).
- ↑ K. Hancke, S. Wilhelm: Wasseraufbereitung: Chemie und chemische Verfahrenstechnik. Springer, 2003, ISBN 3-540-06848-1, S. 249.
- ↑ F. Zymalkokowski: Katalytische Hydrierung, Ferdinand Enke Verlag, Stuttgart 1965.
- ↑ Byron Harris: NASA says object found in East Texas lake is from doomed shuttle. WFAA.com, 2. August 2011, archiviert vom (nicht mehr online verfügbar) am 10. März 2016; abgerufen am 10. März 2016 (englisch).
- ↑ Christina Knorz: Hydrazinvergiftung kann zu Nierenschäden führen: F-16-Absturz – Die Retter sollen zum Arzt - Nordbayerischer Kurier. In: Kurier – Verlagsgruppe Hof, Coburg, Suhl Bayreuth. 1. Oktober 2015, abgerufen am 22. August 2025.
- ↑ Bernd Wientjes: Absturzstelle gesperrt: Nach Kampfjet-Absturz in der Eifel wird das Trinkwasser untersucht. In: Trierischer Volksfreund. 9. Oktober 2019, abgerufen am 22. August 2025.
- ↑ Drucksache 19/16190 – Schriftliche Fragen mit den in der Woche vom 16. Dezember 2019 eingegangenen Antworten der Bundesregierung. (pdf) Deutscher Bundestag, 20. Dezember 2019, S. 73, abgerufen am 22. August 2025.
- ↑ BAuA: Technische Regel für Gefahrstoffe 608. 13. November 2001, abgerufen am 5. Januar 2013.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor/Urheber: Braveheart, Lizenz: CC BY 4.0
Eine Puch MS 25 mit einer Hydrazin-Luft-Brennstoffzelle im Technischen Museum in Wien. Entwickelt von Karl Kordesch.
Hydrazinstruktur
KENNEDY SPACE CENTER, FLA. - A suited worker at Astrotech Space Operations in Titusville, Fla., looks over the fuel supply to be loaded in the MESSENGER (Mercury Surface, Space Environment, Geochemistry and Ranging) spacecraft. Liftoff of MESSENGER aboard a Boeing Delta II Heavy rocket, bound for Mercury, is scheduled for Aug. 2. The spacecraft is expected to reach orbit around the planet in March 2011. MESSENGER was built for NASA by the Johns Hopkins University Applied Physics Laboratory in Laurel, Md.












