HIV
| Humanes Immundefizienz-Virus 1, 2 | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 HI-Viren im TEM | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Human immunodeficiency virus 1, 2 | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| HIV-1, HIV-2 | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
Mit Humanes Immundefizienz-Virus (wissenschaftlich Human immunodeficiency virus), zumeist abgekürzt als HIV (auch HI-Virus) oder auch Humanes Immundefizienz-Virus bzw. Menschliches Immunschwäche-Virus werden zwei Spezies (Arten) behüllter Viren aus der Gattung der Lentiviren in der Familie der Retroviren bezeichnet. Eine unbehandelte HIV-Infektion führt nach einer unterschiedlich langen, meist mehrjährigen symptomfreien Latenzphase in der Regel zu AIDS (englisch acquired immunodeficiency syndrome‚ 'erworbenes Immundefizienzsyndrom').
Die Verbreitung von HIV hat sich seit Anfang der 1980er Jahre zu einer Pandemie entwickelt, die nach Schätzungen des Gemeinsamen Programms der Vereinten Nationen für HIV/Aids (UNAIDS) bisher mindestens ca. 42 Millionen Menschenleben gefordert hat.[2]
Ende 2023 waren geschätzt 40 Millionen Menschen weltweit mit HIV infiziert, bei etwa gleichmäßiger Verteilung auf beide Geschlechter.[2] In Deutschland lebten Ende 2023 96.700 Menschen mit einer HIV-Infektion,[3] in Österreich 2020 etwa 9.000 infizierte Menschen[4] und in der Schweiz 2021 etwa 17.000 HIV-Infizierte[5].
Struktur und Aufbau des HI-Virus

Das Viruspartikel (Virion) hat einen Durchmesser von etwa 100 bis 120 Nanometer und ist damit für ein Virus überdurchschnittlich groß, jedoch deutlich kleiner als zum Beispiel Erythrozyten (Durchmesser 7500 Nanometer). Umgeben ist das HIV von einer Lipiddoppelschicht, die bei der Knospung von der menschlichen Wirtszelle abgetrennt wurde.[6] Dementsprechend befinden sich verschiedene Membranproteine der Wirtszelle in der Virushülle, beispielsweise HLA-Klasse-I- und -II-Moleküle sowie Zelladhäsionsmoleküle.
Ebenfalls eingebettet in diese Hülle sind pro Virion etwa 12 bis 16 sogenannte Spikes (dt. ‚Dornen‘), ca. zehn Nanometer große virale Glykoproteinkomplexe (envelope, Env); die Dichte der Spikes ist somit recht niedrig, hätten doch 73 ± 25 dieser Fortsätze auf der Oberfläche eines HIV-Partikels Platz. Ein HIV-Spike ist ein Heterodimer und besteht daher aus zwei Untereinheiten: Je drei Moleküle des externen Oberflächen-(englisch surface)-Glykoproteins gp120 sind nicht-kovalent an drei Moleküle des transmembranen Hüll-(englisch envelope)-Glykoproteins gp41 gebunden.[7][8][9] Die Bezeichnungen spiegeln deren Molekülmasse in Kilodalton wider.[6] Gp120 ist für die Bindung des Virus an die CD4-Rezeptoren der Zielzellen von entscheidender Bedeutung.

Mit der Innenseite der Membran sind die durch gag codierten Matrixproteine p17 assoziiert. Im Inneren des Virions findet sich das Viruskapsid, das aus den durch gag codierten Kapsidproteinen p24 aufgebaut ist, deren Struktur schrittweise 1996[10] und 1997[11] aufgeklärt wurde. Das Kapsid besteht aus etwa 1500 Kapsidproteinen und nimmt dabei eine Fulleren-ähnliche, konische Struktur ein, dieses Strukturmodell wurde erstmals 1999 vorgeschlagen.[12] 2013 wurde mittels Kryoelektronenmikroskopie die dreidimensionale Struktur mit einer Auflösung von 8 Å abgebildet.[13] p24 formen mit etwa 250 Hexameren und genau 12 Pentameren das Kapsid.[14][15]
Im Kapsid findet sich, an die durch gag codierten Nukleokapsidproteine assoziiert, das virale Genom (9,2 kb) in Form zweier Kopien der einzelsträngigen RNA. Die Nukleokapsidproteine haben die Aufgabe, die RNA nach Eindringen in die Wirtszelle vor Degradierung zu schützen. Ebenso befinden sich im Kapsid die Enzyme reverse Transkriptase (RT), Integrase sowie einige der akzessorischen Proteine. Die Protease ist maßgeblich beteiligt an der Partikelbildung und findet sich daher im gesamten Viruspartikel. Das Kapsidprotein p24 kann als Antigen in HIV-Tests der vierten Generation nachgewiesen werden.
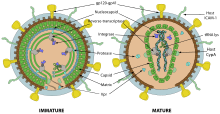
Das HIV gehört zu den komplexen Retroviren, das heißt, die Viren besitzen neben den kanonischen retroviralen Genen gag (gruppenspezifisches Antigen), pol (Polymerase) und env (envelope) weitere Leseraster, namentlich tat und rev (für regulatorische Prozesse) sowie vif, vpu, vpr und nef (für akzessorische Prozesse).[6] Durch die teils überlappenden, offenen Leseraster können trotz der geringen Genomgröße (ca. 9.700 bp)[16] neun verschiedene Proteine kodiert werden.[6] Sogenannte LTR-Regionen (Long Terminal Repeat) befinden sich am 5'- und 3'-Ende, die u. a. die Transkription und Integration ins Wirtsgenom regulieren.
Das gag-Gen kodiert für die Strukturproteine p24, p17, p7 und p6, env für die Oberflächenproteine gp120 und gp41. Die Reverse Transkriptase, die HIV-Protease sowie die Integrase finden ihren Ursprung in pol.
Für die regulatorische Prozesse ist tat für die Initiierung der Transkription und rev neben der Bindung an das HIV Rev Response Element des Genoms (RRE) am Export viraler mRNA aus dem Zellkern in das Cytoplasma beteiligt.[6]
Die Expression verschiedene Rezeptoren und Antigene (zum Beispiel CD4, CD8, CD28, CD3, SERINC3/5, Tetherin und HLA-Klasse-I-Antigene) wird bei HIV-infizierten Zellen mittels nef herunterreguliert. Dies hat zur Folge, dass das Immunsystem solche Zellen schlechter erkennen und damit bekämpfen kann. Außerdem erhöht es die Replikationsrate von HIV in diesen befallenen Zellen, was die Infektiosität steigert.
Die antivirale Aktivität von APOBEC3G wird durch vif beeinträchtigt; APOBEC3G verursacht Mutationen in der viralen RNA und schädigt diese, es handelt sich um ein Element des Immunsystems zur Abwehr von Retrovirus-Infektionen. Vpr vermittelt den Transport des viralen Genoms in den Zellkern. Tetherin wird schließlich durch vpu gehemmt, infolgedessen werden gereifte Viren besser freigesetzt. Außerdem baut vpu CD4-gp120-Komplexe ab, wodurch env-Proteine freigesetzt werden, welche für Virionen benötigt werden.[6]
HIV-1 und HIV-2 haben eine RNA-Identität von 50 %.[6]
Geschichte
HIV ist die vom International Committee on Taxonomy of Viruses (ICTV) 1986 empfohlene Bezeichnung. Es ersetzt die ehemaligen Benennungen wie Lymphadenopathie-assoziiertes Virus (LAV), humanes T-Zell-Leukämie-Virus III (HTLV-III) oder AIDS-assoziiertes Retrovirus (ARV).[17]



HIV Typ 1 wurde 1983 zum ersten Mal von Luc Montagnier, Françoise Barré-Sinoussi und Mitarbeitern vom Institut Pasteur in Paris beschrieben[18] und bereits im Juni 1983 behandelte der Spiegel in seiner Titelgeschichte HIV („Die tödliche Seuche Aids“).
In derselben Ausgabe des Journals Science veröffentlichte Robert Gallo, der Leiter des Tumorvirus-Labors am NIH in Bethesda, ebenfalls die Entdeckung eines Virus, das seiner Meinung nach AIDS auslösen könnte.[19] Er beschrieb in dieser Veröffentlichung jedoch die Isolierung von Humanen T-Zell-Leukämie-Viren Typ I (HTLV-1; kurze Zeit später auch von HTLV-2) bei AIDS-Patienten, die in seinen Proben zufällig neben dem HI-Virus vorlagen, und isolierte erst etwa ein Jahr später auch das HI-Virus. In einer Pressekonferenz mit der damaligen Gesundheitsministerin der Vereinigten Staaten, Margaret Heckler, gab er am 23. April 1984 öffentlich bekannt, dass AIDS durch ein Virus ausgelöst werde, das er entdeckt habe.[20]
Sowohl Montagnier als auch Gallo beanspruchten jeweils die Erstentdeckung für sich. Daraufhin folgte ein jahrelanger Rechtsstreit, bei dem es auch um das Patent für den neu entwickelten HIV-Test ging. 1986 wurde HIV-2 entdeckt.
Die beiden Forscher Barré-Sinoussi und Montagnier wurden 2008 für die Entdeckung des HI-Virus mit dem Nobelpreis für Medizin ausgezeichnet.[21] Die Tatsache, dass Gallo dabei nicht berücksichtigt wurde, stieß zum Teil auf Kritik in der Virologen-Gemeinde.[22][23][24]
Im Mai 2005 gelang einem internationalen Forscherteam erstmals der Nachweis, dass der Ursprung von HIV beim Affen liegt. Das Forscherteam nahm dazu in der Wildnis des zentralafrikanischen Kamerun 446 Kotproben freilebender Schimpansen. Etliche Proben wiesen Antikörper gegen Simianes Immundefizienz-Virus (kurz SIV; englisch Simian Immunodeficiency Virus) auf, die Schimpansenversion des HI-Virus, wie das Team im US-Fachjournal Science veröffentlichte. Zwölf Proben waren fast identisch mit dem HIV-1 bei Menschen. Das Team betonte, dass die Antikörper zuvor nur bei Schimpansen in Gefangenschaft nachgewiesen wurden. Ursprüngliche Quelle des HI-Virus sind die Schimpansen jedoch nicht. Sie sollen sich im westlichen Zentralafrika mit SIV oder einem Vorläufer dieses Virus bei anderen Affenarten infiziert haben. Etwa zu Beginn des 20. Jahrhunderts infizierten sich erstmals Menschen mit dem SIV, das anschließend in deren Organismen zum AIDS verursachenden HIV mutierte. Damit hat das Virus bereits mindestens zweimal die Artengrenze übersprungen, nämlich vom Affen zum Menschenaffen und anschließend zum Menschen. Wie das Virus auf den Menschen übertragen wurde, ist unklar. Man geht davon aus, dass Jäger, die Affen gejagt und verspeist haben, mit dem Virus erstmals infiziert wurden, etwa durch kleinere offene Wunden.[25][26]
Eine andere These war, dass ein Impfstoff gegen Poliomyelitis (Kinderlähmung) im Jahre 1959 durch Affen, die das Virus trugen, verunreinigt worden sei (siehe auch Kontroverse um die Entstehung von AIDS). Nach dieser These wurden im ehemaligen Belgisch-Kongo Schimpansennieren zur Vermehrung des Impfstoffes verwendet und anschließend hunderttausende Menschen durch eine Schluckimpfung geimpft, wodurch SIV auf den Menschen übertragen worden und zum HIV mutiert sei.[27][28][29] Allerdings zeigte eine Analyse der Mutationen, dass mit 95-prozentiger Wahrscheinlichkeit der Ursprung des Stammes HIV-1 vor das Jahr 1930 zu datieren ist.[30] Im Februar 2000 wurde eine Probe der verteilten Schluckimpfungen gefunden und untersucht. Darin zeigten sich weder Spuren von HIV noch von SIV.[31]
Der älteste Infizierte, dessen HIV-Infektion anhand von Blutproben gesichert nachgewiesen wurde, stammt aus Belgisch-Kongo und aus dem Jahr 1959.[32][33] In der Erstveröffentlichung zu dieser Serumprobe wurde allerdings angegeben, dass die Herkunft der Probe nicht sicher geklärt sei,[34] so ist es auch möglich, dass sich im damaligen Französisch-Äquatorialafrika erstmals ein Mensch infizierte.[25] Eine fast gleich alte DNA-Paraffin-Probe aus dem Jahre 1960, die ebenfalls aus Belgisch-Kongo stammt, unterscheidet sich genetisch deutlich von der ersten Probe, was darauf hindeutet, dass HIV schon lange vor 1960 in Afrika präsent war.[35] Mittels statistischer Analysen (sogenannte molekulare Uhr) lässt sich das Zeitfenster für das Erstauftreten mit hoher Wahrscheinlichkeit auf die Jahre zwischen 1902 und 1921 eingrenzen.[36][35] In der Zeit wurden die afrikanischen Ureinwohner, die u. a. als Arbeiter und Träger für Rohstoffe dienten, von den belgischen Kolonialherren im Kongo gegen die Schlafkrankheit behandelt. Dazu wurden nicht desinfizierte und daher mit HIV infizierte Spritzen für mehrere Personen verwendet. Darüber hinaus kamen zu eher schlechten medizinischen und hygienischen Verhältnissen neu eingeschleppte Krankheiten (u. a. Syphilis aus Europa), welche die Bevölkerung zusätzlich schwächten und anfällig machten. Die Trägerkolonnen könnten zudem dazu beigetragen haben, den HI-Virus aus dem Landesinneren an die Küste zu bringen, sodass er von dort weiter verbreitet werden konnte.[25]
Wann HIV erstmals in den USA, also am Ausgangspunkt der AIDS-Pandemie auftrat, ist seit langem Forschungsgegenstand mit unterschiedlichen, teilweise kontroversen Resultaten. Bereits 1968 wurden an dem Patienten Robert Rayford AIDS-ähnliche Symptome beobachtet und später als HIV identifiziert. Es konnte jedoch nicht eindeutig nachgewiesen werden, dass es sich dabei um das heute zirkulierende HIV handelte.[37][38] Einer aktuellen Arbeit von 2016 zufolge soll das Virus (HIV-1 Subtyp B) geschätzt 1967 von Afrika nach Haiti und von dort aus etwa um 1971 in die USA gelangt sein, wobei nachgewiesen wurde, dass der lange Zeit für Patient Zero gehaltene Gaëtan Dugas nicht der erste infizierte Mensch in Nordamerika gewesen sein kann.[39] Die Angaben beziehen sich auf phylogenetische Extrapolationen. Die frühesten serologischen Nachweise finden sich in Proben aus San Francisco[40] und New York City,[41] jeweils ab dem Jahr 1978.
Die als Verschwörungstheorie eingestufte These einer Verursachung der AIDS-Pandemie durch einen US-amerikanischen Laborunfall wurde im Zuge der Operation Infektion durch den KGB kreiert. Jakob Segal entwickelte in den 1980er Jahren in Berlin eine Hypothese mit mutmaßlich wissenschaftlichem Hintergrund, die ebenfalls von einem Laborunfall in Fort Detrick als Auslöser der AIDS-Pandemie ausgeht, jedoch abweichend von den Darstellungen des KGB die gentechnische Rekombination aus einem Visna-Virus und HTLV-I als künstlichen Ursprung von HIV-1 annimmt.
Einteilung und Systematik

Es sind bisher zwei verschiedene Arten von HI-Viren bekannt, die als HIV-1 und HIV-2 bezeichnet werden. Die Homologie zwischen HIV-1 und HIV-2 beträgt auf Aminosäuresequenzebene nur etwa 45 bis 50 Prozent. Hierbei sind etwa 95 % der Infektionen auf HIV-1 zurückzuführen.[42] HIV-1 und HIV-2 können weiter in Gruppen unterteilt werden, die teilweise mit unterschiedlicher Häufigkeit in verschiedenen Regionen der Welt auftreten.
So ist HIV-1 in vier Gruppen unterteilt, die mit M, N, O und P bezeichnet werden.[43][42]
- M steht für engl. major group ‚Hauptgruppe‘ und ist am häufigsten verbreitet. Sie wird ferner in verschiedene Subtypen unterteilt, die mit A, B, C, D, F, G, H, J, K und L[44] bezeichnet werden. Etwa 70 % der HIV-1-Infektionen geht auf die Subtypen A, B und C zurück; Subtyp B kommt vor allem in Nordamerika und Europa vor, A in Osteuropa und C hauptsächlich in Südafrika und Asien. In Mitteleuropa wie Deutschland ist der Subtyp B aus der Gruppe M von HIV-1 am häufigsten, besonders unter MSM und injizierenden Drogenkonsumenten.
- Die O-Gruppe wurde nach outlier ‚Sonderfall‘ benannt. Infektionen sind weitestgehend auf Westafrika (Kamerun) beschränkt.[43] Sie stammt ursprünglich aus Gorillas (SIVgor).[45]
- N der Gruppe N steht für „non-M“ und „non-O“ und bislang nur bei einigen wenigen Menschen nachgewiesen.[45]
- Ferner wurde Gruppe P eingeführt, es wurde ebenfalls in sehr wenigen Menschen nachgewiesen.[46]
Eine Koinfektion mit verschiedenen Subtypen kann dazu führen, dass zirkulierende rekombinante Formen entstehen, die circulating recombinant forms (CRFs) genannt werden.[46][47] Die Reihenfolge der Entdeckung wird durch eine sequenzielle Nummer kenntlich gemacht, die enthaltenen Subtypen durch entsprechende Buchstaben. So ist zum Beispiel CRF01_AB die erste identifizierte CRF (01) mit der Rekombination der Subtypen A und B. Falls mehr als zwei Subtypen präsent sind, wird dies durch cpx (complex) kenntlich gemacht, z. B. CRF06_cpx – sie enthält die Subtypen A, G, J und K. Es wurden über 100 CRFs identifiziert.[48] Die Klassifikation der HIV-Stämme ist entsprechend komplex und noch nicht abgeschlossen.
HIV-1, das insgesamt häufiger ist, und HIV-2 ähneln sich prinzipiell hinsichtlich des klinischen Infektionsverlaufs und der krankmachenden (pathogenen) Eigenschaften, auch wenn die Infektion mit HIV-2 wohl insgesamt langsamer verläuft. Die beiden Stämme sehen unter dem Elektronenmikroskop gleich aus, unterscheiden sich jedoch in der molaren Masse der Proteine und in der Anordnung und Nukleotidsequenz der Gene. HIV-1 und HIV-2 entstanden aus unterschiedlichen Typen der bei bestimmten Affenarten vorkommenden SI-Viren. HIV-2 wurde überwiegend in Westafrika nachgewiesen.[43]
HIV-1 wurde ursprünglich von SIV-infizierten Schimpansen und Gorillas auf den Menschen übertragen. So konnte für die Gruppen M und N nachgewiesen werden, dass sie aus Schimpansen stammen, während HIV-1 P von Gorillas auf den Menschen übertragen wurde.[49] Alle vier HIV-1-Gruppen (M, N, O und P) sind auf vier unabhängige Zoonosen (d. h. Tier-zu-Mensch-Übertragungen) zurückzuführen, wobei bislang nur die Gruppe M die Ausmaße einer Pandemie angenommen hat.[50][51] Der Grund für die höhere Infektiosität des HIV-1-M-Stammes beruht unter anderem auf spezifischen Eigenschaften des Virusproteins vpu der M-Gruppe, mit deren Hilfe gleich zwei Infektionsbarrieren überwunden werden: Zum einen wird der antivirale Faktor Tetherin auf humanen Zellen effektiv ausgeschaltet und zum anderen wird der CD4-Rezeptor abgebaut.[50][52][53]
Epidemiologie
Weltweit
Die weltweite HIV-Prävalenz (Krankheitshäufigkeit) bei Erwachsenen im Alter von 15 bis 49 Jahren lag 2010 bei 0,8 Prozent. Für Zentral- und Westeuropa lag sie bei 0,2 Prozent. Im subsaharischen Afrika (5,0 Prozent) und in der Karibik (0,9 Prozent) war sie überdurchschnittlich hoch. In einzelnen Staaten, wie zum Beispiel Eswatini, Botswana oder Lesotho sind etwa ein Viertel der 15- bis 49-Jährigen mit dem HI-Virus infiziert. Stark unterdurchschnittlich war die HIV-Prävalenz im Jahr 2010 in den Regionen Ostasien (0,1 Prozent) sowie in Nordafrika und dem Mittleren Osten (0,2 Prozent).[54] In Russland hat sich die Zahl der HIV-Infizierten von 2007 bis 2012 verdoppelt, rund 1,2 Millionen Russen sind mit dem Virus infiziert.[55] Dies entspricht in etwa einem Prozent der Einwohner.[56] Weltweit wird die Anzahl infizierter HIV-Patienten auf knapp 40 Millionen für 2023 geschätzt.[2]
Die Zahl der AIDS-Toten ist seit 2005 rückläufig: 2005 starben etwa zwei Millionen Menschen weltweit an den Folgen einer HIV-Infektion, im Jahr 2023 ungefähr 630.000 Menschen.[2] Die Zahl der bekannten Neuinfektionen sinkt seit 1997 stetig und lag 2023 bei 1,3 Millionen Menschen. Gleichzeitig nimmt die Anzahl der Personen unter Therapie zu, sie lag 2023 bei etwa 31 Millionen.
In Deutschland
Nach Daten des Robert Koch-Instituts erlagen bis Ende 2023 insgesamt etwa 33.900 Menschen in Deutschland den Folgen der Immunschwäche.[3] Im Jahr 2023 waren geschätzt 96.700 Menschen in Deutschland (ca. ein Mensch auf 1000) mit HIV infiziert. Hierbei machen HIV-2-Infektionen 5 ‰ aller Neudiagnosen aus.[43]
Von den etwa 2200 Neuinfizierten im Jahr 2023 waren nach Schätzungen des RKI etwa 77 % Männer, hiervon 55 % Männer, die Sex mit Männern haben. Etwa 28 % der Übertragungen kamen durch heterosexuellen Geschlechtsverkehr zustande, 17 % der Infektionen durch infizierte Spritzen bei intravenösem Drogenkonsum und weniger als 1 % Übertragungen von der Mutter auf das Kind während der Schwangerschaft und der Geburt. Die Zahl der bisher noch nicht diagnostizierten HIV-Positiven in Deutschland beträgt laut Schätzungen etwa 8.200.[3] Das Infektionsrisiko für Männer, die Sex mit Männern haben, ist damit signifikant höher, als bei ungeschütztem Geschlechtsverkehr bei heterosexuellen Paaren.
Eine antiretrovirale Therapie erhielten 2023 geschätzte 87.200 Menschen mit bekannter HIV-Infektion, was einer Therapieabdeckung von 99 % bedeutet. Davon war bei 96 % die Therapie so erfolgreich, dass sie nicht infektiös waren.[3]
In Folge der COVID-19-Pandemie in Deutschland und der damit einhergehenden Hygienemaßnahmen lag die Zahl der in den Kalenderwochen 10 bis 32 registrierten Neuinfektionen im Jahr 2020 im Mittel rund 22 Prozent unter den Werten der Vorjahre.[57]
Übertragung
| Infektionsweg | Risiko pro 10.000 Kontakten mit infektiöser Quelle | In Prozent |
|---|---|---|
| Parenteral | ||
| Bluttransfusion | 9.250 | 92,50 % |
| Drogeninjektion mit gebrauchter Nadel | 63 | 0,63 % |
| Nadelstich durch die Haut | 23 | 0,23 % |
| Sexuell (ungeschützter Verkehr) | ||
| Analverkehr, empfangender Partner | 138 | 1,38 % |
| Vaginalverkehr, empfangender Partner | 8 | 0,08 % |
| Analverkehr, einführender Partner | 11 | 0,11 % |
| Vaginalverkehr, einführender Partner | 4 | 0,04 % |
| Oralverkehr | gering1 | - |
| 1 Fälle von HIV-Übertragung durch Oralsex wurden wissenschaftlich dokumentiert, sind jedoch selten. Eine präzise Schätzung des Risikos ist aufgrund der schlechten Datenlage nicht verfügbar. | ||
Das HI-Virus wird durch Kontakt mit den Körperflüssigkeiten Blut, Sperma, Vaginalsekret sowie Muttermilch und Liquor cerebrospinalis übertragen. Potenzielle Eintrittspforten sind frische, noch blutende Wunden und Schleimhäute (vor allem Bindehaut, Vaginal-[59] und Analschleimhaut) bzw. nicht ausreichend verhornte, leicht verletzliche Stellen der Außenhaut (Eichel, Innenseite der Penisvorhaut, Anus). Der häufigste Infektionsweg ist Anal- oder Vaginalverkehr ohne Verwendung von Kondomen. Die Benutzung kontaminierter Spritzen beim intravenösen Drogenkonsum stellt einen weiteren gängigen Infektionsweg dar. Oralverkehr gilt als weit weniger infektiös, da die gesunde Mundschleimhaut sehr viel widerstandsfähiger ist als andere Schleimhäute.[60] Eine Ansteckung ist bei Oralverkehr nur dann möglich, wenn Sperma oder Menstruationsblut auf die Mundschleimhaut gelangt. Bei der Aufnahme von Scheidenflüssigkeit ohne Blut reicht die Virenmenge für eine Ansteckung nicht aus. Auch die orale Aufnahme von Präejakulat stellt bei intakter Mundschleimhaut kein Risiko dar.[61] Homosexuelle Männer gelten als Risikogruppe, da Analverkehr, welcher ein deutlich höheres Infektionsrisiko als Vaginalverkehr birgt, bei ihnen stärker verbreitet ist als in der Gruppe der Heterosexuellen. Wie hoch das Risiko beim Geschlechtsverkehr ist, hängt vor allem von der Viruskonzentration (Viruslast) in der übertragenden Körperflüssigkeit (zum Beispiel Blut, Samenflüssigkeit oder Scheidensekret) ab. Die Viruslast ist in den ersten Wochen nach der Infektion, bevor sich ausreichend Antikörper gebildet haben, besonders hoch, nimmt dann aber zunächst ab und steigt in späten Stadien der Erkrankung wieder an.[62]
Das Infektionsrisiko beim ungeschützten, heterosexuellen Geschlechtsverkehr mit HIV-infizierten Partnern für beschnittene Männer ist vermutlich etwas geringer als bei unbeschnittenen Männern.[63] Bei MSM wird ein möglicher protektiver Effekt dagegen als wahrscheinlich niedrig angesehen. Aufgrund der Ergebnisse von verschiedener Studien empfahl die Weltgesundheitsorganisation (WHO) 2007 ihren Mitgliedsländern die Beschneidung als zusätzliche Präventivmaßnahme zur Eindämmung von HIV/AIDS, wofür sie allerdings von Experten kritisiert wurde. Eine Befürchtung ist, dass sich beschnittene Männer in einer trügerischen Sicherheit wähnen und ein höheres Risiko eingehen, da sie auf Safer-Sex-Maßnahmen verzichten.[64] Außerdem hat die Beschneidung keinen Einfluss auf das Erkrankungsrisiko der Partnerinnen.
Bluttransfusionen sind ebenfalls eine mögliche Infektionsquelle: Das Infektionsrisiko für den Empfänger bei einer Transfusion mit HIV-kontaminiertem Blut wird auf 90 % geschätzt.[65] So kam es Anfang der 1980er Jahre in vielen Ländern zu verschiedenen Blutskandalen. Diese Ansteckungsmöglichkeit hat heute in Deutschland wegen der 1985 eingeführten Routine-Untersuchungen auf HIV-Antikörper der Blutspender allerdings kaum noch Bedeutung.[66] Da zwischen der Ansteckung des Spenders und der Nachweisbarkeit von Antikörpern im HIV-Test in Einzelfällen bis zu drei Monate verstreichen können (diagnostische Lücke), werden seit Anfang 2002 zwingend alle deutschen Blutspenden auch mittels Polymerase-Kettenreaktion (PCR) auf die Anwesenheit des Virus getestet. Das Robert Koch-Institut schätzt das Risiko, sich in Deutschland bei einer Blutspende mit HIV zu infizieren, auf kleiner als 1:5 Millionen.[67]
Das Risiko der Infektion eines Kindes durch eine HIV-infizierte Mutter während der Schwangerschaft oder Geburt ohne antiretrovirale Therapie wird für Europa auf 15 bis 25 % geschätzt.[68] Eine Übertragung des Virus beim Stillen ist ebenfalls möglich.[69] Bei bekannter HIV-Infektion der Mutter kann das Risiko einer Übertragung auf das Kind durch die Gabe antiretroviraler Medikamente (an die Mutter vor und das Kind nach der Geburt), die Geburt durch Kaiserschnitt und den Verzicht auf das Stillen des Kindes auf unter ein Prozent vermindert werden.[43]
Die sogenannte CHAT-Survey-Studie[70] des schweizerischen Bundesamtes für Gesundheitswesen (BAG) – eine Nachbefragung von Menschen, die im Verlauf eines Jahres positive HIV-Tests erhielten – ergab, dass 49 % aller Neuinfizierten die Infektion von ihrem festen Sexualpartner erhielten; 38 % wurden von einem zwar bekannten, aber nicht festen Gelegenheitspartner infiziert. Zehn Prozent der neuinfizierten Personen wussten schon vorher, dass ihr Partner HIV-positiv ist. Hat sich jemand von seinem bereits infizierten Partner absichtlich anstecken lassen, spricht man vom sogenannten Pozzen. Nur 13 % der Heterosexuellen steckten sich bei anonymen sexuellen Begegnungen an. Bei Homosexuellen spielten die Infektionen durch feste Partner eine geringere Rolle – anonyme Sexualkontakte machten 26 % der Infektionen aus.[71]
Zungenküsse gelten nicht als HIV-Infektionsrisiko. Obwohl theoretisch die Möglichkeit einer Infektion denkbar erscheint, wenn blutende Wunden, beispielsweise Verletzungen des Zahnfleisches, im Mund vorhanden sind, gibt es weltweit keinen dokumentierten Fall dieses Übertragungsweges.[72]
Die HIV-Konzentration in Tränen, Schweiß und Speichel reicht für eine Ansteckung nicht aus. Des Weiteren wird HIV nicht durch Tröpfcheninfektion, über Nahrungsmittel, Speichel, Tränenflüssigkeit, Insektenstiche oder Trinkwasser übertragen.[73]
Menschen, die einer akuten Ansteckungsgefahr ausgesetzt waren, sollten möglichst bald (idealerweise innerhalb von Stunden) einen Arzt aufsuchen, um sich beraten zu lassen und gegebenenfalls eine postexpositionelle Prophylaxe (PEP) durchzuführen. Nach Ablauf von 48 bzw. 72 Stunden wird eine medikamentöse Postexpositionsprophylaxe nicht mehr als sinnvoll erachtet.
Hinsichtlich der Infektionswahrscheinlichkeiten, der Behandlungsindikationen und Therapie siehe ausführlich unter AIDS.
Vermehrungszyklus des HIV
Follikuläre T-Helferzellen als HIV-Reservoir
Zur Vermehrung benötigt das Virus Wirtszellen, die den CD4-Rezeptor auf der Oberfläche tragen.[74] Dies sind vor allem CD4-tragende T-Helferzellen (CD4+-Zellen). Als hauptsächliches Reservoir für die humanen Immundefizienz-Viren dienen die follikulären T-Helferzellen in den Lymphfollikeln des Körpers, die rund zwei Prozent der CD4+-Zellen ausmachen.[75][76] T-Helferzellen unterstützen andere Weiße Blutzellen bei immunbiologischen Prozessen, wie der Reifung der B-Lymphozyten zu Plasma- und Gedächtniszellen oder der Aktivierung zytotoxischer T-Lymphozyten und Makrophagen. Neben T-Lymphozyten besitzen auch Monozyten, Makrophagen und dendritische Zellen CD4-Rezeptoren. Latent infizierte, ruhende CD4+-T-Zellen (T-Gedächtniszellen) stellen langlebige Reservoire für HIV dar und sind der Grund, dass HIV trotz wirksamer antiretroviraler Medikamente bisher nicht eradiziert werden kann und es nach Absetzen der Therapie immer wieder zu Rezidiven kommt.[77][78][79]
Fusion mit der Wirtszelle

1. Das Oberflächenprotein gp120 bindet an die CD4-Rezeptoren.
2. Konformationsänderung in gp120 ermöglicht eine nachfolgende Interaktion mit CCR5.
3. Die distalen Spitzen von gp41 dringen in die Zellmembran ein.
4. Durch die Bindung kommt es zu einer Konformationsänderung im Transmembranprotein gp41 („Schnappfedermechanismus“). Dieser Prozess verschmilzt die virale und zelluläre Membranen miteinander.
Um mit der Zellmembran der Wirtszelle verschmelzen zu können, binden die Oberflächenproteine gp120 an die CD4-Rezeptoren. Durch die Bindung kommt es zu einer Konformationsänderung im Transmembranprotein gp41, ein Mechanismus, der einer „Schnappfeder“ oder einer „Mausefalle“ ähnelt.
Neben den CD4-Rezeptoren sind weitere Co-Rezeptoren an der Bindung des HI-Virus an weiße Blutzellen beteiligt:[80] Die Chemokin-Rezeptoren CCR5 an monozytären Zellen und CXCR4 an T-Zellen sind an der Bindung beteiligt.[81][82] Die unterschiedliche Ausprägung dieser Rezeptoren beeinflusst die Ansteckungswahrscheinlichkeit und den Verlauf der HIV-Infektion.[83] Moleküle, die die CCR5-Rezeptoren blockieren, gehören zur Wirkstoffgruppe der Entry-Inhibitoren, spielen in aktuellen HIV-Therapien jedoch eine untergeordnete Rolle.[84][85]
Ebenso sind Menschen, die homozygot die sogenannte Delta-32-Mutation des CCR5-Co-Rezeptor-Gens aufweisen, schwerer mit HIV infizierbar. Dies trifft auf etwa ein Prozent der Bevölkerung in Europa zu. In geringerem Maße trifft dies auch auf Mutationen des CCR2-Gens zu. Menschen mit HLA-B27/B57 (siehe Human Leukocyte Antigen) zeigen einen langsameren Verlauf der Erkrankung.
Transport zum Zellkern und Zerfall des Virus-Kapsids
Nach der Membranfusion gelangt das virale Kapsid in das Zytosol und wird entlang von Mikrotubuli in Richtung des Zellkerns transportiert[86] mittels des Motorproteins Dynein[87][88]. Während frühere Studien von einem Auflösen des Virus-Kapsids („uncaoting“) kurz nach dem Eintritt in das Zytosol ausgingen, wurde gezeigt, dass das Kapsid als ganzes die Kernpore passiert[89] und erst im Inneren des Zellkerns zerbricht und die Virus-Erbinformation im Zellkern freisetzt. Andernfalls werden durch Erkennung viraler Nukleinsäure durch zelluläre „Pattern Recognition Receptors“ diese Kapside eliminiert.[86] Der Durchmesser des Kernporenkanals beträgt 40 bis 60 nm. Würde das Virus-Kapsid wie andere Proteine erst durch eine klassische Transporter-Schicht (Importine) für den Transport durch die FG-Phase (Barriere, die den Kernporenkanal ausfüllt und blockiert) umhüllt werden, wäre es mit knapp 70 nm zu groß für die Passage.[90] 2024 wurde gezeigt, dass das Kapsid eine importinartigen Oberfläche aufweist.[91] Dadurch gleitet es direkt durch den Kanal ohne eine stattfindende zelltypische Selektion, wodurch es auch gemäß einer der Autoren, Dirk Görlich, zu einer neuen Klasse von molekularen Transportern gezählt werden kann.
Einbau des HI-Virus-Genoms in die Wirtszelle


Das HIV baut zur Vermehrung seine Erbsubstanz, die bei ihm in Form eines RNA-Genoms vorliegt, nach der sogenannten reversen Transkription in die doppelsträngige DNA des Genoms der Wirtszelle ein.[92] Die Umwandlung von viraler RNA in provirale DNA im Cytoplasma der Wirtszelle durch das Enzym Reverse Transkriptase ist ein entscheidender Schritt im Reproduktionszyklus der Retroviren; beim HI-Virus ist dieser Prozess extrem fehlerbehaftet, was zu einer wiederholten Mutation des Virus' führt, welche wiederum einen Hauptgrund für die schwierige Bekämpfung darstellt. Da die Reverse Transkriptase von Retro- und Hepadnaviren sich stark von anderen reversen Transkriptasen wie der humanen Telomerase unterscheidet, stellt sie ein wichtiges Ziel therapeutischer Intervention dar und ist Ansatzpunkt zweier pharmakologischer Wirkstoffklassen.
Nach reverser Transkription und Transport in den Zellkern schließt sich die Integration des Virus-Genoms in das menschliche Erbgut durch ein weiteres virales Enzym an, die Integrase.[93][94] Die virale DNA wird schon vor der Integration abgelesen, dabei werden auch bereits die viralen Proteine gebildet. Demnach liegt die HIV-DNA als integrierte und nicht-integrierte Form vor. Auch existieren zirkuläre Formen von HIV-DNA.
Das nun als integriertes Provirus vorliegende virale Genom zeigt einen charakteristischen Aufbau, wobei die codierenden Bereiche auf beiden Seiten von identischen regulatorischen Sequenzen, die im Verlauf der reversen Transkription generiert wurden, den sogenannten LTRs, flankiert sind. Der Promotor, unter dessen Kontrolle die Transkription der verschiedenen mRNAs erfolgt, liegt im Bereich des LTR und wird durch das virale Protein TAT aktiviert. Eine ungespleißte RNA dient als virales Genom für die nächste Generation von HI-Viren und als mRNA für die Translation eines Gag (Gruppenspezifisches Antigen) sowie mittels einer in einem von 20 Fällen vorkommenden Verschiebung des Leserasters eines Gag-Pro-Pol-Vorläuferproteins. Gespleißte RNAs codieren für das Hüllprotein Env sowie die ebenfalls im 3'-Bereich befindlichen weiteren Proteine. HIV codiert für 16 Proteine.[95]
Im weiteren Verlauf folgt die Morphogenese, das heißt, über verschiedene Interaktionen finden die viralen Bestandteile wie Gag-, Pro-pol- und Env-Vorläuferproteine sowie die RNA zusammen und formen sich zu zunächst unreifen Virionen, die sich von der Plasmamembran abschnüren. Durch weitere Reifungsprozesse entsteht das reife Viruspartikel, bereit für die Infektion der nächsten Zelle. Zu den Reifungsprozessen gehört insbesondere die Spaltung der Vorläuferproteine – teils durch die virale Protease, teils durch zelluläre Enzyme – in ihre einzelnen Bestandteile, also von Gag in Matrix-, Kapsid- und Nukleokapsidprotein, Pol in Protease, Reverse Transkriptase mit RNase H und Integrase sowie Env in Oberflächen- und Transmembraneinheit. Die neugebildeten Tochtervirionen verlassen die Zelle durch Knospung. Beim Zusammenbau wird das HIV mit dem zellulären Protein Cyclophilin A bedeckt.[96] Dabei bindet je ein Cyclophilin A an zwei Hexamere des Kapsidproteins, wodurch es das Kapsid stabilisiert und maskiert vor intrazellulären Mechanismen der angeborenen Immunantwort in Makrophagen und dendritischen Zellen.[96]
Das Virus in infizierten und ruhenden CD4+-T-Zellen entzieht sich dem Angriff seitens antiviraler Medikamente und des Immunsystems. Zu einer Aktivierung dieser „Immunzellen“ kommt es nach Antigenkontakt, zum Beispiel im Rahmen gewöhnlicher oder einer opportunistischen Infektion. Während die Zelle eigentlich gegen einen anderen Krankheitserreger vorgehen will, beginnt sie stattdessen Virusproteine zu produzieren und neue Viren freizusetzen. Diese infizieren dann wiederum andere Zellen.
Was das HI-Virus so außergewöhnlich überlebensfähig macht, ist seine Wandlungsfähigkeit oder, besser gesagt, seine hohe Mutationsrate. Von den Influenza-Viren (Grippe) zum Beispiel entwickeln sich in derselben Zeit auf der ganzen Welt nicht einmal halb so viele neue Varianten wie vom HI-Virus in einem einzelnen infizierten Menschen.
Verlauf der HIV-Infektion



Eine unbehandelte HIV-Infektion verläuft in der Regel in mehreren Stadien. Nach einer Inkubationszeit von etwa drei bis sechs Wochen kommt es nach der Ansteckung meist zu einer akuten HIV-Infektion. Diese ist durch Fieber, starken Nachtschweiß[97], Abgeschlagenheit, Hautausschläge, orale Ulzerationen oder Arthralgie (Gelenkschmerzen) gekennzeichnet. Wegen der Ähnlichkeit mit grippalen Infektionen bleibt die akute HIV-Infektion meistens unerkannt. Eine frühe Diagnose ist jedoch wichtig: Durch sie können nicht nur weitere Infektionen von Sexualpartnern verhindert werden. Erste Studien an Patienten, die während der akuten HIV-Infektion antiviral behandelt wurden und nach einiger Zeit die Therapie absetzten, zeigten, dass die HIV-spezifische Immunantwort der Patienten gestärkt werden konnte.[98][99] Die akute Infektion dauert selten mehr als vier Wochen an.
In der folgenden, meist mehrjährigen Latenzphase treten keine gravierenden körperlichen Symptome auf. Veränderte Blutwerte und eine schleichende Lipodystrophie bleiben von den HIV-Infizierten oftmals unbemerkt. Danach kommt es vielfach zu ersten Erkrankungen, die auf ein mittelschwer geschwächtes Immunsystem zurückzuführen sind, jedoch noch nicht als AIDS-definierend gelten (CDC Klassifikation B, siehe AIDS).
Neben den Symptomen durch die Schwächung des Immunsystems gibt es auch weitere Symptome, wie zum Beispiel Veränderungen in der Struktur des Herzmuskels.[100] Zur Strukturveränderung am Herzen kommt es vor allem dann, wenn es nicht gelingt, die Viruslast adäquat zu senken.
Zerstörung von CD4-Helferzellen
Im Verlauf einer HIV-Infektion werden unter anderem CD4+-Helferzellen kontinuierlich auf verschiedenen Wegen zerstört, was eine Schwächung des Immunsystems bewirkt. Zum einen können infizierte Wirtszellen auf direktem Wege eliminiert werden. Dies geschieht entweder durch Membranschäden an der Zelle, welche durch Ein-/Austritte der Viren verursacht werden, oder durch proapoptotische Eiweiße der HI-Viren sowie zerstörerische Informationshybride aus RNA und DNA. Zum anderen findet eine indirekte Zerstörung infizierter Zellen statt, die durch gesunde Zellen des Immunsystems als gefährlich erkannt und von ihnen anschließend ausgeschaltet werden. Außerdem werden auch nichtinfizierte T-Helferzellen als Kollateralschäden durch einen Kontakt mit Proteinen wie p120 zerstört. Diese Proteine entstehen bei der Vermehrung des HI-Virus in der Blutbahn. Im Anschluss an eine akute HIV-Infektion und nach erfolgter virusspezifischer Immunantwort ist der Körper in der Regel über einige Jahre in der Lage, die Menge der zerstörten Zellen durch die Produktion neuer Zellen zum größten Teil zu ersetzen.
Ausbildung eines Immundefektes
Bleibt die HIV-Infektion unbehandelt, sinkt die Zahl der CD4+Helferzellen kontinuierlich ab, und es kommt im Median neun bis elf Jahre nach der Erstinfektion zu einem schweren Immundefekt (< 200 CD4+-Zellen/Mikroliter). Dieser führt in der Regel zu AIDS-definierenden Erkrankungen (CDC Klassifikation 3). Zu diesen zählen opportunistische Infektionen, die durch Viren, Bakterien, Pilze oder Parasiten bedingt sind. Aus diesem Grund gehören HIV-positive Menschen zu den Hochrisikopatienten für viele impfpräventable Infektionskrankheiten, wie Pneumonie (ausgelöst zum Beispiel durch Pneumokokken) oder Meningitis (ausgelöst zum Beispiel durch Meningokokken).[101] Hinzu kommen andere Erkrankungen, wie Kaposi-Sarkom, malignes Lymphom, HIV-Enzephalopathie und das Wasting-Syndrom. Nach individuell unterschiedlicher Zeit führen diese unbehandelt meist zum Tod. Ein schwerer Immundefekt bedeutet jedoch nicht, dass sofort AIDS auftritt. Je länger ein schwerer Immundefekt vorliegt, desto größer ist die Wahrscheinlichkeit, AIDS zu bekommen.
Genetische Faktoren und Resistenz
Die Tatsache, dass Individuen trotz gleicher Infektionsquelle oft sehr unterschiedliche Krankheitsverläufe haben, deutet auf einen starken Einfluss von Wirtsfaktoren auf den Verlauf der Infektion hin. Neben der Ausbildung der Immunantwort scheinen auch einige genetische Faktoren eine Rolle zu spielen. Verschiedene Gruppen erkranken nicht an AIDS, zum Beispiel die Long-term non-progressors (LTNPs, darunter auch die elite controllers bzw. elite suppressors) und die HIV-exposed seronegative (HESN).[102] Letztere wurden früher auch als highly exposed persistently seronegative (HEPS) bezeichnet. Die LTNP entwickeln für längere Zeit keine fortschreitende Erkrankung, HESN zeigen sogar weder klinische noch serologische Anzeichen einer HIV-Infektion.
Homozygote Individuen mit einem genetischen Defekt am CCR5-Rezeptor (CCR5Δ32) sind weitgehend resistent gegen HIV-Infektionen.[103][104]
Dieser Rezeptor dient als Korezeptor bei der Fusion des Virus mit der Wirtszelle. Es wurden nur wenige Individuen gefunden, die eine Infektion trotz dieses Rezeptordefektes haben. Sie infizierten sich mit HI-Viren, die andere Co-Rezeptoren benutzen, wie etwa den CXCR4-Rezeptor auf T-Zellen. Homozygote Genträger dieser Deletion machen etwa ein Prozent der Bevölkerung aus, heterozygote Genträger etwa 20 Prozent. Heterozygote haben zwar deutlich weniger CCR5-Rezeptoren, können sich aber auch mit HIV infizieren und scheinen nach einer Infektion kaum eine längere mittlere Überlebenszeit zu haben.
Abgesehen von Mutationen, die eine vollständige Resistenz gegen HIV verleihen, gibt es auch eine Reihe von Genotypen, die zwar nicht vor einer HIV-Infektion schützen, aber mit einem langsameren Voranschreiten der Krankheit und geringerer Viruslast assoziiert sind. Dabei sind zwei unterschiedliche Mechanismen identifiziert worden:
- Träger gewisser Allele der MHC-I-Proteine, insbesondere HLA-B*5705 und/oder HLA-B*2705, weisen gegenüber anderen Menschen ein langsameres Voranschreiten der Infektion auf. Da MHC-I-Proteine virale Proteine aus dem Zellinneren binden und so die Infektion einer Zelle anzeigen, wird davon ausgegangen, dass die genannten Varianten in der Lage sind, die Proteine des HIV besonders effizient zu binden. Daher werden HIV-infizierte T-Helferzellen in diesen Individuen besonders schnell von cytotoxischen T-Zellen erkannt und vernichtet.
- Nach einer HIV-Infektion beginnt das Immunsystem mit der Produktion von Antikörpern gegen HIV; aufgrund der hohen Mutationsrate des HIV bleiben diese aber weitgehend wirkungslos. Einige Menschen produzieren jedoch Antikörper, die sich gegen eine konstante Region des gp120 richten, was die Infektion verlangsamt. Warum diese Antikörper nur von gewissen Menschen produziert werden, ist unbekannt.[105]
Tests auf eine HIV-Infektion
Es gibt verschiedene Möglichkeiten, Blut, Sperma, Urin oder auch Gewebe auf eine mögliche Infektion mit HIV zu prüfen. Dabei kann das Virus entweder direkt durch die virale RNA bzw. das Antigen p24 (ein Protein des HIV-Kapsids) oder indirekt durch die vom Körper gebildeten Antikörper gegen HIV nachgewiesen werden.
Immunologische Testverfahren
Die umgangssprachlich oft fälschlich[106] als „Aidstest“ bezeichneten serologischen Testverfahren detektieren die vom Immunsystem des Menschen gebildeten Antikörper gegen das Virus. Moderne Suchtests der vierten Generation (HIV-1/2-Antikörper & p24-Antigen Kombi-Tests) erfassen zusätzlich das p24-Antigen des HIV-1-Virus. Da p24 bereits in der Frühphase der Infektion nachweisbar ist, wenn noch keine Antikörper gebildet worden sind, verkürzt sich dadurch das diagnostische Fenster und ermöglicht ein früheres aussagekräftiges Testergebnis. Ab dem 11. Tag der Infektion ist ein positives Ergebnis möglich. Ein negatives Ergebnis schließt eine Infektion nur sicher aus, wenn 6 Wochen vor dem Test keine Infektionsmöglichkeit bestanden hat. HIV Tests der dritten Generation, welche nur auf Antikörper Testen, können eine Infektion erst nach 3 Monaten mit Sicherheit ausschließen.[107]
Als Suchtests werden in den meisten Routinelaboratorien automatisierte Immunassays und nur noch vereinzelt der klassische ELISA-Test auf Mikrotiterplatten eingesetzt. Bei einem positiven oder grenzwertigen Ergebnis im Immunassay folgt als Bestätigungstest ein Immunoblot nach dem Western-Blot-Prinzip. Diese zwei Methoden werden stets nacheinander verwendet: Der Immunassay ist hochsensitiv und somit geeignet, falsch negative Resultate zu vermeiden. Die geringere Spezifität des Suchtests wird in Kauf genommen, um in dieser Stufe der Diagnostik keine positiven Proben zu übersehen. Der zur Bestätigung eingesetzte, spezifischere Immunoblot dient dem Ausschluss falsch positiver Resultate. Immunassays wie Western Blot sind günstige Tests und sie sind ca. drei Monate nach einer möglichen Infektion von hoher Genauigkeit, können aber nach einer vermuteten Ansteckung schon früher eingesetzt werden, denn die Zeit zur Bildung von HIV-Antikörpern beträgt durchschnittlich etwa 22 Tage.[108] Für ein abschließendes Testergebnis eines Immunassays empfehlen AIDS-Hilfe und das Robert Koch-Institut jedoch eine Wartezeit von zwölf Wochen. Dies gilt nicht für die Tests der vierten Generation, die zusätzlich zu den Antikörpern das p24-Antigen detektieren. Diese kombinierten Antikörper-Antigen-Suchtests liefern bereits nach sechs Wochen ein aussagekräftiges Ergebnis.[109][73]
Ein positives Ergebnis im Screeningtest allein ist kein sicherer Befund für eine HIV-Infektion, deshalb wird er immer zusammen mit Immunoblot angewendet. Kann ein positives Ergebnis im Immunassay mittels Immunoblot (der nur Antikörper nachweisen kann) nicht bestätigt werden, muss eine HIV-PCR zum direkten Erregernachweis durchgeführt werden, weil es sein kann, dass der Immunassay nur auf das p24-Antigen des Virus reagiert, während noch keine Antikörper vorhanden sind. Ist der Immunassay weder durch Blot noch durch PCR zu bestätigen, kann angenommen werden, dass der Immunassay „unspezifisch“ reagiert hat, d. h. durch eine andere Ursache als eine HIV-Infektion positiv wurde. Antikörpertests können in seltenen Fällen nach kurz zurückliegenden akuten Erkrankungen, Grippeimpfungen und Allergien falsch positive Befunde liefern.[110]
PCR
Der direkte Nachweis von viralen Nukleinsäuren (Ribonukleinsäure (RNA)) durch Polymerase-Kettenreaktion (PCR) ist das schnellste, jedoch auch das teuerste Verfahren, das schon 15 Tage nach einer Ansteckung verlässliche Resultate liefert. Abgesehen von der qualitativen PCR, wie sie zur Diagnose einer akuten HIV-Infektion und im Blutspendewesen verwendet wird, sind quantitative PCR-Verfahren ein wichtiges Werkzeug, um bei HIV-positiven Patienten die Viruslast (Anzahl der viralen RNAs pro Milliliter Blutplasma) zu bestimmen, um zum Beispiel den Erfolg der antiretroviralen Therapie zu überwachen.
Behandlung
Mit einer Antiretroviralen Therapie (ART), auch hochaktiven antiretroviralen Therapie (HAART), kann die Virusvermehrung im Körper verlangsamt und der Ausbruch einer AIDS-Erkrankung hinausgezögert werden. Ab 1996 kamen immer besser wirksame antiretrovirale Medikamente auf den Markt, die anfangs als Dreierkombination, später auch als Zweierkombination zur Behandlung einer HIV-1-Infektion eingesetzt wurden. Die Tablettenlast und die damit verbundene mehrfach tägliche Einnahme wurden erheblich reduziert, mittlerweile gibt es sogenannte Single-Tablet-Regimes, bei der in einer Tablette drei bzw. zwei Wirkstoffe kombiniert sind. Dies erleichtert die tägliche Einnahme.[111]
Durch die lebenslang notwendige Therapiestrategie kann AIDS fast vollständig verhindert werden. Ziel ist die Absenkung der Viruslast des zu behandelnden Patienten auf weniger als 50 Viruskopien pro Milliliter Blut; dies gilt als virologischer Therapieerfolg.[112] Fällt diese unter die Nachweisgrenze der verfügbaren Testverfahren von 20–50 Kopien/ml Blut, sind HIV-Infizierte nicht mehr infektiös bzw. die Ansteckungsfähigkeit wird praktisch aufgehoben d. h. N=N oder: nicht-nachweisbar = nicht übertragbar.[113][43]
Daher gilt die Behandlungsrichtlinie, jede diagnostizierte HIV-Infektion zeitnah antiretroviral zu behandeln.[112] 2023 standen in Deutschland etwa 87.200 von 88.500 HIV-positiv getesteten Personen unter einer ART (99 %)[3], weltweit etwa 30,7 Millionen.[2]
Prophylaxe
Um eine HIV-Infektion zu verhindern, wurde anfangs vor allem auf einen Schutz bei den drei üblichen Übertragungswegen Geschlechtsverkehr, Übertragung durch Blutprodukte und intravenöser Drogenkonsum gesetzt.
Für den Geschlechtsverkehr wird weiterhin „als Grundpfeiler“ der Prävention von HIV und anderen sexuell übertragbare Erkrankungen die Verwendung von Kondomen empfohlen, eingegangene Risiken sollten zeitnah durch einen Test abgeklärt werden.[3] Gelegentlich wird auch Enthaltsamkeit postuliert oder zumindest das Vermeiden von Hochrisikoverhalten.
In den 1980er Jahren bestand auch ein Problem in der HIV-Übertragung durch Blutprodukte wie Plasma- oder Bluttransfusionen; dies galt ebenso für die Übertragung von Virushepatitiden. Daher wurden jahrelang Männer, die Sex mit Männern haben, von Blut- und Plasmaspenden ausgeschlossen. Inzwischen erfolgen direkte Viruskontrollen, die das Übertragungsrisiko sehr stark reduziert haben.
In der Europäischen Union wurde 2016 ein Kombinationspräparat zweier moderner antiretroviraler Wirkstoffe (Emtricitabin und Tenofovir) unter dem Namen Truvada zugelassen, das ebenso wie Generika zur anlassbezogenen sporadischen Einnahme bei Nicht-Infizierten indiziert ist und die Ansteckungsgefahr bei Geschlechtsverkehr mit einem HIV-Infizierten (dessen Viruslast nicht sowieso bereits durch eine antiretrovirale Therapie reduziert ist) um weitere 92 % reduzieren kann. Seit dem 1. September 2019 übernehmen in Deutschland die gesetzlichen Krankenkassen die Kosten für diese Präexpositionsprophylaxe. Jedoch ist diese „PrEP“-Behandlung noch nicht ausreichend bekannt und laut Deutscher Aidshilfe „das Potenzial […] bei Weitem noch nicht erschöpft“, zumal in Deutschland geschätzte 10.600 Menschen mit HIV leben, bei denen diese Infektion nicht bekannt ist.[114]
Aktuell werden 2023 zur weiteren Unterbindung der Virusübertragung vor allem die folgenden Punkte von Robert Koch-Institut und Deutscher Aidshilfe genannt:[114][3]
- Steigerung der Bereitschaft zum HIV-Test mit niederschwelligen Angeboten und freiem Zugang für jeden („Ausweitung des Testangebots“)
- Vergabe sauberer Einmalspritzen und freier Zugang zu einer Drogen-Substitutionstherapie auch in Haftanstalten
- Zugang zur HIV-Therapie für alle Infizierten, auch für jene ohne gültige Aufenthaltspapiere und für HIV-positive Drogenkonsumenten, von denen 2016 nur 55 % eine antiretrovirale Therapie erhalten haben (entgegen 93 % aller HIV-Infizierten)
- Vermehrter Einsatz von PrEP und freier Zugang hierzu für alle
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis von HIV nichtnamentlich meldepflichtig nach § 7 Absatz 3 des Infektionsschutzgesetzes (IfSG).
In der Schweiz ist der positive laboranalytische Befund zum HI-Virus meldepflichtig, und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Impfempfehlungen
Während des Krankheitsverlaufes HIV-positiver Menschen nimmt mit der Anzahl an CD4+-T-Zellen im Blut auch die Abwehrleistung des Immunsystems ab.[101] Die Ständige Impfkommission (STIKO) am Robert Koch-Institut (RKI) kategorisiert Menschen mit HI-Virus-verursachter Immunschwäche deshalb als Risikogruppe für verschiedene opportunistische Infektionskrankheiten.[101][115] Immungeschwächte Personen erkranken nicht nur häufiger an solchen Infektionen als immungesunde Personen, sondern erleiden auch öfter schwere Verläufe.[115][116] Beispielsweise haben HIV-infizierte Personen einer amerikanischen Studie zufolge ein zehnmal höheres Risiko an einer invasiven Meningokokken-Infektion zu erkranken als die Allgemeinbevölkerung.[117]
Die STIKO rät Betroffenen, die altersentsprechenden Standardimpfungen zu vervollständigen und zu aktualisieren.[101][116] Zusätzlich gibt die STIKO in Zusammenarbeit mit verschiedenen medizinischen Fachgesellschaften eine Reihe von Anwendungshinweisen für Indikationsimpfungen bei HIV-Positiven: Insbesondere Totimpfstoffe gelten als gut verträglich für immungeschwächte Patienten, da hierbei in der Regel kein erhöhtes Risiko für unerwünschte Wirkungen besteht. Hierzu gehören zum Beispiel Impfstoffe gegen Influenza, Herpes Zoster, Meningokokken der Serogruppen ACWY und B sowie Pneumokokken. Lebendimpfstoffe, zum Beispiel gegen Mumps-Masern-Röteln, Varizellen oder Rotaviren, sind bei immundefizienten Patienten häufig kontraindiziert und sollten HIV-positiven Personen dagegen aufgrund möglicher Komplikationen nur nach individueller Risiko-Nutzen-Abschätzung des behandelnden Arztes gegeben werden.[101][115] Zu typischen Reiseimpfungen gehören oft Lebendimpfstoffe, zum Beispiel gegen Gelbfieber. In solchen Fällen empfiehlt sich die frühzeitige Kontaktaufnahme zu einem Reisemediziner.
Die Immunantwort auf eine Impfung fällt bei Erwachsenen mit HI-Virus-bedingter Immundefizienz teilweise schwächer aus oder hält kürzer an als bei immungesunden Personen. Für eine optimale Immunantwort sollten Impfungen deshalb möglichst vorgenommen werden, während das Immunsystem unter ART stabil gehalten wird. Zusätzlich bietet es sich an, die Immunantwort nach einer Impfung mit einer Blutanalyse zu überprüfen und gegebenenfalls mit einer Auffrischungsimpfung zu unterstützen.[101]
Als Infektionsprävention gegen Erkrankungen, deren Impfung für HIV-Positive nicht möglich ist, gilt außerdem der vollständige Impfschutz direkter Kontaktpersonen.[101][115]
Siehe auch
- Diskriminierung von Menschen mit HIV/AIDS
- HIV-Impfstoff
- HIV/AIDS in Afrika
Literatur
Leitlinien
- S2k-Leitlinie Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion der Deutschen AIDS-Gesellschaft e. V. (DAIG). In: AWMF online (Stand 2021)
- S2k-Leitlinie HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen der Deutschen AIDS-Gesellschaft e. V. (DAIG). In: AWMF online (Stand 2020)
Sonstiges
- Aids: »Eine Epidemie, die erst beginnt«. In: Der Spiegel 23/1983. 5. Juni 1983, abgerufen am 31. März 2022: „Die Homosexuellen-Seuche »Aids«, eine tödliche Abwehrschwäche, hat Europa erreicht. Mindestens 100 Deutsche sind bereits erkrankt, sechs in den letzten Wochen gestorben. Die Ärzte sind ratlos: Über die Ursache wird nur spekuliert, eine Behandlung gibt es nicht.“
- Christoph Benn, Sonja Weinreich: HIV und Aids. Eine Krankheit verändert die Welt. Lembeck, Frankfurt am Main 2009, ISBN 978-3-87476-586-2.
- Die wissenschaftliche Fachzeitschrift AIDS Reviews erscheint vierteljährlich und veröffentlicht Übersichtsarbeiten, die sich mit den verschiedenen Aspekten von HIV und AIDS beschäftigen.
Weblinks
Deutsch
- HIV (AIDS) – Informationen des Robert Koch-Instituts
- Detaillierte und aktuelle Informationen zum Thema HIV auf hivbuch.de
- DAGNÄ e. V. (Leitlinien und Stellungnahmen der Deutschen Arbeitsgemeinschaft niedergelassener Ärzte in der Versorgung HIV-Infizierter)
- HIV / Aids, Deutsche Aidshilfe
- Spektrum.de: Natürlich immun gegen HIV 1. Dezember 2022
Andere Sprachen
- HIV-Datenbank (englisch)
Audio
- 30 Jahre Entdeckung des HI-Virus In: Zeitblende von Schweizer Radio und Fernsehen vom 11. Mai 2013 (Audio)
Einzelnachweise
- ↑ a b c d ICTV: ICTV Taxonomy history: Commelina yellow mottle virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- ↑ a b c d e Fact Sheet 2024. (PDF) In: Gemeinsames Programm der Vereinten Nationen für HIV/Aids. 2024, abgerufen am 4. Januar 2025 (englisch).
- ↑ a b c d e f g HIV in Deutschland 2022 und 2023. (PDF) In: Epidemiologisches Bulletin 28 / 2024. RKI, 11. Juli 2024, abgerufen am 4. Januar 2025.
- ↑ HIV / AIDS in Österreich. (PDF) In: AIDS Hilfe Wien. März 2021, S. 1, abgerufen am 21. April 2023.
- ↑ Switzerland HIV and AIDS estimates (2021). UNAIDS, 2021, abgerufen am 21. April 2023 (englisch).
- ↑ a b c d e f g Henning Grüll, Philipp Schommers, Florian Klein: Pathophysiologie der HIV-Infektion. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 22–33 (hivbuch.de [PDF]).
- ↑ Ping Zhu et al.: Distribution and three-dimensional structure of AIDS virus envelope spikes. In: Nature. Band 441, Nr. 7095, 15. Juni 2006, S. 847–852, doi:10.1038/nature04817, PMID 16728975 (englisch).
- ↑ Kenneth H. Roux, Kenneth A. Taylor: AIDS virus envelope spike structure. In: Current Opinion in Structural Biology. Band 17, Nr. 2, April 2007, S. 244–252, doi:10.1016/j.sbi.2007.03.008, PMID 17395457 (englisch).
- ↑ Jun Liu et al.: Molecular architecture of native HIV-1 gp120 trimers. In: Nature. Band 455, Nr. 7209, 4. September 2008, S. 109–113, doi:10.1038/nature07159, PMID 18668044, PMC 2610422 (freier Volltext) – (englisch).
- ↑ Rossitza K. Gitti et al.: Structure of the amino-terminal core domain of the HIV-1 capsid protein. In: Science (New York, N.Y.). Band 273, Nr. 5272, 12. Juli 1996, S. 231–235, doi:10.1126/science.273.5272.231, PMID 8662505 (englisch).
- ↑ Theresa R. Gamble et al.: Structure of the carboxyl-terminal dimerization domain of the HIV-1 capsid protein. In: Science (New York, N.Y.). Band 278, Nr. 5339, 31. Oktober 1997, S. 849–853, doi:10.1126/science.278.5339.849, PMID 9346481 (englisch).
- ↑ Barbie K. Ganser et al.: Assembly and analysis of conical models for the HIV-1 core. In: Science (New York, N.Y.). Band 283, Nr. 5398, 1. Januar 1999, S. 80–83, doi:10.1126/science.283.5398.80, PMID 9872746 (englisch).
- ↑ Gongpu Zhao et al.: Mature HIV-1 capsid structure by cryo-electron microscopy and all-atom molecular dynamics. In: Nature. Band 497, Nr. 7451, 30. Mai 2013, S. 643–646, doi:10.1038/nature12162, PMID 23719463, PMC 3729984 (freier Volltext) – (englisch).
- ↑ Owen Pornillos et al.: X-ray structures of the hexameric building block of the HIV capsid. In: Cell. Band 137, Nr. 7, 26. Juni 2009, S. 1282–1292, doi:10.1016/j.cell.2009.04.063, PMID 19523676, PMC 2840706 (freier Volltext) – (englisch).
- ↑ Owen Pornillos et al.: Atomic-level modelling of the HIV capsid. In: Nature. Band 469, Nr. 7330, 20. Januar 2011, S. 424–427, doi:10.1038/nature09640, PMID 21248851, PMC 3075868 (freier Volltext) – (englisch).
- ↑ Karen E. Ocwieja et al.: Dynamic regulation of HIV-1 mRNA populations analyzed by single-molecule enrichment and long-read sequencing. In: Nucleic Acids Research. Band 40, Nr. 20, 1. November 2012, S. 10345–10355, doi:10.1093/nar/gks753, PMID 22923523, PMC 3488221 (freier Volltext) – (englisch).
- ↑ John Coffin et al.: What to call the AIDS virus? In: Nature. Band 321, Nr. 6065, Mai 1986, S. 10–10, doi:10.1038/321010a0, PMID 3010128 (englisch).
- ↑ Françoise Barré-Sinoussi et al.: Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). In: Science. Band 220, Nr. 4599, 20. Mai 1983, S. 868–871, doi:10.1126/science.6189183, PMID 6189183 (englisch).
- ↑ Robert Gallo et al.: Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS). In: Science. Band 220, Nr. 4599, 20. Mai 1983, S. 865–867, doi:10.1126/science.6601823, PMID 6601823 (englisch).
- ↑ ORF: Als Robert Gallo das HI-Virus nicht entdeckte, April 2009
- ↑ The Nobel Prize in Physiology or Medicine 2008. In: Internet-Seiten des Nobelpreises. The Nobel Foundation, abgerufen am 18. Dezember 2008 (englisch).
- ↑ Jon Cohen, Martin Enserink: Nobel Prize in Physiology or Medicine. HIV, HPV researchers honored, but one scientist is left out. In: Science. Band 322, Nr. 5899, 10. Oktober 2008, S. 174–175, doi:10.1126/science.322.5899.174, PMID 18845715 (englisch).
- ↑ Stephen Pincock: HIV discoverers awarded Nobel Prize for medicine. In: Lancet. Band 372, Nr. 9647, 18. Oktober 2008, S. 1373, doi:10.1016/s0140-6736(08)61571-8, PMID 18946912 (englisch).
- ↑ Coco Ballantyne: Nobel decision stirs viral dismay. In: Nature Medicine. Band 14, Nr. 11, November 2008, S. 1132, doi:10.1038/nm1108-1132b, PMID 18989265 (englisch).
- ↑ a b c Aids – Erbe der Kolonialzeit. ARD, 26. November 2016, abgerufen am 14. August 2019 (https://www.youtube.com/watch?v).
- ↑ Jan Osterkamp: Wie Affen-Immunschwächeviren plötzlich den Menschen eroberten. In: Spektrum.de. 23. August 2019.
- ↑ Edward Hooper: Aids and the Polio Vaccine. In: London Review of Books, Band 25, Nr. 7, 2003.
- ↑ Edward Hooper: Untruths, misrepresentations and spin: the dubious methods and tactics used by Stanley Plotkin’s group in the “Origins of AIDS” debate. uow.edu.au, 2004; abgerufen am 28. Oktober 2014.
- ↑ AIDS Origins. Auf: aidsorigins.com – Website von Edward Hooper; abgerufen am 28. Oktober 2014.
- ↑ Bette Korber et al.: Timing the ancestor of the HIV-1 pandemic strains. In: Science (New York, N.Y.). Band 288, Nr. 5472, 9. Juni 2000, S. 1789–1796, doi:10.1126/science.288.5472.1789, PMID 10846155 (englisch).
- ↑ Philippe Blancou et al.: Polio vaccine samples not linked to AIDS. In: Nature. Band 410, Nr. 6832, 26. April 2001, S. 1045–1046, doi:10.1038/35074171, PMID 11323657 (englisch).
- ↑ Jörg Albrecht, Volker Stollorz: Impfen ohne Grenzen. In: FAZ.net. 6. Oktober 2014, abgerufen am 27. Dezember 2014.
- ↑ T. Zhu, B. T. Korber et al.: An African HIV-1 sequence from 1959 and implications for the origin of the epidemic. In: Nature, Band 391, Nummer 6667, Februar 1998, S. 594–597, doi:10.1038/35400. PMID 9468138.
- ↑ A. J. Nahmias, J. Weiss, X. Yao et al.: Evidence for human infection with an HTLV III/LAV-like virus in Central Africa, 1959. In: The Lancet. Band 327, Nr. 8492, Juni 1986, S. 1279–1280, doi:10.1016/S0140-6736(86)91422-4.
- ↑ a b Michael Worobey et al.: Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960. In: Nature. Band 455, Oktober 2008, S. 661–664, doi:10.1038/nature07390 (englisch).
- ↑ Der Werdegang des HI-Virus. wissenschaft.de, 27. Juni 2008, abgerufen am 12. September 2019.
- ↑ M. Elvin-Lewis et al.: Systemic Chlamydial infection associated with generalized lymphedema and lymphangiosarcoma. In: Lymphology. Band 6, Nr. 3, September 1973, S. 113–121, PMID 4766275 (englisch).
- ↑ Robert F. Garry et al.: Documentation of an AIDS virus infection in the United States in 1968. In: JAMA. Band 260, Nr. 14, 14. Oktober 1988, S. 2085–2087, doi:10.1001/jama.1988.03410140097031, PMID 3418874 (englisch).
- ↑ Michael Worobey et al.: 1970s and 'Patient 0' HIV-1 genomes illuminate early HIV/AIDS history in North America. In: Nature. Band 539, Nr. 7627, 3. November 2016, S. 98–101, doi:10.1038/nature19827, PMID 27783600, PMC 5257289 (freier Volltext) – (englisch).
- ↑ Harlod W. Jaffe et al.: The acquired immunodeficiency syndrome in a cohort of homosexual men. A six-year follow-up study. In: Annals of Internal Medicine. Band 103, Nr. 2, August 1985, S. 210–214, doi:10.7326/0003-4819-103-2-210, PMID 2990275 (englisch).
- ↑ Cladd E. Stevens: Human T-Cell Lymphotropic Virus Type III Infection in a Cohort of Homosexual Men in New York City. In: JAMA: The Journal of the American Medical Association. Band 255, Nr. 16, 25. April 1986, S. 2167, doi:10.1001/jama.1986.03370160065028, PMID 3007789 (englisch).
- ↑ a b Alexandria Williams et al.: Geographic and Population Distributions of Human Immunodeficiency Virus (HIV)-1 and HIV-2 Circulating Subtypes: A Systematic Literature Review and Meta-analysis (2010–2021). In: The Journal of Infectious Diseases. Band 228, Nr. 11, 28. November 2023, S. 1583–1591, doi:10.1093/infdis/jiad327, PMID 37592824 (englisch).
- ↑ a b c d e f HIV-Infektion/AIDS. RKI-Ratgeber. Robert Koch-Institut, 16. Juni 2022, abgerufen am 4. Mai 2023.
- ↑ Julie Yamaguchi et al.: Brief Report: Complete Genome Sequence of CG-0018a-01 Establishes HIV-1 Subtype L. In: Journal of Acquired Immune Deficiency Syndromes (1999). Band 83, Nr. 3, 1. März 2020, S. 319–322, doi:10.1097/QAI.0000000000002246, PMID 31693506, PMC 7012332 (freier Volltext) – (englisch).
- ↑ a b Mirela D'arc et al.: Origin of the HIV-1 group O epidemic in western lowland gorillas. In: Proceedings of the National Academy of Sciences of the United States of America. Band 112, Nr. 11, 17. März 2015, S. E1343–1352, doi:10.1073/pnas.1502022112, PMID 25733890, PMC 4371950 (freier Volltext) – (englisch).
- ↑ a b Nicholas Bbosa et al.: HIV subtype diversity worldwide. In: Current opinion in HIV and AIDS. Band 14, Nr. 3, Mai 2019, S. 153–160, doi:10.1097/COH.0000000000000534, PMID 30882484 (englisch).
- ↑ Martine Peeters: Recombinant HIV sequences: their role in the global epidemic. In: HIV Sequence Compendium. Los Alamos National Laboratory, 2000, abgerufen am 4. Januar 2024 (englisch).
- ↑ HIV Circulating Recombinant Forms (CRFs). In: HIV Sequence Database. Los Alamos National Laboratory, abgerufen am 4. Januar 2024 (englisch).
- ↑ J. C. Plantier et al.: A new human immunodeficiency virus derived from gorillas. In: Nature Medicine. Band 15, Nr. 8, 2009, S. 871–872, PMID 19648927.
- ↑ a b F. Kirchhoff: „Optimale“ Anpassung pandemischer HIV-1-Stämme an den Menschen. In: BIOspektrum. Band 2, 2010, S. 144–148.
- ↑ B. H. Hahn et al.: AIDS as a zoonosis: scientific and public health implications. In: Science. Band 287, Nr. 5453, 2000, S. 607–614, PMID 10649986.
- ↑ D. Sauter et al.: Tetherin-driven adaptation of Vpu and Nef function and the evolution of pandemic and nonpandemic HIV-1 strains. In: Cell Host Microbe. Band 6, Nr. 5, 2009, S. 409–421, PMID 19917496.
- ↑ „Optimale“ Anpassung von HIV-1 an den menschlichen Wirt eine Voraussetzung für die effektive Ausbreitung der AIDS Pandemie? Universität Ulm, archiviert vom am 15. Januar 2016; abgerufen am 24. Juni 2010.
- ↑ World AIDS Day report 2011. (PDF; 618 kB) UNAIDS, abgerufen am 2. September 2012 (englisch).
- ↑ Если быть точным. (russisch) Auf: t.me; zuletzt abgerufen am 7. Dezember 2023.
- ↑ kna: Zahl der HIV-Infizierten in Russland in fünf Jahren fast verdoppelt. In: aerzteblatt.de. 28. November 2012, abgerufen am 27. Dezember 2014.
- ↑ Die Auswirkungen der COVID-19-Pandemie und assoziierter Public-Health-Maßnahmen auf andere meldepflichtige Infektionskrankheiten in Deutschland (MW 1/2016 – 32/2020). (PDF) In: rki.de. Robert Koch-Institut, 18. Februar 2021, abgerufen am 13. Februar 2021 (Online-Vorab-Veröffentlichung aus dem Epidemiologischen Bulletin).
- ↑ Zahlen zur mittleren Übertragbarkeit von HIV, pro Akt. CDC, abgerufen am 17. November 2016 (englisch).
- ↑ Cornelia Dick-Pfaff: HI-Viren durchdringen auch gesunde Schleimhaut der Scheide. In: wissenschaft-aktuell.de. 17. Dezember 2008, abgerufen am 18. Dezember 2008.
- ↑ Pietro Vernazza: Oralverkehr ohne Gummi: Wie hoch ist das HIV-Risiko? In: Klinik für Infektiologie/Spitalhygiene, Kantonsspital St. Gallen. 10. Juni 2002, abgerufen am 31. Januar 2014.
- ↑ HIVreport – Lusttropfen. (PDF) Deutsche AIDShilfe, archiviert vom (nicht mehr online verfügbar) am 18. April 2016; abgerufen am 6. April 2016.
- ↑ Zahlen zur mittleren Übertragbarkeit von HIV, pro Akt. CDC, abgerufen am 1. Juli 2009.
- ↑ Christoph Spinner, Christian Hoffmann: Prävention der HIV-Infektion. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 644 (hivbuch.de [PDF]).
- ↑ Kann eine Beschneidung das HIV-Infektionsrisiko senken? HIV-Übertragung – Häufige Fragen. Auf: gib-aids-keine-chance.de; abgerufen am 15. Januar 2015.
- ↑ M. Hilgartner: AIDS in the transfusion recipient. In: Pediatr Clin North Am. Band 38, Nr. 1, 1991, S. 121–131, PMID 1987513.
- ↑ Irja Most: Wie sicher sind deutsche Kliniken? In: Tagesspiegel. 29. Februar 2008, archiviert vom (nicht mehr online verfügbar).
- ↑ Blutsicherheit: Häufig gestellten Fragen. Robert Koch-Institut, 19. Mai 2014, abgerufen am 7. April 2016.
- ↑ S2k-Leitlinie HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen der Deutschen AIDS-Gesellschaft (DAIG). In: AWMF online (Stand 2020)
- ↑ Stillen: Prophylaxe halbiert HIV-Risiko. In: aerztezeitung.de.
- ↑ CHAT-Survey-Studie
- ↑ Andrea Fischer: Viele holen sich beim Partner HIV. In: Tages-Anzeiger. 2. Mai 2006, archiviert vom (nicht mehr online verfügbar) am 30. Mai 2011; abgerufen am 18. Dezember 2008.
- ↑ HIV-Übertragung und Aids-Gefahr. Bundeszentrale für gesundheitliche Aufklärung, 2015, archiviert vom (nicht mehr online verfügbar) am 6. Juni 2016; abgerufen am 6. April 2016.
- ↑ a b RKI Ratgeber für Ärzte: HIV/AIDS. Robert Koch-Institut, 16. Juni 2022, abgerufen am 4. Januar 2025.
- ↑ C. B. Wilen, J. C. Tilton, R. W. Doms: HIV: cell binding and entry. In: Cold Spring Harbor perspectives in medicine. Band 2, Nummer 8, August 2012, S. , doi:10.1101/cshperspect.a006866, PMID 22908191, PMC 3405824 (freier Volltext).
- ↑ Forscher entdecken lange gesuchtes Versteck des HI-Virus. Der Standard, 18. Dezember 2012, abgerufen am 19. Dezember 2012.
- ↑ Giuseppe Pantaleo et al.: Follicular helper T cells serve as the major CD4 T cell compartment for HIV-1 infection, replication, and production. Journal of Experimental Medicine, abgerufen am 19. Dezember 2012 (englisch).
- ↑ M. J. Buzon, H. Sun et al.: HIV-1 persistence in CD4+ T cells with stem cell-like properties. In: Nature medicine, Band 20, Nummer 2, Februar 2014, S. 139–142, ISSN 1546-170X. doi:10.1038/nm.3445. PMID 24412925. PMC 3959167 (freier Volltext).
- ↑ J. B. Dinoso, S. Y. Kim, A. M. Wiegand: Treatment intensification does not reduce residual HIV-1 viremia in patients on highly active antiretroviral therapy. In: Proceedings of the National Academy of Sciences of the United States of America. Band 106, Nr. 23, Juni 2009, S. 9403–9408, doi:10.1073/pnas.0903107106 (englisch).
- ↑ S. R. Lewin, C. Rouzioux: HIV cure and eradication: how will we get from the laboratory to effective clinical trials? In: AIDS. Band 25, Nr. 7, April 2011, S. 885–897, doi:10.1097/QAD.0b013e3283467041 (englisch).
- ↑ H. Deng, R. Liu et al.: Identification of a major co-receptor for primary isolates of HIV-1. In: Nature, Band 381, Nummer 6584, Juni 1996, S. 661–666. doi:10.1038/381661a0. PMID 8649511.
- ↑ Y. R. Zou, A. H. Kottmann et al.: Function of the chemokine receptor CXCR4 in haematopoiesis and in cerebellar development. In: Nature, Band 393, Nummer 6685, Juni 1998, S. 595–599, doi:10.1038/31269. PMID 9634238.
- ↑ Y. R. Zou et al.: Function of the chemokine receptor CXCR4 in haematopoiesis and in cerebellar development. In: Nature, Band 393, Nr. 6685, 1998, S. 595–599, PMID 9634238.
- ↑ C. Winkler, W. Modi et al.: Genetic restriction of AIDS pathogenesis by an SDF-1 chemokine gene variant. ALIVE Study, Hemophilia Growth and Development Study (HGDS), Multicenter AIDS Cohort Study (MACS), Multicenter Hemophilia Cohort Study (MHCS), San Francisco City Cohort (SFCC) In: Science, Band 279, Nummer 5349, Januar 1998, S. 389–393, PMID 9430590.
- ↑ D. Schols, S. Struyf et al.: Inhibition of T-tropic HIV strains by selective antagonization of the chemokine receptor CXCR4. In: The Journal of experimental medicine. Band 186, Nummer 8, Oktober 1997, S. 1383–1388, ISSN 0022-1007. PMID 9334378. PMC 2199084 (freier Volltext).
- ↑ T. Murakami, T. Nakajima et al.: A small molecule CXCR4 inhibitor that blocks T cell line-tropic HIV-1 infection. In: The Journal of experimental medicine, Band 186, Nummer 8, Oktober 1997, S. 1389–1393, ISSN 0022-1007. PMID 9334379. PMC 2199089 (freier Volltext).
- ↑ a b Henning Grüll et al.: Pathophysiologie der HIV-Infektion. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 25–26 (hivbuch.de [PDF]).
- ↑ Somayesadat Badieyan et al.: HIV-1 binds dynein directly to hijack microtubule transport machinery. In: bioRxiv: The Preprint Server for Biology. 2. Dezember 2023, S. 2023.08.29.555335, doi:10.1101/2023.08.29.555335, PMID 37693451 (englisch).
- ↑ Somayesadat Badieyan et al.: A team of dynein motor proteins drives microtubule-based trafficking of HIV-1. In: Biophysical Journal. Band 123, Nr. 3, Februar 2024, S. 125a, doi:10.1016/j.bpj.2023.11.860 (englisch).
- ↑ Neues Puzzleteil der HIV-Infektion erforscht: Virus-Capsid gelangt unversehrt in den Zellkern. Universitätsklinikum Heidelberg, 10. Februar 2021, abgerufen am 22. August 2024.
- ↑ Dirk Görlich, Kristin Fricke: HIV: Erbgut-Schmuggel in den Zellkern. Max-Planck-Gesellschaft, 24. Januar 2024, abgerufen am 4. Januar 2025.
- ↑ Liran Fu, Erika N. Weiskopf, Onno Akkermans et al.: HIV-1 capsids enter the FG phase of nuclear pores like a transport receptor. In: Nature. Band 626, Nr. 8000, Februar 2024, S. 843–851, doi:10.1038/s41586-023-06966-w, PMID 38267583 (englisch).
- ↑ D. M. Knipe, Peter Howley, D. E. Griffin (Hrsg.): Fields Virology. 5. Auflage, Lippincott Williams & Wilkins, Philadelphia 2007, ISBN 978-0-7817-6060-7.
- ↑ Valentina Poletti, Fulvio Mavilio: Interactions between Retroviruses and the Host Cell Genome. In: Molecular Therapy - Methods & Clinical Development. Band 8, März 2018, S. 31–41, doi:10.1016/j.omtm.2017.10.001, PMID 29159201, PMC 5684498 (freier Volltext) – (englisch).
- ↑ Frank Maldarelli et al.: Specific HIV integration sites are linked to clonal expansion and persistence of infected cells. In: Science. Band 345, Nr. 6193, 11. Juli 2014, S. 179–183, doi:10.1126/science.1254194, PMID 24968937, PMC 4262401 (freier Volltext) – (englisch).
- ↑ G. Li, E. De Clercq: HIV Genome-Wide Protein Associations: a Review of 30 Years of Research. In: Microbiology and molecular biology reviews: MMBR. Band 80, Nummer 3, 2016-09, S. 679–731, doi:10.1128/MMBR.00065-15, PMID 27357278, PMC 4981665 (freier Volltext).
- ↑ a b Chuang Liu et al.: Cyclophilin A stabilizes the HIV-1 capsid through a novel non-canonical binding site. In: Nature Communications. Band 7, Nr. 1, 4. März 2016, doi:10.1038/ncomms10714, PMID 26940118, PMC 4785225 (freier Volltext) – (englisch).
- ↑ Armin Schafberger, Holger Sweers: HIV / AIDS – Heutiger Wissensstand. Deutsche AIDS-Hilfe e. V., 2008, S. 7, abgerufen am 15. Januar 2016.
- ↑ Eric S. Rosenberg et al.: Immune control of HIV-1 after early treatment of acute infection. In: Nature. Band 407, Nr. 6803, September 2000, S. 523–526, doi:10.1038/35035103 (englisch).
- ↑ M. Altfeld, E. S. Rosenberg u. a.: Cellular immune responses and viral diversity in individuals treated during acute and early HIV-1 infection. In: The Journal of experimental medicine. Band 193, Nummer 2, Januar 2001, S. 169–180, ISSN 0022-1007. PMID 11148221. PMC 2193337 (freier Volltext).
- ↑ HIV causes structural heart disease. In: escardio.org. 11. Dezember 2013, archiviert vom (nicht mehr online verfügbar) am 27. Dezember 2014; abgerufen am 27. Dezember 2014.
- ↑ a b c d e f g Impfen bei Immundefizienz: Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen.(II) Impfen bei 1. Primären Immundefekterkrankungen und 2. HIV-Infektion. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. Band 61, Nr. 8, August 2018, ISSN 1436-9990, S. 1034–1051, doi:10.1007/s00103-018-2761-8.
- ↑ Joseph Hokello et al.: Comparison of the Biological Basis for Non-HIV Transmission to HIV-Exposed Seronegative Individuals, Disease Non-Progression in HIV Long-Term Non-Progressors and Elite Controllers. In: Viruses. Band 15, Nr. 6, 13. Juni 2023, S. 1362, doi:10.3390/v15061362, PMID 37376660 (englisch).
- ↑ M. Dean, M. Carrington u. a.: Genetic restriction of HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 structural gene. Hemophilia Growth and Development Study, Multicenter AIDS Cohort Study, Multicenter Hemophilia Cohort Study, San Francisco City Cohort, ALIVE Study. In: Science. Band 273, Nummer 5283, September 1996, S. 1856–1862, ISSN 0036-8075. PMID 8791590.
- ↑ R. Liu, W. A. Paxton u. a.: Homozygous defect in HIV-1 coreceptor accounts for resistance of some multiply-exposed individuals to HIV-1 infection. In: Cell. Band 86, Nummer 3, August 1996, S. 367–377, ISSN 0092-8674. PMID 8756719.
- ↑ A. Djordjevic, M. Veljkovic u. a.: The presence of antibodies recognizing a peptide derived from the second conserved region of HIV-1 gp120 correlates with non-progressive HIV infection. In: Current HIV research. Band 5, Nummer 5, September 2007, S. 443–448, ISSN 1873-4251. PMID 17896963.
- ↑ HIV-Test & Beratung. Bundeszentrale für gesundheitliche Aufklärung (BZgA), archiviert vom (nicht mehr online verfügbar) am 15. Juli 2014; abgerufen am 7. Juli 2014.
- ↑ [1] (PDF) LADR
- ↑ Cohen et al.: The Detection of Acute HIV Infection. In: The Journal of Infectious Diseases. Band 202, 2010, S. S270-S277, doi:10.1086/655651, PMID 20846033.
- ↑ Diagnostisches Fenster: Ab 2015 von zwölf auf sechs Wochen verkürzt! Deutsche AIDShilfe; abgerufen am 15. Januar 2016.
- ↑ L. Simonsen, J. Buffington u. a.: Multiple false reactions in viral antibody screening assays after influenza vaccination. In: American journal of epidemiology, Band 141, Nummer 11, Juni 1995, S. 1089–1096, ISSN 0002-9262. PMID 7539579.
- ↑ Christian Hoffmann: Die richtige Primärtherapie. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 170 (hivbuch.de [PDF]).
- ↑ a b Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion. (PDF) In: Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften. 3. September 2020, abgerufen am 4. Mai 2023.
- ↑ Laborwerte bei HIV. In: AIDS-Hilfe. Abgerufen am 4. Mai 2023.
- ↑ a b Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: HIV in Deutschland: Insgesamt weniger Neuinfektionen. 29. November 2019, abgerufen am 4. Mai 2023.
- ↑ a b c d Tim Niehues, Christian Bogdan, Jane Hecht, Thomas Mertens, Miriam Wiese-Posselt: Impfen bei Immundefizienz: Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen(I) Grundlagenpapier. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. Band 60, Nr. 6, Juni 2017, ISSN 1436-9990, S. 674–684, doi:10.1007/s00103-017-2555-4.
- ↑ a b Ständige Impfkommission (STIKO): Empfehlungen der Ständigen Impfkommission (STIKO) beim Robert Koch-Institut 2021. 26. August 2021, doi:10.25646/8824 (rki.de [abgerufen am 18. Oktober 2021]).
- ↑ Laura Miller, Lola Arakaki, Arianne Ramautar, Sara Bodach, Sarah L. Braunstein: Elevated Risk for Invasive Meningococcal Disease Among Persons With HIV. In: Annals of Internal Medicine. Band 160, Nr. 1, 7. Januar 2014, ISSN 0003-4819, S. 30–37, doi:10.7326/0003-4819-160-1-201401070-00731 (annals.org [abgerufen am 12. Oktober 2021]).
Auf dieser Seite verwendete Medien
(c) Tagesschau (ARD), CC BY-SA 4.0
In diesem Clip der Tagesschau wird geklärt, ob bald eine Pille anstatt einer Impfung gegen HIV helfen kann.
Autor/Urheber: see Source, Lizenz: CC BY 2.5
HIV-1 particles assembling at the surface of an infected macrophage.
Autor/Urheber: Thomas Splettstoesser (www.scistyle.com), Lizenz: CC BY-SA 4.0
The HIV capsid consists of roughly 200 copies of the p24 protein. The p24 structure is shown in two representations: cartoon (top) and isosurface (bottom) and based on PDB 4XFX. The capsid structure is based on PDB 3J3Q
Autor/Urheber: Thomas Splettstoesser (www.scistyle.com), Lizenz: CC BY-SA 3.0
Schematische Darstellung des Replikationszyklus von HIV.
Autor/Urheber: Prolineserver (talk), Lizenz: GFDL 1.2
Françoise Barré-Sinoussi, Nobelpreisträger für Physiologie oder Medizin 2008, auf einer Pressekonferenz am Karolsinska, Solna
Autor/Urheber: Thomas Splettstößer, Lizenz: CC0
Verlauf der Zahl der Viren und der der T-Lymphozyten von einer unbehandelten HIV-Infektion bis zum Tod durch AIDS
Autor/Urheber: Thomas Splettstoesser (www.scistyle.com), Lizenz: CC BY-SA 4.0
Aufbau des HIV-Virions
HI-Virus, das sich aus einer Immunzelle herauslöst
Autor/Urheber: Thomas Splettstoesser (www.scistyle.com), Lizenz: CC BY-SA 3.0
Aufbau des HIV-1 Genoms. Es besteht aus etwa 10.000 Basenpaaren und enthält neun Gene, die teilweise überlappen.
Robert Gallo, co-discoverer of the HIV virus, in the early eighties among (from left to right) Sandra Eva, Sandra Colombini, and Ersell Richardson.
Autor/Urheber: Grant, B. D. and Sato, M, Lizenz: CC BY 2.5
Mechanism of clathrin-dependent endocytosis. Clathrin and cargo molecules are assembled into clathrin-coated pits on the plasma membrane together with an adaptor complex called AP-2 that links clathrin with transmembrane receptors, concluding in the formation of mature clathrin-coated vesicles (CCVs). CCVs are then actively uncoated and transported to early/sorting endosomes.
Autor/Urheber: ViralZone, SIB Swiss Institute of Bioinformatics: https://viralzone.expasy.org - see also permission note at File:T4likevirus virion.jpg, Lizenz: CC BY 4.0
Genomkarte der Gattung Lentivirus (mit HIV-1, HIV-2)
Autor/Urheber: Prolineserver (talk), Lizenz: GFDL 1.2
Luc Montagnier, Nobelpreisträger für Physiologie oder Medizin 2008, auf einer Pressekonferenz am Karolsinska, Solna
Autor/Urheber: Mike Jones, Lizenz: CC BY-SA 3.0
Mechanism of Viral Entry/Membrane Fusion
1. Initial interaction between gp120 and CD4. 2. Conformational change in gp120 allows for secondary interaction with CXCR4. 3. The distal tips of gp41 are inserted in to the cellular membrane.
4. gp41 undergoes significant conformational change; folding in half and forming coiled-coils. This process pulls the viral and cellular membranes together, fusing them.Autor/Urheber: ViralZone, SIB Swiss Institute of Bioinformatics, see https://viralzone.expasy.org/ bottom right and Commons:Deletion requests/Files uploaded by Ernsts, Lizenz: CC BY 4.0
Lentivirus HIV-1: Unreifes und reifes Virion im Querschnitt
HIV-1. Transmission electron micrograph.
- Cone-shaped cores are sectioned in various orientations. Viral genomic RNA is located in the electron-dense wide end of core.
Autor/Urheber: Thomas Splettstoesser (www.scistyle.com), Lizenz: CC BY-SA 4.0
Phylogenetic Tree of the SIV and HIV viruses.
- Viruses Depicted:
- Human
- HIV-1 M (Main) group, including reference strains from subtypes A-J. Group M is responsible for the pandemic.
- HIV-1 O (Outlier) group, most commonly found in West Africa
- HIV-1 N (Not-M, Not-O) group, found in a very small number of individuals in West Africa
- HIV-1 M group reference strains: A_UG.U455, A_KE.Q2317, B_US.JRFL, B_US.WEAU160, C_ET.ETH2220, C_IN.21068, D_ZR.NDK, D_ZR.ELI, F_FI.FIN6393, F_BE.VI850, G_SE.SE6165, G_BE.DRCBL, H_CF.90CF056, H_BE.VI997, J_SE.SE91733, J_SE.SE92809, and CRF01 AE_CF.90CF402 and AE_TH.CM240, which are subtype A in pol.
- HIV-1 N group: N_CM.YBF30
- HIV-1 O group: O_CM.ANT70, O_CM.MVP5180
- HIV-2 subtypes A and B: H2A_DE.BEN, H2A_SN.ST, H2B_GH.D205, and H2B_CI.EHO
- HIV-1 M (Main) group, including reference strains from subtypes A-J. Group M is responsible for the pandemic.
- Simian
- SIVcpz from chimpanzee Pan troglodytes troglodytes (P.t.t.):
- SIVcpz.GAB, SIVcpz.US, and SIVcpz.Cam3
- SIVcpz from chimpanzee Pan troglodytes shweinfuthii (P.t.s.): SIVcpz.ANT
- SIV African Green Monkey (SIVagm):
- Tantalus (TAN): SIVagm.TAN1
- Vervet (VER): SIVagm.VERTYO, SIVagm.VERAGM3, SIVagm.VER9063, SIVagm.VER155
- Grivet (GRI): SIVagm.GRI677
- Sabaeus (SAB): SIVagm.SAB1C
- SIV Sooty Mangaby (SIVsm) (also found in captive macaques): SIVsm.mac251, SIVsm.smm9
- SIV L’hoest: SIV.LHOEST
- SIV Mandrill: SIV.MNDGB1
- SIV Sun: SIV.SUN