Hornhaut
| Schema des Auges |
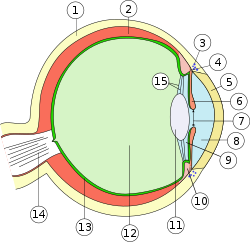 |
1. Lederhaut (Sclera) |
Die Hornhaut (lateinisch Cornea, eingedeutscht auch Kornea, griechisch keras = Horn, keratoeides chitōn = Hornhaut) ist der normalerweise glasklare, von Tränenflüssigkeit benetzte, gewölbte vordere Teil der äußeren Augenhaut und leistet einen Großteil der Lichtbrechung. Sie ist der frontale Abschluss des Augapfels. Anders als der Name suggeriert, ist kein Teil der Hornhaut tatsächlich verhornt.
Funktion
Eine klare und regelrecht benetzte Cornea ist eine notwendige Voraussetzung für scharfes Sehen, da sie als „Fenster“ des Augapfels mit einer Brechkraft von +43 dpt den Hauptanteil der Lichtbrechung zur Bildfokussierung übernimmt (das gesamte menschliche Auge hat eine Brechkraft von etwa 60 dpt, Emmetropauge nach Gullstrand 58,635 dpt). Die Brechkraft von +43 dpt kommt aber nur zustande, weil sich hinter der Cornea Kammerwasser befindet. Wäre in den Augenkammern Luft, wäre die Cornea eine Minuslinse (Zerstreuungslinse), da sie im Zentrum dünner ist als am Rand.
Anatomie
Form
Die Hornhaut ist ein klares Scheibchen, zirkulär durch den Limbus von der Sklera (Lederhaut) abgegrenzt. Die normale menschliche Hornhaut ist meist horizontal elliptisch (Durchmesser 11,7 mm × 10,6 mm) und ist sphärisch gewölbt. Der Radius dieser Wölbung beträgt etwa 7,7 mm. Im Zentrum ist die Hornhaut dünner (0,52 mm) als am Rand (0,67 mm). Unterscheidet sich der horizontale von dem vertikalen Radius, spricht man von einer Hornhautverkrümmung (Astigmatismus). Die Hornhaut kann durch von außen ausgeübten Druck, beispielsweise von formstabilen Kontaktlinsen verformt werden und braucht danach Minuten bis Tage, um die Ausgangsform wieder einzunehmen. Dieser Effekt wird in der Orthokeratologie sogar ausgenutzt, um eine Kurzsichtigkeit auszugleichen. Auch der Liddruck beeinflusst die Form und damit die Brechkraft der Cornea. Um diesen Umstand zu testen, kann man 2 bis 3 Minuten seitlich „aus dem Augenwinkel“ heraussehen, was die Hornhaut vorübergehend stark verformt. Infolgedessen wird sich beim anschließenden Geradeaussehen für einige Minuten die Sehschärfe stark verändert haben.
Mikroskopischer Schichtenaufbau

Die menschliche Hornhaut besteht aus sechs Schichten: Der Epithelschicht (1 in der Abbildung), der Bowman-Membran (2), dem Stroma (3), der Descemet-Membran (4) und der Endothelzellschicht (5). In einer Studie aus dem Jahr 2013 wird als sechste eine 15 µm dicke Schicht zwischen Stroma und Descemet-Membran definiert (Dua-Schicht), die aus 5 bis 8 Lamellen von Kollagen-Typ-1-Bündeln besteht.[1]
Epithelschicht
Die Oberfläche der Hornhaut besteht aus fünf bis sechs Schichten Epithelzellen. Das Epithel ist im Mittel 40–60 µm dick, wobei seine Dicke zum Limbus hin zunimmt. Das Hornhautepithel besteht von innen nach außen aus drei verschiedenen Zelltypen, den Basal-, Flügel- und Schuppenzellen. An der Basalmembran haften die Basalzellen, die in ihrer Form kubisch bis prismatisch sind. Diese basalen Zellen in der Limbusregion sind teilungsfähig und bilden das Keimschichtepithel der Cornea. Außerhalb der Basalzellen liegen die zwei- oder dreischichtigen Flügelzellen, die aus ehemaligen Basalzellen bestehen und bei ihrer Zellwanderung zur Außenseite flach werden. Nach weiterem Vordringen der Flügelzellen an die Oberfläche werden aus ihnen schließlich die Schuppenzellen. Diese sind wieder zwei- bis dreischichtig angeordnet und enthalten weniger Organellen und Desmosomen (Haftplatten) als die Basal- und Flügelzellen, sind allerdings verhältnismäßig mitochondrienreich.
Die oberflächlichen Zellen, die an den Tränenfilm angrenzen, sind mit vielen Mikrozotten bzw. Mikrovilli besetzt. Ihre Höhe beträgt etwa 0,5 µm, ihre Breite 0,3 µm und ihr Abstand etwa 0,5 µm. Diese Zellen stabilisieren vermutlich den Tränenfilm und sind an der Aufnahme von Nährstoffen beteiligt. Betrachtet man die Schuppenzellen mit den Mikrozotten im Elektronenmikroskop, dann werden zwei verschiedene Zelltypen sichtbar: lange, dunkle Zellen und kleine, helle Zellen. Die dunklen Zellen zeichnen sich durch eine hohe Dichte an Mikrozotten aus. Sie sind die älteren und reiferen Zellen, die in den Tränenfilm abgeschuppt werden. Die kleinen, hellen Zellen haben deutlich weniger Mikrozotten und sind die jüngeren Zellen. Sie werden somit nicht sofort in den Tränenfilm abgeschuppt. Die Struktur der an den Tränenfilm angrenzenden Epithelschicht ist damit unregelmäßig. Da die Hornhaut gefäßlos ist, ist sie nicht in der Lage eine eigene Immunantwort einzuleiten. Aus diesem Grunde findet man im Epithel in der Nähe des Limbus die Langerhans-Zellen. Diese werden bei Kontakt mit Fremdantigenen aktiviert, wandern von der Limbusregion zu den nächstgelegenen Lymphknoten und lösen dort eine Immunreaktion gegen das Antigen aus.
Die ineinander verflochtenen Basalzellen, welche die unterste Zelllage des Epithels bilden, sind im Schnitt jeweils etwa 24 μm hoch und 12 µm breit. Durch ihre Desmosomen an den Vorder- und Seitenwänden sowie basale Hemidesmosomen-Verankerungen mit der Basalmembran wird das Hornhautepithel widerstandsfähig gegen mechanische Beanspruchung (z. B. Augenreiben).
Bowman-Membran
Die Bowman-Membran, auch Bowman-Schicht oder Lamina limitans anterior genannt, liegt zwischen dem Stroma und der Basalmembran und ist etwa 12 µm dick. Sie ist weniger eine Membran als eine Ansammlung von Kollagenfibrillen und Proteoglykanen. Die Kollagenfibrillen haben einen Durchmesser von etwa 20–30 nm, was ungefähr zwei Drittel der Dicke derer im Stroma entspricht. Da die Kollagenfibrillen zufällig angeordnet und aus abgesonderten Keratinozyten des Stromas zusammengesetzt sind, kann man von einem engen Zusammenspiel zwischen Bowman-Membran und Stroma ausgehen. Die Vorderfläche der Bowman-Membran ist glatt und formt die Basalmembran. Weiterhin ist die Bowman-Membran unabdingbar für die Erhaltung der Epithelstruktur. Einmal verletzt, heilt sie nur unter Narbenbildung wieder aus, da sie keine Regenerationsfähigkeit besitzt. Eine deutliche Bowman-Membran besitzen nur Primaten.
Stroma

Das Stroma macht etwa 90 % der gesamten Hornhautdicke aus. Es ist die mittlere Schicht der Hornhaut und mit 400–500 µm die dickste aller Hornhautschichten. Das Hornhautstroma – auch Substantia propria (Eigenschicht) genannt – besteht aus Fasern, Zwischensubstanzen sowie Zellen (Keratozyten) und ist in seiner Gesamtheit grundsätzlich ein Bindegewebe. Das Stroma enthält ebenfalls Nervenfasern. Zelluläre Komponenten existieren im Stroma nur etwa in der Größenordnung von 2–3 %. Der Rest wird von verschiedenen Komponenten der extrazellulären Matrix – Kollagenfibrillen, Proteoglykanen und Glykosaminoglykanen ausgefüllt. Elektronenmikroskopisch betrachtet erscheinen die Kollagenfibrillen nicht ausgereift, sondern behalten das ganze Leben lang einen embryonalen Charakter. Sie sind alle ähnlich dick (25–30 nm) und im Gegensatz zu den Sclerafibrillen gleichmäßig, innerhalb einer Lamelle parallel, angeordnet. Die Kollagenfibrillen haben mit 10 % Kollagentyp III und 90 % Kollagentyp I ein für Bindegewebe typisches Kollagenmuster. Jedes Kollagenmolekül besteht aus α-Protein-Ketten. Man geht davon aus, dass sich im Stroma etwa 100–150 Lamellen mit Fibrillen befinden, die 5–6 µm dick sind. Die Lamellen kreuzen sich jeweils unter einem Winkel von 90°, verlaufen parallel zu den anderen Schichten und bilden auf diese Weise ein regelmäßiges Gitter von besonders hoher Stabilität. Diese Anordnung ist neben dem Quellungsgleichgewicht eine der Voraussetzungen für die Transparenz der Hornhaut. Die Lamellen untereinander sind mit einer Kitt- oder Grundsubstanz verbunden, die chemisch aus Proteoglykanen, einer Mischung aus Keratinsulfat und Chondroitinsulfat, besteht. Glykosaminoglykane besitzen zahlreiche Oberflächenladungen und sind damit in der Lage, große Mengen an Wasser zu binden. Somit wird der Brechungsindex zwischen der Kittsubstanz und den Kollagenlamellen auf gleichem Niveau gehalten, um die Transparenz der Cornea zu gewährleisten. Wird das Gleichgewicht durch Wasseraufnahme oder Wasserentzug gestört, ändert sich der Brechungsindex, und es kommt an den Grenzflächen zu Reflexionen und Streuungen. Bei übermäßiger Wasseraufnahme quillt die Kittsubstanz und drängt die Fibrillen auseinander, so dass es zur Stauung im Stroma kommt. Es entstehen Trübungen. Zwischen den Lamellen sind nur potentielle Spalträume aufzufinden, die sich z. B. durch Wasserstoffperoxid zu feinsten röhrenförmigen Saftspalten (Bowman-Röhren) erweitern lassen. Hier befinden sich auch einige Hornhautzellen.
Die Keratozyten sind fixe Zellen, die den Fibrozyten des Bindegewebes gleichen. Sie haben eine langgestreckte Form und besitzen lange, verzweigte Fortsätze. Diese Zellen sind durch Protoplasmabrücken untereinander verbunden und bilden ein Synzytium. Es handelt sich hierbei um einen Zellverband, bei dem die Zellen im zytoplasmatischen Zusammenhang stehen. Das bedeutet, dass keine Grenzen mehr zwischen ihnen sichtbar sind. Diese Anordnung der Zellen hat zur Folge, dass bei einem Reizzustand nicht nur die betroffenen Zellen, sondern auch die umliegenden reagieren. Unter normalen Umständen teilen sich die Keratozyten nur selten. Die turnover-Rate liegt bei etwa 2–3 Jahren. Bei einer Verletzung der Hornhaut bis in das Stroma hinein vermehren sich die Keratozyten und wandern in das beschädigte Gewebe ein. Dort wandeln sie sich in Fibroblasten um und produzieren Kollagene und Proteoglykane. Somit wird die Wunde unter Narbenbildung verschlossen. Außerdem gibt es noch die Fibrozyten, die ständig Kollagen bilden. Sie sichern die Grundsubstanz des Stromas.
Die Wanderzellen können in verschiedenen Formen auftreten (Retikulozyten, Makrophagen, Lymphozyten usw.). Diese Zellen wandern im Falle einer Entzündung zu der betroffenen Stelle hin und sorgen für eine gute Abwehr. Im Limbusgebiet verflechten sich die Lamellen und gehen in die undurchsichtige, weiße Lederhaut (Sclera) über.
Dua-Schicht
Die Dua-Schicht ist eine feine, gleichwohl sehr belastbare, etwa 15 µm dicke Membran, die sich zwischen Stroma und Descemet-Membran befindet. Trotz ihrer geringen Dicke ist sie sehr reißfest und kann einer Druckbelastung von bis zu 2 bar standhalten.[2] Sie wurde erst im Juni 2013 von dem englischen Ophthalmologen Harminder Dua entdeckt, nach dem sie auch benannt ist.[3]
Descemet-Membran
Die Descemet-Membran – auch als Demours-Membran, Lamina limitans posterior oder auch hintere Basalmembran bezeichnet – ist die dickste Basalmembran im menschlichen Körper. Sie ist zur Zeit der Geburt etwa 3 µm und im Erwachsenenalter 8–10 µm dick. Die Descemet-Membran nimmt also im Laufe des Lebens an Dicke zu.
Die Descemet-Membran wird in verschiedene Schichten unterteilt: Eine ungebundene, etwa 0,3 µm dicke Schicht, welche direkt an das Stroma angrenzt, sowie eine 2–4 µm dicke vordere und eine hintere formlose, ungebundene Schicht mit mehr als 4 µm Dicke. Hierbei ist es die hintere Schicht, die im Leben ständig an Dicke durch Auflagerungen von Endothelkollagenen zunimmt. Es wird vermutet, dass die Descemet-Membran ein Ausscheidungsprodukt des Endothels ist. Allerdings kompensiert sie die mit zunehmendem Alter abnehmende Pumpleistung des Endothels. Die Descemet-Membran ist durchsichtig, homogen und besteht hauptsächlich aus Kollagenfasern des Typs VIII und Laminin. Die Kollagenfibrillen bilden ein regelmäßiges, zweidimensionales Sechseckraster. Damit wird die Descemet-Membran zur widerstandsfähigsten, elastischen Membran der gesamten Hornhaut. Als Schutzschicht für das Endothel wirkt die Descemet-Membran wirkungsvoll Infektionen, mechanischen und chemischen Verletzungen sowie enzymatischer Zerstörung entgegen. Verletzungen heilen nur unter Narbenbildung aus.
Endothelzellschicht
Das Endothel besteht aus einer Einzelschicht abgeflachter, hexagonaler Zellen. Diese sind etwa 5 µm dick und messen einen Durchmesser von ca. 20 µm. Gewöhnlich sind diese Zellen in ihrer Form regelmäßig und von ähnlicher Größe. Die Zelldichte beträgt bei jungen, erwachsenen Menschen ungefähr 3500 Zellen/mm². Diese Anzahl ist aber mit fortschreitendem Alter und unabhängig von Erkrankungen stetig abnehmend, bis es im hohen Alter noch etwa 2000 Zellen/mm² aufweist. In den ersten Lebensmonaten kommen gelegentlich Zellteilungen in der Peripherie des Endothels vor. Bei Erwachsenen hat man dagegen noch keinerlei solcher Vorgänge beobachten können. Die Teilung bzw. Regeneration der Zellen findet vom Trabekelwerk des Kammerwinkels aus statt. Im Übergangsbereich zwischen Cornea und Trabekelwerk sind Zellnester zu finden, die in kleinen Vertiefungen der Descemet-Membran liegen und Zellteilungen aufweisen können. Endothelzellen besitzen große Kerne und reichlich zytoplasmatische Organellen wie Mitochondrien, endoplasmatisches Retikulum, freie Ribosomen und Golgi-Apparate. Damit sind die Endothelzellen aktiv am Stoffwechsel beteiligt. Die vordere Seite der Zellen grenzt flach an die Descemet-Membran, die hintere Seite an die Vorderkammer des Auges. Hier sind die Zellen nicht mehr flach, sondern besitzen Mikrozotten und zum Rand hin Falten, wodurch eine größere Oberfläche zum Kammerwasser entsteht. Die Endothelzellen sind eng miteinander durch komplexe Anschlussstellen verbunden. Es sind aber keine Desmosomen vorhanden. Durch Spaltverbindungen können Moleküle und Elektrolyte zwischen den Endothelzellen hindurch gelangen. Die Verbindung der Endothelzellschicht miteinander schafft eine für das Kammerwasser durchlässige Barriere. Im Vergleich ist das Endothel für Wasser 7-mal und für Ionen 400-mal so durchlässig wie das Epithel. Absterbende oder ausfallende Zellen werden durch Polymorphismus und Polymegatismus ersetzt. Dabei verlieren die Zellen ihre sechseckige Form und es entstehen Zellen unterschiedlicher Form und Größe. Durch diesen Vorgang ist gewährleistet, dass die Descemet-Membran immer vollständig von Endothelzellen bedeckt bleibt. Für die Aufrechterhaltung der Pumpenleistung des Endothels ist eine Zelldichte von mindestens 300–800 Zellen/mm² nötig, andernfalls kommt es zur Dekompression des Stromas und zur Eintrübung der Cornea.
Eine der wichtigsten Aufgaben des Endothels ist es, den Hydratationszustand und somit die Transparenz der Hornhaut aufrechtzuerhalten. Eine weitere Aufgabe besteht in der Synthese bestimmter Komponenten der Descemet-Membran und der Regulierung des Austausches von Stoffwechselprodukten zwischen Kammerwasser und Stroma. Das durch den Stoffwechselvorgang eindringende Wasser muss von den Endothelzellen unter Verbrauch von Stoffwechselenergie wieder aus der Hornhaut herausgepumpt werden.
Embryologie
Nur das Epithel entstammt dem embryonalen Ektoderm, die übrigen Hornhautschichten entwickeln sich aus dem Mesoderm. Die Endothelzellen entspringen der Neuralleiste. Der Hornhautdurchmesser eines Neugeborenen beträgt im Mittel 9,5 mm. Das Hornhautwachstum ist Ende des zweiten Lebensjahres beendet. Ein Erwachsener hat im Mittel einen Hornhautdurchmesser von 11,5 mm (<10 = Mikrokornea, >13 = Makrokornea).
Physiologie
Transparenz
Die Transparenz der Hornhaut ist durch eine regelmäßige ultrastrukturelle Anordnung ihrer Proteinbestandteile (Kollagene und Proteoglykane) und einen streng definierten Wassergehalt des Stromas bedingt. Bei Störungen des Wassergehaltes des Hornhautstromas, beispielsweise durch Quellung, geht die regelmäßige Anordnung verloren, und die Lichtstreuung nimmt zu. Im extremen Fall bedingt die Lichtstreuung eine komplette Weißfärbung der Hornhaut. Der Wassergehalt wird von der Endothelzellschicht aktiv unter Sauerstoffverbrauch reguliert.
Polarisationseigenschaften
Die Hornhaut ist aufgrund ihres strukturierten Aufbaus (Fibrillen) stark doppelbrechend, d. h. die Polarisation von hindurchtretendem Licht wird deutlich verändert. Die Doppelbrechung der Hornhaut weist im Allgemeinen sowohl einen linearen als auch einen zirkularen Anteil auf. Sie hängt vom Ort, Einfallswinkel und der Lichtwellenlänge ab. Darüber hinaus ist die Stärke der Hornhaut-Doppelbrechung individuell sehr variabel.[4]
Tränenfilm
Die Tränenflüssigkeit wird größtenteils in der Tränendrüse erzeugt und rinnt über den Augenwinkel und den Tränenkanal in die Nasenhöhle ab. Der gesamte Tränenfilm besteht aus zwei unterschiedlichen Arten von Tränenfilmen, dem präokulären und dem präcornealen Tränenfilm. Der präokuläre Tränenfilm bedeckt die innerhalb der Lidspalte gelegene Hornhaut und Bindehaut. Der präcorneale Tränenfilm überzieht hingegen nur die freiliegende Cornea. Auf der Augenoberfläche bildet die präcorneale Tränenflüssigkeit einen dreischichtigen Tränenfilm.
Beim Zwinkern entstehen mikroskopische Bläschen, die die Sehleistung kurzfristig herabsetzen. Nach etwa 0,5 bis 1,5 Sekunden lösen sie sich auf (je nach Konsistenz des Films) und auch durch den Lidschlag erzeugte Verdickungen werden ausgeglichen. Nach zirka 5 Sekunden bricht der Film auf und erzeugt wiederum Unregelmäßigkeiten, wodurch sich die Sehleistung wieder verschlechtert.
Stoffwechsel
Die äußeren Schichten der Hornhaut werden durch die Tränenflüssigkeit, die inneren durch das Kammerwasser und das Randschlingennetz mit Nährstoffen und Sauerstoff versorgt. Unter energetischen Gesichtspunkten betrachtet befindet sich die Hornhaut in einem Zustand, wie es der Gesamtorganismus nach einem 1000-Meter-Lauf ist. Defizite des Energiestoffwechsels führen sofort zu Ödemen in der Hornhaut und zu einer verringerten Epithelregeneration. Die Hornhaut ist also auf eine ständige und gute Versorgung mit Nährstoffen angewiesen und auf eine restlose Beseitigung der Stoffwechselendprodukte. Für den Metabolismus werden vor allem Glucose (Traubenzucker) und Sauerstoff benötigt, die von außen zugeführt werden müssen. Als Stoffwechselendprodukte entstehen hauptsächlich Wasser, Kohlendioxid und Laktat (Milchsäure). Für den Metabolismus benötigte Substanzen aus dem Tränenfilm und dem Kammerwasser müssen durch Diffusion in die Cornea eingebracht werden, da sie gefäßlos ist. Ebenso müssen die Stoffwechselendprodukte durch Diffusion aus der Hornhaut herausgeleitet werden. Einzig und allein das Randschlingennetz als peripheres Gefäßsystem im Limbusbereich ist in der Lage, die Peripherie der Cornea mit Glucose und Sauerstoff direkt zu versorgen. Weiter gelangen die Substanzen aber auch nur durch Diffusion in die Hornhaut hinein. Bei eventuellen Verletzungen des Randschlingennetzes und dessen vollständiger Ausfall an der Ernährungsbeteiligung der Hornhaut führt unterdessen nicht zur Funktionsuntüchtigkeit der Hornhaut. Man geht davon aus, dass der Beitrag an der Ernährung der Cornea äußerst gering ist. Die Tränenflüssigkeit liefert den größten Anteil an Sauerstoff, wobei er bei geöffneten Lidern aus der Atmosphäre in den Tränenfilm gelangt und bei geschlossenen Lidern aus den Gefäßen des Randschlingennetzes und der Bindehaut in den Tränenfilm diffundiert. Während im Tränenfilm nur sehr wenig Glucose vorhanden ist (etwa 0,2 µmol/g Wasser), existiert im Kammerwasser wenig gelöster Sauerstoff. Dieser reicht gerade aus, um den hintersten Bereich der Cornea zu versorgen. Im Gegenzug befindet sich im Kammerwasser der größte Anteil an Glucose (etwa 6,5 µmol/g Wasser). Für die Hornhaut ist der Abbau von Glucose von entscheidender Bedeutung für die Energieversorgung. Der Abbau erfolgt unter Mitwirkung von zahlreichen Enzymen auf drei Wegen. Ein Weg verläuft in Abwesenheit von Sauerstoff, also anaerob, zwei Wege erfordern die Anwesenheit von Sauerstoff, sie verlaufen aerob:
- Ohne Sauerstoff erfolgt der Abbau von Glucose auf dem Wege der anaeroben Glykolyse. Der Vorgang heißt auch Embden-Meyerhof-Zyklus. Dieser Prozess führt in mehreren Stufen über die Brenztraubensäure zum Laktat bzw. zur Milchsäure. Die Milchsäure wird dann über das Kammerwasser abtransportiert. Im Falle eines Glucosemangels wird auf das im Epithel gespeicherte Glykogen zurückgegriffen. Schätzungen zufolge werden rund 55 % der der Cornea zur Verfügung stehenden Glucose über diesen Weg abgebaut.[5] Pro Mol Glucose werden aber nur 2 mol energiereiches ATP erzeugt. Die Energieausbeute ist damit relativ gering.
- Der Hexosemonophosphat-Weg liefert in der Ausbeute unterschiedlich viel Energie, die in der Form von ATP gespeichert wird. Mit einem Mol energiereichem ATP pro Mol Glucose ist der Hexosemonophosphat-Weg wohl der unergiebigste, über ihn werden aber rund 35 % der gesamten Glucose umgewandelt.
- Bei Anwesenheit von Sauerstoff wird das erzeugte Laktat, welches über die aerobe Glykolyse entsteht, vollständig zu Kohlendioxid und Wasser umgewandelt. Bekannt ist dieser Prozess als Zitronensäurezyklus. Beim aeroben Abbau der Glucose (Zitronensäurezyklus) werden pro Mol Glucose 36 mol ATP erzeugt. Diesen Weg nehmen jedoch nur ungefähr 15 % der verstoffwechselten Glucose.
Es ist also erkennbar, dass die Sauerstoffversorgung für die Energienutzung maßgeblich ist. Bei Sauerstoffmangel wird die Glucose nur unvollständig bis zu Laktat abgebaut. Dieses reichert sich dann in der Hornhaut an und hemmt oder unterbricht die Umwandlung in Wasser und Kohlendioxid. Dadurch kommt es zur Quellung der Hornhaut, eine dadurch ausgelöste Störung der regelmäßigen Anordnung der Fibrillen im Stroma und letzten Endes zu einer Trübung in der Cornea. In der Nacht wird weniger Tränenflüssigkeit gebildet und durch die geschlossenen Augenlider kann weniger Sauerstoff von der Hornhaut aufgenommen werden. Dieser Umstand erklärt, dass die Symptome vieler Hornhauterkrankungen morgens stärker als abends ausgeprägt sind. Auch gilt die Trübung durch Hornhautquellung als ein „unsicheres Todeszeichen“, das etwa 24 Stunden nach Verlust der Endothelzellfunktion beobachtet wird.
Innervation
Die Hornhaut ist von sensiblen Nervenästen des Nervus ophthalmicus innerviert, die in der Cornea nicht myelinisiert sind. Etwa 70 bis 80 Nervenstämme münden strahlenförmig in die Hornhaut. Die epithelialen, nicht von Schwann-Zellen begleiteten Axone befinden sich parallel zur Basalmembran in einer Einstülpung des Basalplasmalemms der Basalzellen. Die meisten Axone enden hier. Einige Nerven reichen jedoch noch weiter bis fast zur Oberfläche in das Epithel hinein. Die weniger zahlreich vorhandenen Nervenfasern reagieren im Stroma ebenfalls auf äußere Stimuli, wie die Nerven im Epithel. Somit sind die Nerven im Stroma in der Lage, die Schutzfunktion der Nerven im Epithel bei deren Verlust zu ersetzen. Da zwischen den Nerven und dem Hornhautepithel eine Symbiose existiert, bewirken epitheliale Belastungen oder Traumata Veränderungen der Hornhautneurologie. Eine Schädigung der Nerven löst eine epitheliale Reaktion aus, die als Keratitis neuroparalytica bekannt ist. Bei dieser Art der Keratitis bemerkt der Betroffene die mangelnde Befeuchtung seines Auges wegen der fehlenden Sensibilität der Nerven nicht. Es bilden sich zunächst oberflächliche Läsionen gefolgt von größeren Epitheldefekten. Durch bakterielle Superinfektionen können sich dann Hornhautulzera bilden. Jede Schädigung der Nerven bringt ein erhöhtes Risiko mit sich, denn sie fungieren als ein lebenswichtiges Warnsystem für die Cornea. Deshalb ist ein Herabsetzen der Sensibilität der Hornhaut durch Kontaktlinsentragen ein unerwünschter Nebeneffekt.
Die Innervation ist Voraussetzung für den Kornealreflex, den unwillkürlichen Lidschluss mit vermehrter Produktion von Tränenflüssigkeit, nach mechanischer Hornhautirritation. Ferner werden von den Hornhautnerven Wachstumsfaktoren abgegeben, die wie ein intakter Tränenfilm für eine reguläre Erneuerung der Epithelschicht unabdingbar sind.
Untersuchungsmethoden

- Die Untersuchung durch den Augenarzt oder Augenoptikermeister erfolgt in der Regel mit einem Spaltlampenmikroskop. Der auf die Hornhaut projizierte Lichtspalt legt einen optischen Schnitt durch die Hornhaut, welcher mit verschiedenen Vergrößerungsstufen (6–40×, meist 16×) betrachtet wird.
- Die Endothelzellschicht kann isoliert mit einem Spiegelmikroskop dargestellt werden.
- Mit einem Topometer (auch „Videokeratograf“ oder „Topografiegerät“) kann die Hornhauttopografie gemessen werden.
- Die Hornhautkrümmungsradien werden bei der Keratometrie mittels Ophthalmometer gemessen.
- Ein Ästhesiometer misst die Hornhautsensibilität.
- Ein Pachymeter misst die Hornhautdicke.
- Die Tränenproduktion kann mittels Schirmer-Test gemessen werden.
- Die Tränenaufreißzeit (Break-Up-Time) misst die Güte des Tränenfilmes unter Gabe von Fluorescein und wird an der Spaltlampe gemessen.
- Der Seidel-Test wird ebenfalls an der Spaltlampe unter Gabe von Fluorescein durchgeführt.
- Mit dem Tonometer wird der Augeninnendruck gemessen. Diese werden als Contact- und Non-Contact-Tonometer verwendet, wobei das Goldmantonometer (Contacttonometer) wohl das genaueste ist.
- Der Heidelberg Retina Tomograph erstellt detaillierte Bilder des Zellgewebes in unterschiedlichen Tiefen der Hornhaut.
- Die Optische kohärenztomographie ist eine Untersuchungsmethode zur Darstellung der Hornhaut.[6]
Erkrankungen und Behandlungsmöglichkeiten

Fehlsichtigkeiten können bei vielen Patienten und in gewissen Grenzen durch Veränderung der Hornhautbrechkraft mittels refraktiver Chirurgie korrigiert werden, beispielsweise durch LASIK oder Photorefraktive Keratektomie.
Veränderungen der Hornhaut („Nebel“, „Fell“ und „Weißfleck“) wurden bereits von den Alten Griechen im Corpus Hippocraticum beschrieben. Die Abtragungen des Pannus und des Flügelfells sind schon von Rhazes beschriebene Operationen.[7] Krankheiten lassen sich unterteilen in Degenerationen (erworben), Dystrophien (vererbt, siehe Hornhautdystrophie) und Entzündungen (erworben, z. B. Herpeskeratitis, Akanthamoebenkeratitis, Hornhautulcus). In entsprechend indizierten Fällen kann ein Transplantat (Keratoplastik) eine erkrankte Hornhaut ersetzen.
Bei einem Mangel an Vitamin A kann es zur Hornhauterweichung, der Keratomalazie kommen.
Verbreitet sind ebenfalls oberflächliche Fremdkörperverletzungen des Epithels von unterschiedlicher Ausprägung, die unter dem Begriff der Hornhauterosion (erosio corneae) zusammengefasst werden.
Beim Keratokonus als häufigster Wölbungsanomalie der Hornhaut kommt es infolge einer Verdünnung zu einer kegelförmigen Vorwölbung. Bei der Fuchs-Endotheldystrophie führt ein Untergang der Endothelzellen zur Quellung der Hornhaut. Ein Sjögren-Syndrom führt dagegen zur Austrocknung.
Weitere Hornhautdeformitäten stellen Descemetozelen und Staphylome unterschiedlicher Ursachen dar.
Die Hornhaut kann zudem von einer Reihe von Infektionen befallen werden. Die Keratitis entsteht bei Hornhautverletzung (oder Immunschwäche) durch Bakterien (Pneumokokken, Pseudomonas, Moraxella), Viren (Herpes-simplex-Viren, Varizella-Zoster-Virus) oder Pilze (Candida, Aspergillus).
In manchen Fällen von Hornhautläsionen kann es zum Auftreten von monokularer Diplopie kommen.
Bei angeborenen Syndromen kann eine Vergrößerung der Hornhaut, eine Megalokornea vorliegen, z. B. beim Neuhäuser-Syndrom.
Literatur
- Theodor Axenfeld (Begründer), Hans Pau (Hrsg.): Lehrbuch und Atlas der Augenheilkunde. Unter Mitarbeit von Rudolf Sachsenweger u. a. 12., völlig neu bearbeitete Auflage. Gustav Fischer, Stuttgart u. a. 1980, ISBN 3-437-00255-4.
- Albert J. Augustin: Augenheilkunde. 3., komplett überarbeitete und erweiterte Auflage. Springer, Berlin u. a. 2007, ISBN 978-3-540-30454-8.
- Pschyrembel klinisches Wörterbuch. Mit klinischen Syndromen und Nomina Anatomica. = Klinisches Wörterbuch. Bearbeitet von der Wörterbuchredaktion des Verlages unter der Leitung von Christoph Zink. 256., neu bearbeitete Auflage. de Gruyter, Berlin u. a. 1990, ISBN 3-11-010881-X.
Weblinks
Einzelnachweise
- ↑ Harminder S. Dua, Lana A. Faraj, Dalia G. Said, Trevor Gray, James Lowe: Human Corneal Anatomy Redefined: A Novel Pre-Descemet's Layer (Dua's Layer). In: Ophthalmology, Mai 2013, ISSN 1549-4713, (elektronische Veröffentlichung vor dem Druck), PMID 23714320, doi:10.1016/j.ophtha.2013.01.018, Abstract.
- ↑ Scientists discover new layer of human cornea. UPI.com
- ↑ Harminder S. Dua, Lana A. Faraj, Dalia G. Said, Trevor Gray, James Lowe: Human Corneal Anatomy Redefined: A Novel Pre-Descemet's Layer (Dua's Layer). In: Ophthalmology. Mai 2013, ISSN 1549-4713, (elektronische Veröffentlichung vor dem Druck), PMID 23714320, doi:10.1016/j.ophtha.2013.01.018, Abstract.
- ↑ Peter Westphal, Johannes-Maria Kaltenbach, Kai Wicker: Corneal birefringence measured by spectrally resolved Mueller matrix ellipsometry and implications for non-invasive glucose monitoring. In: Biomed. Opt. Express, 2016, 7, S. 1160–1174; osapublishing.org
- ↑ Schätzungen zufolge werden rund 65 % der der Cornea zur Verfügung stehenden Glucose über die Glykolyse abgebaut. Davon ausgehend werden etwa 85 % über den anaeroben Weg (Embden-Meyerhof-Zyklus) abgebaut.
- ↑ Marcus Ang, Mani Baskaran, René M. Werkmeister, Jacqueline Chua, Doreen Schmidl: Anterior segment optical coherence tomography. In: Progress in Retinal and Eye Research. Band 66, September 2018, S. 132–156, doi:10.1016/j.preteyeres.2018.04.002 (elsevier.com [abgerufen am 11. November 2022]).
- ↑ Carl Hans Sasse: Geschichte der Augenheilkunde in kurzer Zusammenfassung mit mehreren Abbildungen und einer Geschichtstabelle. Ferdinand Enke, Stuttgart 1947, S. 20 und 28 f. (= Bücherei des Augenarztes, Heft 18)
Auf dieser Seite verwendete Medien
slit lamp image of cornea, iris and lens.
Autor/Urheber: Oculus333, Lizenz: CC BY-SA 4.0
Beschreibung der einzelnen Schichten der Hornhaut des menschlichen Auges.
Autor/Urheber: Talos, colorized by Jakov, Lizenz: CC BY-SA 3.0
Anatomie des Auges
1. Lederhaut (Sclera)
2. Aderhaut (Chorioidea)
3. Schlemm-Kanal (Sinus venosus sclerae/Plexus venosus sclerae)
4. Iriswurzel (Radix iridis)
5. Hornhaut (Cornea)
6. Regenbogenhaut (Iris)
7. Pupille (Pupilla)
8. vordere Augenkammer (Camera anterior bulbi)
9. hintere Augenkammer (Camera posterior bulbi)
10. Ziliarkörper (Corpus ciliare)
11. Linse (Lens)
12. Glaskörper (Corpus vitreum)
13. Netzhaut (Retina)
14. Sehnerv (Nervus opticus)
15. Zonulafasern (Fibrae zonulares)
Äußere Augenhaut (Tunica externa bulbi): 1. + 5.
Mittlere Augenhaut (Tunica media bulbi): 2. + 6. + 10.
Autor/Urheber: David Robinson, Lizenz: CC BY-SA 3.0
Human eye about 1 week after a Cornea transplant. The multiple light reflections indicate folds in the cornea, which later resolved.




