Hirnperfusionsszintigrafie

Die Hirnperfusionsszintigrafie (von lateinisch perfundere durchströmen, scintilla Funke[1] und altgriechisch γράφεινgráphein, deutsch ‚zeichnen, beschreiben‘) ist ein nuklearmedizinisches Verfahren zur zweidimensionalen und dreidimensionalen bildlichen Darstellung des regionalen zerebralen Blutflusses (engl. regional cerebral blood flow, rCBF).
Der zerebrale (gehirnbezogene) Blutfluss ist bei verschiedenen Erkrankungen in Teilen des Gehirns (regional) oder im gesamten Gehirn (global) erhöht, vermindert oder aufgehoben. Als Tracer dienen 99mTc-markierte Substanzen, die stark lipophil sind, sich rasch im Gehirn anreichern und dort lange verbleiben, insbesondere Hexamethylpropylenaminooxim (HMPAO) und 99mTc-Ethylcysteinat-Dimer (ECD).
Die Methode wird außerhalb spezialisierter Zentren nur noch selten angewendet, hat aber eine gewisse Bedeutung im Rahmen der Hirntoddiagnostik.
Grundlagen

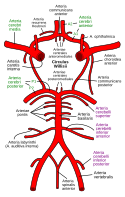
Das Gehirn wird über die rechte und linke Arteria carotis interna und die Arteria basilaris, die aus dem Zusammenfluss der rechten und linken Arteria vertebralis entsteht, mit Blut versorgt. Vorgenannte Gefäße speisen den Circulus arteriosus cerebri, aus dem wiederum die Arteria cerebri anterior, Arteria cerebri media und Arteria cerebri posterior entspringen, die vordere mittlere und hintere Anteile des Gehirns versorgen (siehe auch Blutversorgung des Gehirns). Der vollständige Ausfall der Durchblutung von Hirngewebe führt innerhalb weniger Minuten zum unumkehrbaren Untergang der Nervenzellen im betroffenen Gebiet (ischämischer Schlaganfall).
Die Funktion der Nervenzellen des Gehirns beruht auf ihrer elektrischen Aktivität, dem Aktionspotential, einem energieverbrauchenden Prozess. Um die notwendige Energie zur Verfügung zu stellen, brauchen Nervenzellen Sauerstoff (O2) und Glucose. Die Aktivierung bestimmter Hirnareale resultiert – über vermehrten Anfall von Kohlenstoffdioxid (CO2) – in einer Erweiterung der jeweils zuführenden Arteriolen und damit in einer erhöhten regionalen Durchblutung, wodurch die Substrate O2 und Glucose in ausreichender Menge zur Verfügung stehen.
Indikationen und Alternativen
Die Hirnperfusionsszintigrafie wird unter anderem bei folgenden Indikationen angewendet:
- Diagnose und Bewertung zerebrovaskulärer Erkrankungen
- Diagnose und Verlaufsbeurteilung bei vermuteter oder nachgewiesener Demenz folgender Formen: Alzheimer-Krankheit, Lewy-Körper-Demenz, Demenz bei Parkinson-Krankheit, subkortikale arteriosklerotische Enzephalopathie und frontotemporale Demenz; bereits in der Phase einer leichten kognitiven Beeinträchtigung können Auffälligkeiten in der Hirnperfusionsszintigrafie Informationen zu Art und Prognose der Erkrankung geben; als Alternative steht unter anderem die Positronen-Emissions-Tomografie mit 18F-Fluordesoxyglucose zur Verfügung
- Fokussuche bei Epilepsie (zum Beispiel vor Epilepsiechirurgie); als Alternative stehen die Elektroenzephalografie und die funktionelle Magnetresonanztomografie (fMRI) zur Verfügung
- Bewertung von bekanntem oder vermutetem Schädel-Hirn-Trauma; Auffälligkeiten in der Hirnperfusionsszintigrafie bei unauffälliger übriger Bildgebung (Magnetresonanztomografie, craniale Computertomografie) geben Hinweise auf die Prognose neuropsychologischer Symptome
- Bewertung einer vermuteten Entzündung wie Rasmussen-Enzephalitis, Virus-Enzephalitis (zum Beispiel Herpes-simplex-Enzephalitis), Vaskulitis (zum Beispiel systemischer Lupus erythematodes, Morbus Adamantiades-Behçet) oder HIV-Enzephalopathie
- Nachweis des zerebralen Zirkulationsstillstandes im Rahmen der Feststellung des Hirntods; als Alternative steht hier die transkranielle Dopplersonografie zur Verfügung
- wissenschaftliche Fragestellungen der regionalen Hirnfunktion; als alternative Methoden werden u. a. die Positronenemissionstomografie mit 15O-markierten Tracern (siehe unten) oder mit 18F-Fluordesoxyglucose und die funktionelle Magnetresonanztomografie (fMRI) eingesetzt
Kontraindikationen
Eine Schwangerschaft gilt mit wenigen Ausnahmen als absolute Kontraindikation für nuklearmedizinische Untersuchungen, Stillzeit als relative Kontraindikation. Nach einer Szintigrafie mit 99mTc soll die Stillende für 48 Stunden die Milch abpumpen und verwerfen. Ein unkooperativer oder nicht kooperationsfähiger Patient gilt ebenfalls als Kontraindikation für die Hirnperfusionsszintigrafie.
Radiopharmaka
Für die Szintigrafie und die Einzelphotonen-Emissionscomputertomografie (SPECT), die in der Routinediagnostik zahlreicher Krankenhäuser zur Verfügung stehen, werden stark lipophile Substanzen als Tracer verwendet, die eine hohe Extraktionsrate in das Gehirn aufweisen. Hier sind zum Beispiel 99mTc-Ethylcysteinat-Dimer (ECD, Handelsname Neurolite) und vor allem 99mTc-Hexamethylpropylenaminooxim (HMPAO, Handelsname Ceretec) zu nennen. Nach Anreicherung im Gehirn werden diese Substanzen innerhalb der Nervenzellen in eine hydrophile Form umgewandelt, die die jeweilige Zelle nicht mehr verlassen kann. Die Anreicherung – die überwiegend innerhalb der ersten zwei Minuten nach der Injektion stattfindet und während etwa vier Stunden weitgehend konstant bleibt – entspricht dabei dem Produkt aus Extraktionsrate und Blutfluss. Da die Extraktionsrate wiederum vom Blutfluss abhängt, lässt sich mit diesen Methoden der regionale zerebrale Blutfluss nicht quantifizieren, sondern nur relativ oder semiquantitativ darstellen.
Der regionale zerebrale Blutfluss lässt sich unter Verwendung von 15O-markierten Tracern – zum Beispiel 15O-markiertes Wasser (H215O) oder 15O-Butanol – im Rahmen der Positronen-Emissions-Tomografie (PET) quantifizieren. Die Angabe erfolgt üblicherweise in ml/100 mg/min. Da 15O eine Halbwertszeit von nur etwa 2 Minuten hat, stehen diese Tracer nur in unmittelbarer Nähe eines Zyklotrons und damit meist nur an Forschungseinrichtungen zur Verfügung.
18F-Fluordesoxyglucose steht wegen der längeren Halbwertszeit von 18F (etwa 110 Minuten) an wesentlich mehr Zentren zur Verfügung. Der regionale Gucoseverbrauch des Gehirns ist in vielen Fragestellungen der regionalen Durchblutung vergleichbar. Abweichungen gelten aber insbesondere bei Tumoren und Entzündungen.
Untersuchungsgang
Vorbereitung
Im Vorfeld der Untersuchung soll sichergestellt werden, dass der Patient später während der Aufnahmen, die etwa eine halbe Stunde dauern, ruhig liegen bleiben kann. Sowohl bei kognitiven Störungen (Demenz), als auch bei choreatischen Bewegungsstörungen kann dies eingeschränkt sein. Wenn für die Aufnahmen eine Sedierung notwendig ist, soll diese erst erfolgen, wenn die Anreicherung des Tracers im Gehirn abgeschlossen ist. Überhaupt sollen Substanzen, die den zerebralen Blutfluss beeinflussen können, vor der Untersuchung gemieden werden. Dazu gehören auch Koffein und Ethanol. Tabakrauchen und der Einsatz von Psychopharmaka sind zu vermeiden.
Applikation
Die Gabe (Applikation) des Tracers soll unter Bedingungen erfolgen, die eine Aktivierung bestimmter Hirnareale möglichst vermeidet: Es wird empfohlen, das Radiopharmakon über einen peripheren Venenverweilkatheter zu verabreichen, der etwa 10 bis 15 Minuten vor der Applikation gelegt wurde. Der Raum soll ruhig sein und gedämpftes Licht haben, um eine Aktivierung zum Beispiel des visuellen Cortex zu verhindern. Der Patient soll die Augen geöffnet haben und keine Kopfhörer oder Gehörschutz tragen, nicht sprechen, nicht lesen und insgesamt ruhig liegen.
Bildakquisition und -rekonstruktion
Der Patient ist während der Aufnahmen möglichst bequem zu lagern, der Kopf soll leicht fixiert werden, damit Artefakte durch Bewegung minimiert werden. Der Bequemlichkeit des Patienten ist aber gegenüber einer optimalen Kopfposition Vorrang einzuräumen, da eine unbequeme Position die Wahrscheinlichkeit für versehentliche Bewegungen erhöht. Der Abstand zwischen Kopf und Kamera soll für eine gute Ortsauflösung möglichst gering sein. Die Bildakquisition kann theoretisch bereits etwa 2 Minuten nach intravenöser Gabe des Tracers beginnen, da dann die Fixierung von HMPAO und ECD im Gehirn abgeschlossen ist. Diese Fixierung bleibt über etwa 4 Stunden annähernd konstant; entsprechend soll die Bildakquisition dann abgeschlossen sein. Die beste Bildqualität wird nach 30 bis 60 Minuten (ECD) beziehungsweise 30 bis 90 Minuten (HMPAO) erzielt. Da für eine gute Bildqualität wenigstens 5 Millionen registrierte Ereignisse gefordert werden, ist bevorzugt eine Gammakamera mit mehreren Köpfen einzusetzen. Bei Ein-Kopf-Kameras ist die Aufnahmezeit entsprechend zu verlängern. Je nach Anzahl der Kameraköpfe beträgt die Aufnahmezeit typischerweise zwischen 20 und 60 Minuten.
Die Rekonstruktion erfolgt in drei Raumebenen, möglichst ohne Verkippung in der Transversalebene. Tiefpassfilter reduzieren das Bildrauschen, verschlechtern aber die Bildauflösung. Zur Beurteilung von tiefliegenden Strukturen des Gehirns, wie den Basalganglien und dem Thalamus, ist eine Schwächungskorrektur anzuwenden.
Interpretation
Beim Normalbefund ist die Anreicherung des Tracers in die graue Substanz zwei- bis dreimal höher als diejenige in die weiße Substanz. Die höchste Anreicherung lässt sich im Thalamus, im Striatum und im visuellen Cortex feststellen. Bei jungen Menschen ist die Anreicherung im präfrontalen Cortex höher als im parietalen Cortex, während sich in höherem Lebensalter das Verteilungsmuster angleicht. Eine leichte Asymmetrie ist als normal anzusehen.
Die Bildanalyse erfolgt zunächst visuell („mit bloßem Auge“). Die Einstellungen zur Bilddarstellung wie Farbskala und Schwellenwert sollte der Untersucher möglichst immer einheitlich wählen, um die Bildung von Engrammen für normale und pathologische Befunde zu unterstützen. Die Kenntnis aktueller Befunde struktureller Bildgebung (Magnetresonanztomografie, craniale Computertomografie), gegebenenfalls auch die Bildfusion mit diesen Aufnahmen, vereinfacht die Interpretation. Zu beachten sind außerdem die Anamnese des Patienten (einschließlich einer aktuellen und früheren Medikation und stattgehabter Schädel-Hirn-Traumata) und die Ergebnisse der neurologischen, psychiatrischen und neuropsychologischen Tests (wie beispielsweise der Mini-Mental-Status-Test).
Partialvolumeneffekte können die Interpretation erschweren. Eine Verminderung der Nervenzelldichte oder eine Verminderung der Aktivität der Nervenzellen einer Region stellen sich – wie der eigentlich zu messende verminderte Blutfluss – als verminderte Traceranreicherung dar.
Der regionale zerebrale Blutflusses (rCBF) kann mittels einfacher Methoden wie der Region-of-Interest-Technik im Vergleich zur Gegenseite oder im Vergleich zu bestimmten Regionen (Kleinhirn, gleiche Hemisphäre, gesamtes Gehirn) semiquantitativ bestimmt werden oder mit komplexen Methoden wie der pixelweisen dreidimensionalen Kartierung (zum Beispiel nicht-lineare Datentransformation auf Talairach-Atlanten) und Bestimmung der statistischen Abweichung vom Mittelwert eines dem Alter des Patienten entsprechenden Normalkollektivs quantitativ bestimmt werden. Hierzu existieren verschiedene Softwarepakete, die eine Schnittbild- oder Oberflächenanalyse durchführen. Wurden mehrere Bilderserien erstellt, können Subtraktionsaufnahmen pathologische Befunde deutlicher herausstellen.
Eine innere Hirnatrophie zeigt sich an einem vergrößerten Abstand zwischen Thalamus und Nucleus caudatus. Die äußere Hirnatrophie stellt sich als Erweiterung der Hirnfurchen (Sulci) zuungunsten der Hirnwindungen (Gyri). Die Hirnrinde stellt sich bei Hirnatrophie insgesamt inhomogen dar. Der Vergleich mit einer aktuellen Magnetresonanztomografie des Patienten kann bei der Bildinterpretation hilfreich sein.
Untersuchungsgang bei besonderen Fragestellungen
Fokussuche bei Epilepsie
Die intravenöse Injektion des Radiopharmakons erfolgt während des Anfalls (iktal), bei hoher Anfallshäufigkeit gegebenenfalls unter laufender Ableitung eines Elektroenzephalogramm (EEG). Die Bildakquisition (SPECT) kann nach dem Anfall durchgeführt werden, bis zu vier Stunden nach dem Ereignis. Der Vergleich mit einer Untersuchung im anfallsfreien Intervall (interiktal) – gegebenenfalls als Subtraktionsaufnahme – kann bei der Interpretation hilfreich sein.
Diagnostik der zerebralen Durchblutungsreserve
Die Bestimmung der zerebralen Durchblutungsreserve kann in folgenden Situationen sinnvoll sein: Transitorische ischämische Attacke (TIA), Schlaganfall, Verengung oder Verschluss der Arteria carotis communis oder Arteria carotis interna (Carotiden), Gefäßanomalien, Verlaufskontrolle nach Operation der Carotiden, Frage nach der Notwendigkeit der Anlage eines Shunts vor Endarteriektomie der Carotiden, Bestimmung der Durchblutungsreserve vor und nach Operation oder Stentangioplastie im Bereich der hirnversorgenden Gefäße, Unterscheidung vaskulärer und neuraler Formen der Demenz.
Etwa 10 Minuten vor Gabe des Radiopharmakons wird Acetazolamid – ein Carboanhydrasehemmer – intravenös verabreicht (Off-Label-Use). Als Nebenwirkungen kommen Schwindel, Tinnitus, Parästhesien um den Mund, Übelkeit und Blutdruckabfall vor. Die Beschwerden sind meist milde und klingen von alleine wieder ab. Absolute Kontraindikationen gegen den Einsatz von Acetazolamid sind Allergien gegen Sulfonamide und das subakute Stadium des Schlaganfalls. Als relative Kontraindikationen gelten Migräne, Niereninsuffizienz und Leberinsuffizienz. Acetazolamid erhöht die arterielle Kohlenstoffdioxidkonzentration. In gesundem Hirngewebe führt dies zu einer Erweiterung (Dilatation) der Arteriolen und einer deutlichen Steigerung des Blutflusses. In denjenigen Hirnarealen, deren vorgeschaltete Gefäße Verengungen aufweisen, sind zur Kompensation die Arteriolen bereits maximal erweitert, sodass hier keine Steigerung mehr stattfinden kann und die sich betroffenen Gebiete im Szintigramm als minderspeichernd darstellen.
Der Vergleich mit einer Bilderserie ohne den Einsatz von Acetazolamid – gegebenenfalls als Subtraktionsaufnahme – kann bei der Bildinterpretation hilfreich sein.
Hirntoddiagnostik

Die Hirnperfusionsszintigrafie wird im Rahmen der Diagnostik zur Feststellung des Hirntods eingesetzt. Der Nachweis des Ausfalls der Hirndurchblutung mittels Hirnperfusionsszintigrafie oder transkranieller Dopplersonografie belegt dabei die Irreversibilität (Unumkehrbarkeit) des Hirnfunktionsausfalls ohne weitere Beobachtungszeit, die zum Beispiel bei ausschließlicher klinisch-neurologischer Untersuchung notwendig ist und die bei Kindern und Säuglingen bis zu 72 Stunden betragen kann.
Folgende Befunde gelten als szintigrafische Kriterien des Hirntods: fehlende Darstellung der zerebralen Gefäße, fehlende Darstellung der zerebralen Durchblutung, fehlende Anreicherung im Hirngewebe (leerer Schädel, empty skull). Es kommt zu einer Umverteilung des Blutflusses in das Strömungsgebiet der Arteria carotis externa und einer vermehrten Anreicherung des Tracers im Bereich der Nase (hot nose).[2]
Die deutsche Leitlinie zur Hirntoddiagnostik verlangt den Einsatz von Hexamethylpropylenaminooxim (HMPAO). Es soll eine radiochemische Qualitätskontrolle durchgeführt und dokumentiert werden. Hierbei muss die radiochemische Reinheit des Präparates mindestens 90 % betragen. Wenn zweidimensionale (planare) Aufnahmen aus verschiedenen Blickrichtungen (Projektionen) vorliegen, kann auf eine dreidimensionale Darstellung (SPECT) verzichtet werden. Zusätzliche planare Aufnahmen des Brustkorbs und des Bauchraumes werden empfohlen, um eine normale Verteilung des Tracers als In-vivo-Qualitätskontrolle zu dokumentieren.
Verwendete Aktivitäten und Strahlenexposition
Die Leitlinien der Deutschen Gesellschaft für Nuklearmedizin und der European Association of Nuclear Medicine (EANM) sehen für die 99mTc-markierten Radiopharmaka zu verabreichende Aktivitäten bis 1100 MBq vor. Deutlich niedrigere Aktivitäten können insbesondere bei Verwendung von hochauflösenden Kollimatorsystemen (zum Beispiel im Rahmen der Fokussuche vor Epilepsiechirurgie) zu mangelhafter Bildqualität führen.
Als Strahlenexposition werden für 99mTc-Ethylcysteinat-Dimer (ECD) 0,0077[3] bis 0,011[4] mSv/MBq (Erwachsene) und 0,023 mSv/MBq (5-jähriges Kind) und für 99mTc-Hexamethylpropylenaminooxim (HMPAO) 0,0093 mSv/MBq (Erwachsene) beziehungsweise 0,026 mSv/MBq (5-jähriges Kind) angegeben. Als „kritisches Organ“ – das Organ, das die höchste Organdosis erhält – gelten für ECD die Wand der Harnblase und für HMPAO die Niere (Erwachsene) beziehungsweise die Schilddrüse (5-jähriges Kind).
Die Strahlenexposition bei der Verwendung von 15O-markiertem Wasser in der Positronen-Emissions-Tomografie (PET) wird mit 0,00093 mSv/MBq angegeben. Bei einer verabreichten Aktivität von 1.000 MBq beträgt die effektive Dosis 0,93 mSv.[5]
Ausblick
Vereinfachte Bildinterpretation und verbesserte Bildqualität sind von der zunehmenden verbreiteten Kombination von Einzelphotonen-Emissionscomputertomografie und Computertomografie (SPECT/CT) zu erwarten. Vorteilhaft ist die bei dieser Kombinationsmethode grundsätzlich anfallende Schwächungskorrektur. Ein weiteres Verfahren der gleichzeitigen Bildakquisition mit zwei Verfahren (Modalitäten), das aber (Stand 2013) noch keine nennenswerte Verbreitung gefunden hat, ist die Kombination von Magnetresonanztomografie und SPECT (MRI/SPECT). Die (nahezu) gleichzeitige Erhebung von strukturellen und funktionellen Bilddaten in gleicher Position des Patienten macht die wegen zum Teil fehlender anatomischer Landmarken grundsätzlich fehlerbehaftete nachträgliche Bildfusion überflüssig. Aufgaben für die Zukunft sind die Erhebung aussagekräftiger Normalkollektive – im Prinzip für jede Altersgruppe und jedes Kamerasystem – und die Verbesserung der Methoden zur Quantifizierung der Befunde.
Literatur
- Torsten Kuwert: Gehirn. In: Torsten Kuwert, Frank Grünwald, Uwe Haberkorn, Thomas Krause: Nuklearmedizin. 4., neu erstellte und erweiterte Auflage. Thieme, Stuttgart u. a. 2008, ISBN 978-3-13-118504-4, S. 231–257.
- Özlem L. Kapucu, Flavio Nobili u. a.: EANM procedure guideline for brain perfusion SPECT using 99mTc-labelled radiopharmaceuticals, version 2. In: European Journal of Nuclear Medicine and Molecular Imaging. 36, 2009, S. 2093–2102, doi:10.1007/s00259-009-1266-y.
- Christian Menzel, Peter Bartenstein u. a.: Leitlinie für die Hirnperfusions-SPECT mit Technetium-99m-Radiopharmaka. (Online bei der Deutschen Gesellschaft für Nuklearmedizin, nuklearmedizin.de)
- Wissenschaftlicher Beirat der Bundesärztekammer: Richtlinien zur Feststellung des Hirntodes. Deutsches Ärzteblatt 95, Heft 30, 24. Juli 1998 (bundesaerztekammer.de PDF, 103 kB).
Einzelnachweise
- ↑ Der Kleine Stowasser, München 1971
- ↑ G. Hoglinger, Stefan Kleinert: Hirntod und Organtransplantation. Walter de Gruyter, 1998, ISBN 978-3-11-016203-5 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Özlem L. Kapucu, Flavio Nobili u. a.: EANM procedure guideline for brain perfusion SPECT using 99mTc-labelled radiopharmaceuticals, version 2. In: European Journal of Nuclear Medicine and Molecular Imaging. 36, 2009, S. 2093–2102, doi:10.1007/s00259-009-1266-y.
- ↑ Torsten Kuwert: Gehirn. In: Torsten Kuwert, Frank Grünwald, Uwe Haberkorn, Thomas Krause: Nuklearmedizin. 4., neu erstellte und erweiterte Auflage. Thieme, Stuttgart u. a. 2008, ISBN 978-3-13-118504-4, S. 237.
- ↑ W. Sonnenschein, A. Bockisch: Strahlenschutz. In: Torsten Kuwert, Frank Grünwald, Uwe Haberkorn, Thomas Krause: Nuklearmedizin. 4., neu erstellte und erweiterte Auflage. Thieme, Stuttgart u. a. 2008, ISBN 978-3-13-118504-4, S. 71.
Auf dieser Seite verwendete Medien
Autor/Urheber: Kieran Maher, Lizenz: Copyrighted free use
A SPECT slice of the distribution of 99m-Tc Ceretec within a patient's brain.
Schematische Darstellung der hirnversorgenden Arterien mit deren Seitenästen (lateinische Bezeichnungen).
Autor/Urheber: Drahreg01, Lizenz: CC BY-SA 3.0
Hirnperfusionsszintigrafie bei einem gesunden Probanden.
Autor/Urheber: Drahreg01, Lizenz: CC BY-SA 3.0
Hirnperfusionsszintigrafie zum Nachweis des Hirntods. Fehlende Darstellung einer Hirnperfusion.