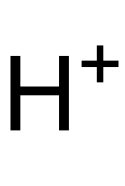Hexafluorphosphorsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexafluorphosphorsäure | |||||||||||||||
| Andere Namen | Hexafluorophosphorsäure | |||||||||||||||
| Summenformel | HPF6 | |||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 145,97 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||
| Dichte | 1,77 g·cm−3[2] | |||||||||||||||
| Löslichkeit | mischbar mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Hexafluorphosphorsäure ist eine chemische Verbindung aus der Gruppe der anorganischen Säuren bzw. Phosphor- und Fluorverbindungen. Das handelsübliche Produkt ist eine 60–70%ige Lösung.
Gewinnung und Darstellung
Wasserfreie Hexafluorphosphorsäure kann durch Reaktion von Fluorwasserstoff mit Phosphorpentafluorid gewonnen werden,[3] wobei Diethylether als Lösungsmittel dienen kann[4]:
Auch eine Darstellung aus Phosphorpentachlorid ist möglich, wenn man auf 110 °C erhitzt:[4]:
Wasserhaltige Hexafluorphosphorsäure kann auch durch Reaktion von Phosphorsäure oder Phosphorpentoxid mit Fluorwasserstoff bzw. Phosphorsäure mit Calciumfluorid und Schwefelsäure gewonnen werden.[5]
Eigenschaften
Hexafluorphosphorsäure ist nur in Lösung stabil. Die wässrige Lösung ist farblos, reagiert sauer (Brønsted-Säure) und kann bis zu einer Konzentration von etwa 75 % konzentriert werden. Hexafluorphosphorsäure zersetzt sich bei erhöhten Temperaturen und setzt dabei Fluorwasserstoff frei.[1] Das Hydrat wird als „Kristalline Hexafluorphosphorsäure“ bezeichnet. Dabei sind die PF6−-Ionen durch Oktaederstümpfe eingeschlossen, welche nach früheren Annahmen durch Wassermoleküle gebildet werden. Die Kernspinresonanzspektroskopie und chemische Analysen liefern aber Hinweise, dass das Gitter des Hydrates signifikante Mengen von Fluorwasserstoff und Hydroniumionen enthält, auch an Plätzen, die vorher dem Wasser zugeordnet wurden.[6]
In der Umwelt ist das Hexafluorophosphat-Anion persistent und mobil.[7]
Verwendung
Hexafluorphosphorsäure wird als Katalysator bei der Photopolymerisation verwendet.[1]
Sehr viele Salze der Hexafluorphosphorsäure werden für die Forschung, z. B. die Peptidsynthese, oder für technische Anwendungen hergestellt und kommerziell vertrieben, wie im Artikel Hexafluorophosphate näher beschrieben. Beispielsweise kommen sie auch in ionischen Flüssigkeiten zum Einsatz.[8] Das wichtigste Salz ist das Lithiumhexafluorophosphat. Dieses wird gelöst in organischen Lösungsmitteln mit Konzentrationen von 1 mol/l oder mehr in Lithiumionenakkumulatoren verwendet und liefert dort die Lithiumionen für die Reaktionen der Elektroden. Gleichzeitig sorgt es für eine sehr gute elektrische Leitfähigkeit und eine geeignete Passivierung der verwendeten Aluminium-Stromzuführungen.
Weblinks
- Patent US6540969B1: Preparation of hexafluorophosphoric acid. Angemeldet am 28. November 2000, veröffentlicht am 1. April 2003, Anmelder: Lithdyne LLC, Erfinder: Novis W. Smith, Joel McCloskey.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Hexafluorphosphorsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ Datenblatt Hexafluorphosphorsäure bei Alfa Aesar, abgerufen am 15. April 2010 (Seite nicht mehr abrufbar).
- ↑ George A. Olah, G. K. Surya Prakash, Arpad Molnar, Jean Sommer: Superacid Chemistry. 2. Auflage. Wiley-Interscience, Hoboken NJ 2009, ISBN 978-0-471-59668-4, S. 44.
- ↑ a b Patent DE812247: Herstellung von Hexafluorphosphorsäure und deren Salzen. Angemeldet am 31. März 1949, veröffentlicht am 27. August 1951, Anmelder: Farbenfabriken Bayer, Leverkusen, Erfinder: Heinz Jonas.
- ↑ Patentanmeldung EP1394108A1: Herstellung von Hexafluorophosphorsäure. Angemeldet am 19. August 2002, veröffentlicht am 3. März 2004, Anmelder: Lithdyne LLC, Erfinder: Novis W. Smith, Joel McCloskey.
- ↑ D. W. Davidson, S. K. Garg: The Hydrate of Hexafluorophosphoric Acid. In: Canadian Journal of Chemistry. Band 50, Nr. 21, 1. November 1972, S. 3515–3520, doi:10.1139/v72-565.
- ↑ Isabelle Neuwald, Matthias Muschket, Daniel Zahn, Urs Berger, Bettina Seiwert: Filling the knowledge gap: A suspect screening study for 1310 potentially persistent and mobile chemicals with SFC- and HILIC-HRMS in two German river systems. In: Water Research. Band 204, 1. Oktober 2021, S. 117645, doi:10.1016/j.watres.2021.117645.
- ↑ Jennifer L. Anthony, Edward J. Maginn, Joan F. Brennecke: Solubilities and Thermodynamic Properties of Gases in the Ionic Liquid 1-n-Butyl-3-methylimidazolium Hexafluorophosphate. In: The Journal of Physical Chemistry B. Band 106, Nr. 29, 1. Juli 2002, S. 7315–7320, doi:10.1021/jp020631a.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Hexafluorphosphat
Struktur des H+-Ions (Proton)