Hexafluoraceton
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexafluoraceton | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit stechendem Geruch (Sesquihydrat)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
| |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | −26 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | Schweiz: 0,1 ml·m−3 bzw. 0,7 mg·m−3[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Hexafluoraceton (HFA) ist ein Derivat des Acetons, bei dem alle Wasserstoffatome durch Fluor ersetzt sind. Als Feinchemikalie ist es im Handel als Sesquihydrat[5], also mit formal 1,5 Wassermolekülen pro Molekül.
Es dient als Baustein bei der Synthese fluorhaltiger organischer Verbindungen. So werden durch Umsetzung mit Aromaten Vernetzungsmittel für Kautschuke sowie Monomere für die Herstellung von Polyamiden erzeugt.[6] Weiterhin findet das Deutero-Hydrat als NMR-Lösungsmittel und als Reagenz in der Schutzgruppen-Technik Verwendung.
Herstellung
Zur Herstellung von Hexafluoraceton wird technisch zumeist die Isomerisierung von Hexafluor-1,2-epoxypropan gewählt. So erhält man es durch Umsetzung in Gegenwart von lewis-sauren Katalysatoren wie Al2O3, TiO2, WO2, AlCl3, AlBr3, SnCl4, VOCl3, TiCl4, FeCl3, CuCl2 oder ZrOCl2.[7]
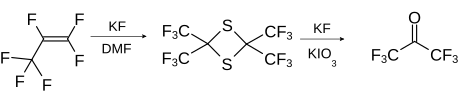
Eine Labormethode beruht auf der Umsetzung von Perfluorpropen mit Schwefel und Kaliumfluorid und anschließender Ringöffnung des Dithietans mit Kaliumfluorid und Kaliumiodat zum HFA.[8]
Eigenschaften
Im Hexafluoraceton ist das Carbonyl-Kohlenstoffatom durch seine benachbarten Trifluormethyl-Reste sehr elektronenarm und daher gegenüber Nucleophilen wie selbst Aromaten oder Olefinen reaktionsfähig. Mit Wasser bilden sich stabile Hydrate. Analog reagiert HFA mit Ammoniak zu den entsprechenden Halbaminalen (CF3)2C(OH)(NH2), deren Dehydratisierung mit Phosphoroxychlorid (POCl3) das Hexafluor-2-propylimin (CF3)2CNH liefert.[9]
Da HFA keine zur Carbonylgruppe benachbarten Wasserstoffatome hat, zeigt es kein zur Keto-Enol-Tautomerie vergleichbares Verhalten.
Verwendung
Eine Bedeutung hat HFA als elektrophiles Reagenz für die Substitution an Aromaten. So reagiert es meist in Gegenwart von Säuren zu den entsprechenden Hexafluor-2-hydroxy-2-aryl-verbindungen, die als Zwischenprodukte in der Wirkstoffsynthese dienen.[10]
Das Hydroperoxid des HFA, also das Wasserstoffperoxid-Addukt, ist ein potentes Epoxidierungsmittel.[11]
Die Reduktion von HFA mit Lithiumaluminiumhydrid oder Natriumborhydrid liefert das wichtige Lösungsmittel Hexafluor-2-propanol. Diese Reduktion gelingt auch durch katalytische Hydrierung (z. B. mit Wasserstoff).
Einzelnachweise
- ↑ a b c d e Datenblatt Hexafluoraceton (PDF) bei Merck, abgerufen am 14. Februar 2015.
- ↑ a b c d Datenblatt Hexafluoroacetone bei Sigma-Aldrich, abgerufen am 3. April 2011 (PDF).
- ↑ a b Eintrag zu Hexafluoraceton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Hexafluoraceton), abgerufen am 4. März 2020.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Hexafluoraceton-Sesquihydrat: CAS-Nummer: 13098-39-0, EG-Nummer: 670-379-0, ECHA-InfoCard: 100.196.107, PubChem: 3032602, ChemSpider: 2297537, Wikidata: Q27275779.
- ↑ C. G. Krespan, W. J. Middleton, In: Fluorine Chem. Rev., 1, 1967, S. 145.
- ↑ U.S.-Patent 3.321.515.
- ↑ M. Van Der Puy, Louis G. Anello: Hexafluoracetone In: Organic Syntheses. 63, 1985, S. 154, doi:10.15227/orgsyn.063.0154; Coll. Vol. 7, 1990, S. 251 (PDF).
- ↑ W. J. Middleton, H. D. Carlson: Hexafluoroacetone Imine In: Organic Syntheses. 50, 1970, S. 81, doi:10.15227/orgsyn.050.0081; Coll. Vol. 6, 1988, S. 664 (PDF).
- ↑ H. Hacklin: Phosphorinane: Synthesen, Eigenschaften und Verhalten gegenüber Hexafluoraceton, Universität Bremen, Dissertations Druck, Darmstadt, 1987.
- ↑ Waldemar Adam, Chantu R. Saha-Möller, Pralhad A. Ganeshpure: Synthetic Applications of Nonmetal Catalysts for Homogeneous Oxidations. In: Chemical Reviews. 101, 2001, S. 3499–3548, doi:10.1021/cr000019k.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
reduction of hexafluoraceton
Autor/Urheber: Roland Mattern, Lizenz: CC-BY-SA-3.0
Isomere des Hexafluoraceton
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances