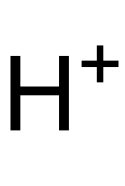Hexachloroiridiumsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexachloroiridiumsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
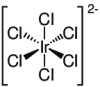
| Summenformel | H2[IrCl6] | |||||||||||||||
| Kurzbeschreibung | schwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 406,95 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 1,02 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | löslich in Wasser und Alkohol[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Hexachloroiridiumsäure ist eine anorganische chemische Verbindung aus der Gruppe der Säuren.
Gewinnung und Darstellung
Hexachloroiridiumsäure kann durch Reaktion einer Lösung von Ammoniumhexachloroiridat mit Chlor gewonnen werden.[3]
Es kann auch durch Auflösung von Ammoniumhexachloroiridat(IV) in Königswasser und anschließende Erwärmung gewonnen werden.[2]
Eigenschaften
Hexachloroiridiumsäure ist ein schwarzer Feststoff.[1] Sie liegt in Form von langen rötlichschwarzen Nadeln vor, die leicht löslich in Wasser und Alkohol mit rotbrauner Farbe sind.[2]
Verwendung
Hexachloroiridiumsäure katalysiert die elektrochemische Synthese von Polyanilin auf der Oberfläche von Nichtedelmetallelektroden. Sie bei der Bildung von Iridium-substituierten Polyoxometallaten vom Dawson- und Keggin-Typ verwendet, indem die freie Stelle der Lacunary-Precursoren wieder aufgefüllt wird.[1]
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Hydrogen hexachloroiridate(IV) hydrate, 99.98% trace metals basis bei Sigma-Aldrich, abgerufen am 17. Februar 2018 (PDF).
- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 683.
- ↑ Georg Brauer: Handbook of Preparative Inorganic Chemistry. Elsevier, 2012, ISBN 978-0-323-16129-9, S. 1593 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Struktur des Hexachloroiridat(IV)-Ions
Struktur des H+-Ions (Proton)
Die Zahl 2