Polyoxometallate

Polyoxometallate (abgekürzt POM) sind eine Stoffgruppe, die polyatomische Anionen besitzen. Diese sind aus drei oder mehr Übergangsmetall-Oxyanionen (etwa Vanadat oder Wolframat) aufgebaut und über Sauerstoff-Atome verbrückt. Sie können so ein großes, geschlossenes, dreidimensionales Netzwerk bilden.
Die Metall-Atome sind üblicherweise Übergangsmetalle der Gruppen 5 oder 6 in hohen Oxidationszahlen, das heißt, ihre Elektronenkonfiguration ist d0 oder d1. Beispiele sind Vanadium(V), Niob(V), Tantal(V), Molybdän(VI), und Wolfram(VI), wobei die größte Zahl der heute bekannten Polyoxometallate aus den beiden letztgenannten Metallen aufgebaut sind.
Die Polyoxometallate können in zwei Gruppen unterteilt werden: Heteropolyanionen und Isopolyanionen. Heteropolyanionen sind Metall-Cluster mit eingeschlossenen Heteroanionen, wie dem Sulfat- oder dem Phosphation. Isopolyanionen sind reine Metalloxid-Netzwerke ohne Heteroatome. Sie sind oft weniger stabil als ihre Heteropolyanion-Gegenstücke.[1] Zusammen mit aziden Wasserstoffionen bilden Polyoxometallate die Heteropolysäuren, welche als Katalysatoren Verwendung finden.
Darstellung
Die Darstellung der Polymetallate kann auf zwei Wegen erfolgen: Einerseits durch die Protonierung eines Oxoliganden des Metallkations in sauerer Lösung, dabei entsteht ein H2O-Ligand, der vom zentralen Metallatom abgespalten werden kann und so zu einer Kondensation der einkernigen Oxometallate führt[2] (vgl. Abb.) und andererseits durch die Kondensationsreaktion von Polysäuren im basischen. Je nach pH-Wert der Lösung entstehen dabei verschieden große Gerüste von Polyoxometallaten.
Bindungsverhalten




Das wohl bekannteste Beispiel für die Kondensationsreaktion zwischen Metalloxiden ist die Bildung von Dichromat aus zwei Chromat-Anionen, wobei sich unter Wasserabspaltung das sauerstoffverbrückte Dichromat-Anion bildet. In sehr saurer Lösung bilden sich auch längerkettige, sauerstoffverbrückte Polychromate. Die Neigung zur Bildung solcher Spezies wird aber dadurch eingeschränkt, dass sich die Chromate ausschließlich über die Ecken ihrer Tetraeder verbinden. Eine Verbindung über Kanten und Flächen würde zu einer Annäherung der Metallzentren führen, was für das Chromkation thermodynamisch ungünstig wäre.[2] Das Chrom(VI) bevorzugt die Koordinationszahl 4, wohingegen einige seiner Nachbarelemente (in den Gruppen 5 und 6), wie zum Beispiel Molybdän und Wolfram, die sich ebenfalls in der Oxidationsstufe +VI befinden, die sechsfache Koordinierung bevorzugen.[4] Dennoch kommen vorwiegend die kleineren Poly-molybdate/-wolframate als tetraederverknüpfte Einheiten vor. Größere Strukturen enthalten dann auch die thermodynamisch für z. B. Molybdän günstigere, oktaedrisch koordinierte Metallkationen. Die Umwandlung von tetraedrischen in oktaedrische Einheiten kann während der Kondensation stattfinden; allerdings können die Einheiten der Polyoxometallate auch schon vorher als Oktaeder vorliegen.[5]
Die Strukturen von Polyoxometallaten können zwei Typen von verbrückenden Sauerstoffatomen enthalten, zum einen die -M-(OH)-M-Verbindung (Reaktionstypus: Olation) und die -M-O-M Verbindung (Reaktionstypus: Oxolation).[6] Die Bildung von Polyoxometallaten ist in den Gruppen 5 und 6 bei Vanadium(V), Molybdän(VI) und Wolfram(VI) am stärksten ausgeprägt (aufgrund ihrer geringen 5. bzw. 6. Ionisierungsenergie und des Ionenradius).[2][7]
Die strukturellen und chemischen Eigenschaften, sowie die Stabilität vieler Polyoxometallate sind so verschieden, dass es schwierig ist, eine allgemeine und verständliche Beschreibung ihrer Synthese zu liefern, auch wenn es einige gut bekannte Spezies gibt.[8] Es erweist sich daher oft als vorteilhaft, die Strukturen der Metallat-Ionen als Polyeder darzustellen. Dabei befindet sich das Metallkation in der Mitte und die Sauerstoffatome an den Ecken (Bezogen auf die Grundeinheiten der Polyoxometallate, die Tetra- und Oktaeder). Die Polyspezies können durch eine Ecken-, Kanten- oder Flächenverknüpfung entstehen. So lässt sich unter anderem die wichtige M6O19-Struktur von u. a. [Mo6O19]6-, sowie die M7O24-Struktur von u. a. [Mo7O24]2- durch Polyederstrukturen darstellen.[9]
Die Strukturen der Polyeder (mit Heteroatomen) werden zumeist nach ihrem Entdecker benannt, da andere Benennungsmethoden sich als kompliziert und schwierig erwiesen haben. Erwähnenswert seien an dieser Stelle das Keggin-, Anderson- und Dawson-Ion. So stellt z. B. Die Keggin-Struktur eine Hohlkugel aus 12MO6-Oktaedern dar, in dessen Zentrum sich das Heteroatom befindet.
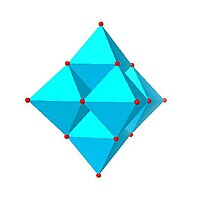 |  | 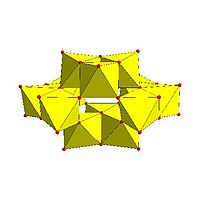 |  |
| Lindqvist-Hexamolybdate, | Decavanadat, | Parawolframat B, | Mo36-polymolybdat, |
 |  |  | |
| Strandberg-Struktur, | Keggin-Struktur, | Dawson-Struktur, | |
 |  |  |  |
| Anderson-Struktur, | Allman-Waugh-Struktur, | Weakley-Yamase-Struktur, | Dexter-Silverton-Struktur, |
Arten
Polyoxovanadate

Polyoxovanadate (POVs) gehören zur Gruppe der Polyoxometallate (POMs), sie bestehen im Allgemeinen aus mehreren [MOx]-Einheiten (mit M = V, Nb, Mo, Ta, W und x = 4 – 7). Meistens weisen sie eine oktaedrische oder quadratisch pyramidale Koordinationsgeometrie auf. Die Metallzentren liegen häufig in einer d0 oder d1 [Elektronen-Konfiguration] vor. Die POVs weisen eine große Vielfalt an Spezies auf. Weiterhin besteht auch die Möglichkeit des Einbaus von Heteroatomen in Polyoxovanadatanionen. Häufig sind in den Strukturen einige Vanadium-Atome durch beispielsweise Arsen, Antimon, Germanium oder Silicium ersetzt, so dass die sogenannten Heteropolyanionen gebildet werden. Weiterhin ist es möglich organischen Molekülen oder Übergangsmetall-Komplexen an die POVs zu binden. Daraus resultieren neue physikalische und chemische Eigenschaften.[10]
Im Gegensatz zu den Pendants mit Molybdän oder Wolfram werden Polyoxovanadate oftmals solvothermal hergestellt. Für die Entstehung der Polyoxovanadate sind sehr viele Syntheseparameter entscheidend. Unter anderem auch der pH-Wert, da sich einzelne Spezies durch Änderung des pH-Wertes ineinander umwandeln können. Bei sehr hohem pH-Wert liegen so vorwiegend Orthovanadat [VO4]3- vor, die beim Ansäuern in Polyvanadate, wie z. B. Decavanadat [V10O28]6-, übergehen.[11]
Polyoxotechnetate und polyoxorhenate

Polyoxotechnetate (Polyoxometallate des Technetium) bilden sich nur unter stark sauren Bedingungen, wie beispielsweise in HTcO4- oder Trifluormethansulfonsäure-Lösungen. Das erste empirisch isolierte Polyoxotechnetat war das rote [Tc20O68]4−.[12] Es enthält sowohl Tc(V) als auch Tc(VII) im Verhältnis 4:16 und wird als Hydroniumsalz [H7O3]4[Tc20O68]·4H2O durch Einengen einer HTcO4-Lösung gewonnen. Das entsprechende Ammoniumpolyoxotechnetatsalz wurde kürzlich aus Trifluormethansulfonsäure isoliert und hat eine sehr ähnliche Struktur.[13] Polyoxorhenate (Polyoxometallate des Rhenium) bilden sich nur bei sauren Pufferbedingungen mit einem pH-Wert von 2,5. Das erste empirisch isolierte Polyoxorhenate war das weiße [Re4O15]2−.[14]
Isopolysäuren und Isopolymetallate
Unter sog. Isopolysäuren versteht man anorganische Polysäuren, die durch Kondensation einer Säure entstehen. Sie weisen nur eine Sorte von Zentralatom (meist die Nebengruppenelemente Vanadium, Niob, Tantal, Chrom, Molybdän und Wolfram, sowie die Hauptgruppenelemente Bor, Silicium, Phosphor, Arsen und Schwefel). Isopolysäuren und Isopolymetallate werden aufgrund der strukturellen Ähnlichkeiten meist zusammengefasst, dabei sind die Metallate genau genommen das Säureanion der entsprechenden Polysäure.
Beispiele
Einzelnachweise
- ↑ M. T. Pope: Isopolyanions and Heteropolyanions. In: Comprehensive Coordination Chemistry. Vol. 3, Pergamon Press, Oxford 1987, S. 1023–1058.
- ↑ a b c Duward F. Shriver, Peter W. Atkins, Cooper Harold Langford, Wolfgang Kaim, Manfred Weidenbruch, Jürgen Heck, Detlef Rehorek, Brigitte Schwederski, Inis C. Tornieporth-Oetting, Gudrun Uhl: Anorganische Chemie. 2. Auflage. Wiley-VCH, Weinheim 1997, S. 321.
- ↑ Achim Müller, Erich Krickemeyer, Jochen Meyer, Hartmut Bögge, Frank Peters: [Mo154(NO)14O420(OH)28(H2O)70](25± 5)−: A Water-Soluble Big Wheel with More than 700 Atoms and a Relative Molecular Mass of About 24000. In: Angewandte Chemie International Edition in English. Band 34, Nr. 19, 16. Oktober 1995, S. 2122–2124, doi:10.1002/anie.199521221.
- ↑ Michael Binnewies, Maik Finze, Manfred Jäckel, Peer Schmidt, Helge Willner, Geoff Rayner-Canham: Allgemeine und Anorganische Chemie. 3. Auflage. Springer, Wiesbaden/ Berlin/ Heidelberg 2015, S. 681.
- ↑ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo, Manfred Bochmann: Advanced Inorganic Chemistry. 6. Auflage. Wiley-Interscience, New York 1999, S. 930ff.
- ↑ Philipp Kurz, Norbert Stock: Synthetische Anorganische Chemie : Grundkurs. Walter de Gruyter, Berlin 2013, S. 76–77.
- ↑ Arnold F. Hollemann, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. de Gruyter-Verlag, Berlin/ New York 1995, S. 1464.
- ↑ Juan J. Borrás-Almenar, E. Coronado, Achim Müller, Michael Pope: Polyoxometalate Molecular Science. Springer Science & Business Media, Berlin/ Heidelberg 2012, S. 34.
- ↑ Duward F. Shriver, Peter W. Atkins, Cooper Harold Langford, Wolfgang Kaim, Manfred Weidenbruch, Jürgen Heck, Detlef Rehorek, Brigitte Schwederski, Inis C. Tornieporth-Oetting, Gudrun Uhl: Anorganische Chemie. 2. Auflage. Wiley-VCH, Weinheim 1997, S. 321–322.
- ↑ De-Liang Long, Ryo Tsunashima, Leroy Cronin: Polyoxometallate als Bausteine für funktionelle Nanosysteme. In: Angewandte Chemie. Band 122, Nr. 10, 2010, S. 1780–1803, doi:10.1002/ange.200902483.
- ↑ Yoshihito Hayashi: Hetero and lacunary polyoxovanadate chemistry: Synthesis, reactivity and structural aspects. In: Coordination Chemistry Reviews. Band 255, Nr. 19-20, 2011, S. 2270–2280, doi:10.1016/j.ccr.2011.02.013.
- ↑ German, Konstantin E.; Fedoseev, Alexander M.; Grigoriev, Mikhail S.; Kirakosyan, Gayane A.; Dumas, Thomas; Den Auwer, Christophe; Moisy, Philippe; Lawler, Keith V.; Forster, Paul M.; Poineau, Frederic (24 September 2021). "A 70‐Year‐Old Mystery in Technetium Chemistry Explained by the New Technetium Polyoxometalate [H7O3]4[Tc20O68]⋅4H2O". Chemistry – A European Journal. 27 (54): 13624–13631. doi:10.1002/chem.202102035.
- ↑ Zegke, Markus; Grödler, Dennis; Roca Jungfer, Maximilian; Haseloer, Alexander; Kreuter, Meike; Neudörfl, Jörg M.; Sittel, Thomas; James, Christopher M.; Rothe, Jörg; Altmaier, Marcus; Klein, Axel (2022-01-17). "Ammonium Pertechnetate in Mixtures of Trifluoromethanesulfonic Acid and Trifluoromethanesulfonic Anhydride". Angewandte Chemie International Edition. 61 (3). doi:10.1002/anie.202113777.
- ↑ Mikhail A. Volkov, Anton P. Novikov, Nataliya E. Borisova, Mikhail S. Grigoriev, Konstantin E. German: Intramolecular Re···O Nonvalent Interactions as a Stabilizer of the Polyoxorhenate(VII). In: Inorganic Chemistry. Band 62, Nr. 33, 21. August 2023, S. 13485–13494, doi:10.1021/acs.inorgchem.3c01863.
Auf dieser Seite verwendete Medien
Autor/Urheber: Ichwarsnur, Lizenz: CC BY-SA 4.0
Ein Molybdän-braun Polyoxometallat vom Typ [Mo57Fe6].
Autor/Urheber: Ichwarsnur, Lizenz: CC BY-SA 4.0
Die Bildung eines zweikernigen Oxometallaten (aus einkernigen Oktaedern) über Kantenverknüpfung in allgemeiner Form
Autor/Urheber: Ichwarsnur, Lizenz: CC BY-SA 4.0
Das Cluster (NH4)(25 ± 5)[Mo154(NO)14O420(OH)28(H2O)70] · ca. 350 H2O besteht aus mehr als 700 Atomen und besitzt die Größe eines kleinen Proteins. Das Anion hat die Form eines Reifens (der Hohlraum hat einen Durchmesser von mehr als 20 Å) und eine extrem großen Innen- und Außenfläche. Dargestellt sind hier zwei Ansichten des Clusters ohne Wasser und Gegenionen sowie das berechnete Röntgenpulverdiffraktogramm.
Autor/Urheber: Rtomsa, Lizenz: CC BY-SA 3.0
Structure of Dawson polyoxometalate
Autor/Urheber: Thoric1999, Lizenz: CC BY-SA 4.0
the new Tc20O68 polyoxotechnetate that forms solid with 4 hydronium cations
Autor/Urheber: rtomsa, Lizenz: CC BY-SA 4.0
Structure of Keggin polyoxometalate
Autor/Urheber: Ichwarsnur, Lizenz: CC BY-SA 4.0
Die radförmige Molybdänblau-Spezies [Mo100Ce6].
Autor/Urheber: Ichwarsnur, Lizenz: CC BY 4.0
Die Polyederstrukturen des [Mo6O19]2- (a) und [Mo7O24]6-
Autor/Urheber: Ichwarsnur, Lizenz: CC BY-SA 4.0
Ein Polyoxovanadat (POV) der Spezies V14Sb8O42 in der alpha-Form. Die POVs können untereinander z. B. durch oktaedrisch koordiniertes Nickel(II) verbunden werden.



















