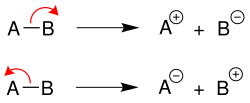
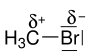Heterolytische Spaltung
Bei einer heterolytischen Spaltung verbleiben die Bindungselektronen an einem Bindungspartner, es entstehen somit je ein Kation und ein Anion.[1] Dabei nimmt das elektronegativere Atom [im Beispiel B (oben) oder A (unten)] die negative Ladung auf:
Anorganische Chemie
Bei Säure-Base-Reaktionen nach Brønsted wird von dieser Art der Bindungsspaltung ausgegangen. Eine Säure spaltet ein Wasserstoff-Kation H+ ab, das zurückbleibende Teilchen wird zum Anion. Starke Säuren, die „leicht“ ein H+-Ion abspalten, besitzen demnach eine tiefere heterolytische Bindungsenergie als schwache Säuren.
Organische Chemie
Die heterolytische Spaltung ist in der organischen Chemie oft nur ein Grenzfall, da meistens keine isolierten Ionen auftreten, sondern die Bindungen nur polarisiert sind; d. h. die Bindungspartner haben eine Partialladung δ+ oder δ−. Im Brommethan ist beispielsweise die C–Br-Bindung polarisiert, das Kohlenstoffatom besitzt eine positive Partialladung (δ+), das Bromatom eine negative Partialladung (δ−):
Die Heterolyse von Brommethan besitzt nur untergeordnete Bedeutung, da thermodynamisch ungünstig:
Das Methyl-Kation besetzt nur eine geringe Stabilität.
Deutlich leichter verläuft die Heterolyse von tert-Butylbromid, da das gebildete tertiäre Carbeniumion stabiler ist als das primäre Methyl-Carbeniumion, das aus Brommethan gebildet werden kann:
Siehe auch
Weblinks
Einzelnachweise
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 1693.