Halbaminale
| Halbaminale |
|---|
 |
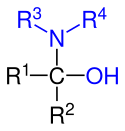
| Allgemeine Struktur der Halbaminale mit der blau markierten Amino- und Hydroxygruppe, die beide am gleichen Kohlenstoff-Atom gebunden sind. Die Reste R1, R2, R3 und R4 stellen dabei unabhängig voneinander einen aliphatischen, cyclischen oder aromatischen Rest oder auch ein Wasserstoff-Atom dar. |
Halbaminale (Synonym: Halbaminoacetal) bilden in der organischen Chemie eine Stoffgruppe, die als charakteristisches Strukturelement eine Hydroxygruppe und eine Aminogruppe, welche am selben Kohlenstoffatom gebunden sind, besitzen. Halbaminale sind meist recht instabil (siehe Erlenmeyer-Regel) und neigen unter Wasserabspaltung zur Bildung von Iminen oder Enaminen. In Gegenwart von verdünnten Säuren tritt diese Reaktion praktisch sofort ein. Halbaminale können weiterhin als Stickstoffanaloga der Halbacetale aufgefasst werden, bei denen die Alkoxy-Gruppe (O–R1) durch eine Aminogruppe ersetzt wurde. In gewisser Weise können Halbaminale auch als α-Aminoalkohole angesehen werden.
Aminale (auch Aminoacetale) sind eine Stoffgruppe, die als funktionelle Gruppen zwei an einem Kohlenstoff-Atom gebundene Aminogruppen enthalten.
Herstellung
Reaktionsmechanismus
Aldehyde und Ketone (Carbonyl-Verbindungen) reagieren mit Ammoniak, primären oder sekundären Aminen in einer nucleophilen Additionsreaktion miteinander und bilden zunächst Halbaminale. Das nachfolgende Reaktionsschema soll die mechanistischen Details dieser Reaktion verdeutlichen:

Im ersten Schritt reagiert die entsprechende Carbonylverbindung mit Ammoniak (R3, R4 = H), einem primären (R3 = H, R4 = Organyl-Rest) oder auch sekundären Amin (R3, R4 = Organyl-Reste). Dabei greift das freie Elektronenpaar des Stickstoffs nucleophil das positiv polarisierte Carbonyl-Kohlenstoffatom (1) an. Als Übergangszustand (2) entsteht das Additionsprodukt, welches entweder als Alkoholat oder als quartäre Ammoniumverbindung aufgefasst werden kann. Der letzte Reaktionsschritt beinhaltet die Tautomerisierung eines Wasserstoff-Atoms („Umprotonierung“). Hierbei deprotoniert das Alkoholat-Anion die Ammoniumgruppe und bildet dabei eine Hydroxygruppe. Weiterhin wird das Ammonium-Kation zu einem primären, sekundären oder tertiären Amin (je nach R3 und R4) rückgebildet. Schließlich entsteht das entsprechende Halbaminal (3).[1]
Beispiele
Die folgende Reaktion zeigt ein Beispiel für die Bildung eines Halbaminals aus dem sekundären Amin Carbazol und Formaldehyd.[2][3]
Aminale von primären Aminen sind instabil und können oft nicht direkt beobachtet werden. Dies erfordert in der Regel spezielle Bedingungen.[4]
Die Bildung von Halbaminalen ist eine Schlüsselreaktion bei der stereoselektiven Synthese von Saxitoxin:[5]
Bei diesem Schritt wird die Doppelbindung zuerst durch Osmium(III)chlorid, Kaliumperoxomonosulfat (engl. „oxone“) und Natriumcarbonat zum intermediären Acyloin oxidiert.– Die Synthese der 3-Oxazoline ist in der Literatur beschrieben.[6]
Einzelnachweise
- ↑ K. Peter C. Vollhardt, Neil E. Schore, Katrin-M. Roy, Holger Butenschön: Organische Chemie. 5. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2011, S. 855, ISBN 978-3-527-32754-6.
- ↑ Milata Viktor, Kada Rudolf, Lokaj Ján: Carbazol-9-yl-methanol. In: Molbank. 2004, 2004, S. M354, doi:10.3390/M354.
- ↑ Reaktion in Ethanol im Rückfluss mit Kaliumcarbonat. Durch saure Katalyse reagiert das Halbaminal zum Aminal N,N´-Biscarbazol-9-yl-methan.
- ↑ Stabilization of Labile Carbonyl Addition Intermediates by a Synthetic Receptor Tetsuo Iwasawa, Richard J. Hooley, Julius Rebek Jr.; Science, 317, 493–496, 2007. doi:10.1126/science.1143272.
- ↑ (+)-Saxitoxin: A First and Second Generation Stereoselective Synthesis James J. Fleming, Matthew D. McReynolds, and J. Du Bois; J. Am. Chem. Soc., 129 (32), 9964–9975, 2007. doi:10.1021/ja071501o.
- ↑ Maya Weber, Jürgen Jakob und Jürgen Martens: Synthese und Reaktivität von 3-Oxazolinen, Liebigs Annalen der Chemie 1992, 1–6.
Weblinks
Auf dieser Seite verwendete Medien
(c) V8rik in der Wikipedia auf Englisch, CC BY-SA 3.0
Hemiaminal formation in saxitoxin synthesis
Allgemeiner Reaktionsmechanismus der Halbaminal-Bildung
(c) V8rik in der Wikipedia auf Englisch, CC BY-SA 3.0
Carbazole Formaldehyde Reaction
Allgemeine Strukturformel der Halbaminale (Halbaminoacetale)