HPV-Impfstoff
HPV-Impfstoffe schützen durch den Aufbau einer Immunität gegen bestimmte Typen der sexuell übertragbaren humanen Papillomaviren (HPV), speziell auch vor Hochrisiko-HPV-Typen mit onkogenem Potential. Damit dient die Impfung auch der Krebsprävention. Bei Frauen wird das Zervixkarzinom (Gebärmutterhalskrebs) fast ausschließlich durch HPV verursacht, hierbei sind insbesondere die Hochrisiko-HPV-Typen 16 und 18 weltweit für etwa 70 % aller Fälle verantwortlich.[1][2] Nach Angaben des Robert Koch-Instituts starben im Jahr 2018 in Deutschland 1612 Frauen an Gebärmutterhalskrebs.[3] Bei Männern treten HPV-bedingt Anal- und Peniskarzinome sowie Karzinome in der Mundhöhle bzw. im Rachen auf. Niedrigrisiko-HPV-Typen (insbesondere HPV 6 und HPV 11) sind primär verantwortlich für die Entstehung von Genitalwarzen (Feigwarzen).
Derzeit sind drei HPV-Impfstoffe in Europa zugelassen: ein Zweifach-Impfstoff, der ausschließlich gegen die Hochrisiko-HPV-Typen 16 und 18 wirksam ist, ein Vierfach-Impfstoff, der sich gegen die HPV-Typen 6, 11, 16 und 18 richtet, und dessen Nachfolger, ein Neunfach-Impfstoff, welcher vor den HPV-Typen 6, 11, 16, 18, 31, 33, 45, 52, und 58 schützt. Die Weltgesundheitsorganisation empfiehlt allen Ländern, die HPV-Impfung in ihre nationalen Immunisierungsprogramme aufzunehmen, der HPV-Impfstoff befindet sich auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation.[4]
HPV-Impfstoffe haben sich als äußert effektiv bei der Verhinderung von Zervixkarzinomen sowie der Reduktion von Gebärmutterhalskrebsvorstufen (CIN) gezeigt, insbesondere wenn die Impfung vor dem ersten Geschlechtsverkehr erfolgt ist. Sie wirken nur vorbeugend (prophylaktisch), bereits bestehende Infektionen können durch sie nicht behandelt werden. Die Verwendung von Kondomen ist nicht ausreichend für einen Schutz, außerdem erzeugt diese im Gegensatz zur Impfung keine Immunität.[5] HPV-Impfstoffe sind gut verträglich und sicher.
Die Vorsorgeuntersuchung zur frühzeitigen Erkennung des Gebärmutterhalskrebses (Pap-Test) wird weiterhin empfohlen, da nicht alle kanzerogenen HPV-Typen durch die Impfung erfasst werden.
Risiken der HPV-Infektion
Aufgrund des onkogenen Potentials werden HPV-Typen in Hoch- und Niedrigrisiko unterteilt. So besteht die Gefahr bei persistierenden Infektionen von Hochrisiko-HPV-Typen bei der Entstehung maligner Tumoren.[1] Die Internationale Agentur für Krebsforschung (IARC) hat die HPV-Typen 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 und 59 als sicher krebserregend eingestuft.[1] Typ 68 ist vermutlich krebserregend, Typ 16 am stärksten onkogen.[6] HPV 16 und 18 werden weltweit für etwa 70 % aller Fälle von Gebärmutterhalskrebs bei der Frau verantwortlich gemacht.[2]
55,3 % aller Gebärmutterhalskrebsvorstufen (zervikale intraepitheliale Neoplasie) der Schweregrade CIN 2 und 3 waren in zwei deutschen Studien mit HPV 16 assoziiert, 6,4 % mit HPV 18, HPV 45 konnte in 8,5 % und HPV 31 in 6,4 % der Fälle nachgewiesen werden.[7] Etwa 35 % der Frauen im Alter von 20–25 Jahren waren mit einem Hochrisiko-HPV-Typ infiziert (Stand 2010/2011).[1] Eine transiente Infektion ist nach ein bis zwei Jahren nicht mehr nachweisbar, diese kann aber auch über Jahre persistieren und dann zum Teil zu einem Karzinom führen. So kann sich in ca. 10 % der Fälle persistierender HPV-Infektionen eine höhergradige CIN III entwickeln. Falls diese nicht behandelt wird, geht daraus in ca. 30–50 % der Fälle innerhalb von 10–30 Jahren ein Zervixkarzinom hervor.[1] In Deutschland erkranken pro Jahr etwa 4.500 Frauen an einem Zervixkarzinom, hierbei versterben etwa 1.500 Frauen jährlich.
Hochrisiko-Virus-Untergruppen sind nicht nur an der Entstehung von Gebärmutterhalskrebs beteiligt; man findet sie auch bei Krebserkrankungen des Penis, der Vulva, des Anus und des Mundes. Bei Männern treten HPV-bedingt schätzungsweise 600 Anal- und mindestens 250 Peniskarzinome sowie mindestens 750 Karzinome in der Mundhöhle bzw. im Rachen als Neuerkrankungen auf.[1]
Niedrigrisiko-HPV-Typen, insbesondere HPV 6 und 11, sind verantwortlich für die Entstehung von über 90 % der Genitalwarzen (Feigwarzen), die die weltweit häufigste virale sexuell übertragene Krankheit sind. Man schätzt, dass etwa 1 bis 2 % der sexuell aktiven europäischen und bundesdeutschen Bevölkerung in der Altersgruppe vom 15. bis 49. Lebensjahr von diesen gutartigen Tumoren betroffen ist. Für Deutschland wird eine Inzidenz von 170 Fällen pro 100.000 angenommen.[1] Untersuchungen der letzten Jahre zeigen eine ansteigende Häufigkeit. Genitalwarzen führen oft zu Ängsten und psychosozialen Komplikationen sowie zu Partnerproblemen und damit zu einer erheblichen Einschränkung der Lebensqualität.[8]
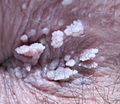
- Feigwarzen im rasierten Schambereich an Peniswurzel, ca. 6 bis 10 Monate nach Infektion
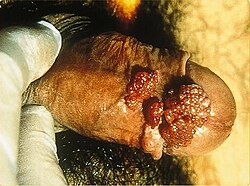
- Stark ausgeprägter Feigwarzenbefall am Penis
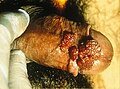
- Stark ausgeprägter Feigwarzenbefall in der Vulva
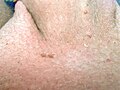
- Feigwarzenbefall des Anus
Entwicklung
Ein von Sanofi Pasteur MSD hergestellter Vierfach-Impfstoff wurde im Juni 2006 zunächst in den USA durch die Food and Drug Administration (FDA) und im September 2006 von der EU-Kommission nach einem zentralen Zulassungsverfahren in den Ländern der Europäischen Union zugelassen. Im November 2006 folgte die Zulassung in der Schweiz durch die Swissmedic.[9] In Europa lautet der Handelsname Gardasil bzw. Silgard. Der Impfstoff richtet sich gegen die vier Papillomavirustypen 6, 11, 16 und 18. Laut Europäischer Arzneimittelagentur wurden bis Januar 2008 in Europa bereits 1,5 Millionen Patientinnen mit Gardasil geimpft.[10] Es folgten Indikationserweiterungen für die Prävention von Vorstufen des Vaginal- und Vulva-Karzinoms (USA: September 2008,[11] EU: Juli 2008[12]) sowie für die Verhütung von Genitalwarzen (USA: im Oktober 2009 Ausweitung auf Männer und Jungen,[11][13] EU: November 2011) und Prävention von Vorstufen maligner Läsionen im Analbereich und Analkarzinomen (USA: Dezember 2010,[14] EU: Juni 2014[15]).
Die Zulassung für den von GlaxoSmithKline entwickelten bivalenten Impfstoff, der unter dem Handelsnamen Cervarix vertrieben wird, wurde im Mai 2007 in Australien und am 20. September 2007 für die Europäische Union erteilt. Eine Zulassung durch die FDA erfolgte im Oktober 2009.[16] Dieser richtet sich gegen die Papillomavirustypen 16 und 18.[17]
In einer Phase-III-Studie von MSD mit einem neuen rekombinanten nonavalenten Impfstoff gegen die Virustypen 6, 11, 16, 18, 31, 33, 45, 52 und 58 mit der Bezeichnung „V503“[18] verhinderte die Impfung 97 % der hochgradigen vaginalen, Vulva- und Zervixkrebsvorstufen, die durch diese Virustypen verursacht werden. Der neue Impfstoff erzeugte eine gleiche oder bessere Immunantwort als Gardasil bei den HPV-Typen 6, 11, 16 und 18.[19] Die Zulassung von V503 in den USA erfolgte im Dezember 2014[20] und in der EU im Juni 2015[21] unter dem Handelsnamen Gardasil 9, welches in Deutschland seit 2016 verfügbar ist.[22]
In anderen Ländern sind weitere HPV-Impfstoffe zugelassen: die bivalenten Impfstoffe Cecolin und Walrinvax sowie ein quadrivalenter Impfstoff Cervavax.[23]
Eigenschaften
Alle sechs verfügbaren Impfstoffe basieren auf rekombinat hergestellten L1-Proteinen aus dem Kapsid gegen unterschiedliche Virustypen.[6] Die L1-Proteine lagern sich spontan zu virusartigen Partikel (VLP) zusammen, es sind leere HP-Virushüllen. Die Impfstoffe enthalten kein lebendes biologisches Material, es handelt sich nicht um Lebendimpfstoffe. In den VLPs ist zudem keine virale DNA enthalten; damit sind die Impfstoffe nicht infektiös und können keine HPV-assoziierte Erkrankung auslösen. HPV-Impfstoffe sind adjuvantiert, aber müssen nicht mit Konservierungsstoffen versetzt werden.[6]
Die humorale Immunantwort gegen HPV wird durch Antikörper vermittelt, die die L1- und L2-Proteine erkennen. B-Lymphozyten werden durch HPV-Antigene aktiviert; diese werden dabei auf den MHC-Klasse-II-Komplexen dendritischer Zellen präsentiert. Typ2-T-Helferzellen erkennen den MHC-II/L1-L2-Antigenkomplex. Dies führt zur Aktivierung des B-Lymphozyten, die anschließend weiter differenzieren und letztendlich HPV-spezifische Antikörper produzieren.[24]
Die Impfung ist äußerst wirkungsvoll, da HPV-Impfstoffe vor einer Infektion mit den im Impfstoff enthaltenen HPV-Typen nahezu 100%ig schützen.[25] Im bivalenten Impfstoff Cervarix wurde auch eine Kreuzimmunität gegenüber anderen, nicht enthaltenen HPV-Typen beschrieben.
Wirksamkeit
Generell
Im Jahre 2011 wurden erste Daten nach Einführung eines flächendeckenden Impfprogramms mit einem quadrivalenten Impfstoff publiziert. Das Programm wurde 2007 in Australien etabliert. Die Impfquote lag dort bei 80 bis 90 Prozent. Drei Jahre nach Beginn der Impfkampagne waren die behandlungsbedürftigen Krebsvorstufen bei Mädchen unter 18 Jahren um 59 Prozent niedriger als zuvor.[26][27]
2018 hat ein Cochrane-Review die HPV-Impfung als wirksam und sicher beurteilt.[28] Dieser Ansicht schlossen sich Wissenschaftler aus Schottland an.[29][30] Die Auswertung von über 100.000 Gesundheitsdaten hat ergeben, dass routinemäßige HPV-Impfungen bei Mädchen im Alter von 12–13 Jahren die Wahrscheinlichkeit für das Auftreten abnormaler Zellen und zervikaler intraepithelialer Neoplasien (CIN; Vorstufen des Gebärmutterhalskrebses) deutlich reduziert hat. Je früher eine HPV-Impfung stattgefunden hatte, desto wirksamer war sie.
Eine Meta-Analyse von über 60 Millionen Patientendaten und einer achtjährigen Nachbeobachtung hat ergeben, dass die HPV-Impfung einen signifikanten Einfluss auf den Rückgang von HPV-Erkrankungen und der Gebärmutterhalskrebsvorstufe CIN2+ hat.[31] So ging CIN2+ 5–9 Jahre nach der HPV-Impfung bei Frauen zwischen 15 und 19 Jahren um 51 %, bei Frauen zwischen 20 und 24 Jahren um 31 % zurück.
In den USA wurde beobachtet, dass nach der Einführung des quadrivalenten Impfstoffes das Auftreten der krebserregenden HPV-Stämme im Vergleich zur Vorimpfperiode signifikant sank: bei 14- bis 19-Jährigen von 11,5 % auf 1,8 % und bei 20- bis 24-Jährigen von 18,5 % auf 5,3 %.[32] In Großbritannien zeigte sich 10 Jahre nach Einführung der HPV-Impfung, dass 16–24-jährige sexuell aktive Frauen nicht mehr mit den Hochrisikostämmen 16 und 18 infiziert waren.[33]
In einer schwedischen retrospektiven Registerstudie[34] von 2020 wurde die Schutzwirkung der HPV-Impfung bei 1,6 Millionen Mädchen und Frauen zwischen 10 und 30 Jahren untersucht. Frauen, die vor einem Alter von 17 Jahren geimpft wurden, haben hierbei ein etwa 88 % geringeres Risiko für Gebärmutterhalskrebs im Vergleich zu Ungeimpften.[35] Bei Frauen, die zwischen 17 und 30 Jahren geimpft wurden, betrug die adjustierte Risikoreduktion nur 53 %, da eine bereits vorhandene Infektion durch eine spätere Impfung nicht behandelt werden kann und bereits ein Risiko für einen zukünftigen Gebärmutterhalskrebs mit sich bringt.
In einer großen Beobachtungsstudie in England von 2021 wurde gezeigt, dass seit Einführung der Impfung im Jahr 2008 ein deutlicher Rückgang sowohl beim Zervixkarzinom als auch bei der Vorstufe CIN3 verzeichnet wurde.[36][37] Falls die Impfung vor ersten sexuellen Kontakten erfolgt ist, war der Effekt am signifikantesten. Wenn Mädchen in einem Alter von 12 bis 13 Jahren geimpft wurden, lag die Reduktion von Gebärmutterhalskrebs bei 87 % – ist diese im Alter von 16 bis 18 Jahren erfolgt, betrug die Reduktion 34 %.[35] Die Autoren schätzen zudem, dass in England die Impfung bis Ende Juni 2019 im Mittel 448 Zervixkarzinome und 17.235 CIN3-Läsionen verhindert hat. Analoge Daten aus Dänemark[38] und Schottland[39] unterstreichen die signifikante Wirksamkeit der Impfung im Alter von 12 bis 13 Jahren.[40]
Andere durch HPV verursachte Tumoren haben eine längere Zeit bis zur Krebsentwicklung. Wegen der fehlenden Nachuntersuchungszeiträume liegen hierfür noch kaum Daten vor.[35]
Studien zur Wirksamkeit vor Marktzulassung
Die Wirksamkeit des tetravalenten Impfstoffes (Gardasil) wurde in vier placebokontrollierten, randomisierten und doppelblinden Phase II- und Phase III-Studien untersucht. Bei Frauen, die zum Zeitpunkt der Impfung nicht mit den entsprechenden humanen Papillomaviren infiziert waren, konnte durch die Impfung eine Infektion bei nahezu allen Frauen (96–100 %) verhindert werden. Bei den geimpften Studienteilnehmerinnen konnte durch die Impfung das Auftreten zervikaler intraepithelialen Neoplasien, einem Surrogatmarker für Gebärmutterhalskrebs, die durch die entsprechenden HPV-Typen verursacht wurden, bei 98–100 % der Probandinnen verhindert werden.
Jungen im Alter von 9 bis 15 Jahren entwickelten nach Impfung eine Immunität. Der tetravalente Impfstoff wurde in einer Studie mit 4.065 Jungen und Männer im Alter von 16 bis 26 Jahren als effektiv beurteilt.[41]
Bei Gardasil ist eine Kreuzprotektion mit den phylogenetisch verwandten HPV-Typen 45, 52 und 58 bekannt.[42][43][44]
Klinische Prüfungen mit Cervarix (gegen die krebserregenden HPV-Typen 16 und 18) zeigen einen Schutz auch gegen Infektionen mit HPV-Typen, die nicht im Impfstoff enthalten sind. Diese sogenannte Kreuzprotektion erstreckt sich in unterschiedlichem Maß auf die Virustypen 31, 33 und 45.[45]
Nach Daten der PATRICIA-Studie (Papilloma Trial against Cancer in young Adults), einer Phase-III-Studie (HPV 008) mit Cervarix, an der in 14 Ländern Nord- und Südamerikas, Europas und der Asien-Pazifik-Region 18.644 Frauen im Alter zwischen 15 und 25 Jahren teilnahmen, wurde eine Verminderung der CIN 2+-Befunde um 70 % (33 gegenüber 110 Fälle), der CIN 3+-Befunde um 87 % (3 gegenüber 23 Fälle) gefunden. Die Quote der Konisationen reduzierte sich um 68,8 Prozent (also auf 31,2 %).[46][47]
Durchführung
Das Impfschema richtet sich nach dem Alter der zu immunisierenden Person: ab 14 Jahre (Gardasil) bzw. ab 15 Jahre (Cervarix) erfolgt die Grundimmunisierung mittels dreier intramuskulärer Injektionen, die je im Abstand von zwei und sechs Monaten nach der Erstinjektion (Gardasil) bzw. nach einem und sechs Monaten (Cervarix) verabreicht werden. Kinder im Alter von neun bis 13 Jahren (Gardasil) bzw. bis 14 Jahren (Cervarix) werden nach einem Zweidosen-Schema mit nur einer weiteren Injektion sechs Monate nach der Erstinjektion geimpft.[48][49] Ob eine Auffrischimpfung erforderlich wird, ist noch Gegenstand weiterer Untersuchungen. Jedoch ergaben Nachbeobachtungen bisher keine Hinweise auf ein Nachlassen des Impfschutzes, wobei die Aussagefähigkeit der Studien für den Langzeitschutz über 5 Jahre hinaus schlechter war als für den Kurzzeitschutz bis zu 5 Jahren.[50] Daten aus zwei großen Phase-III-Studien mit dem bivalenten HPV-Impfstoff Cervarix weisen darauf hin, dass offenbar auch bereits eine einzelne Impfung ausreichend ist.[51]
Impfempfehlung
Die Impfung ist für Mädchen bis Ende Dezember 2022 weltweit in das Impfprogramm von über 125 Ländern aufgenommen worden (in 47 Ländern auch für Jungen),[6] so in Australien,[52][53] Kanada,[54][55] Neuseeland[56] und Südkorea[57]. In den USA wurde die Impfung in vielen Bundesstaaten gesetzlich festgeschrieben.[58] Sie sollen vor erstem Sexualkontakt verimpft werden.
| Land | Datum der Impfempfehlung |
|---|---|
| Belgien | 11. Mai 2007 |
| Dänemark | 4. Oktober 2007 |
| Deutschland | 26. März 2007 |
| Frankreich | 16. März 2007 |
| Griechenland | 7. Februar 2008 |
| Irland | 5. August 2008 |
| Island | 19. Februar 2008 |
| Italien | 28. Februar 2007 |
| Luxemburg | 27. Februar 2007 |
| Niederlande | 31. März 2008 |
| Norwegen | 12. April 2007 |
| Österreich | 20. Dezember 2006 |
| Portugal | 10. Dezember 2007 |
| Schweden | 26. Februar 2008 |
| Schweiz | 18. Juni 2007 |
| Spanien | 10. Oktober 2007 |
| Vereinigtes Königreich | 26. Oktober 2007 |
Deutschland
Die Ständige Impfkommission (STIKO) empfahl die HPV-Impfung für Mädchen erstmals ab März 2007.[60] 2014 setzte sie in ihren Empfehlungen die Altersgrenze für Mädchen herab[61].
Die Deutsche Gesellschaft für Urologie (DGU) und der Berufsverband der Deutschen Urologen (BDU) beurteilten 2018 die Impfung auch für Jungen als empfehlenswert.[62] Am 5. Juni 2018 verabschiedete die STIKO einen Beschluss, in dem die Empfehlung der HPV-Impfung von Jungen im Alter von 9 bis 14 Jahren ausgesprochen wurde. Formell trat die Empfehlung mit ihrer Veröffentlichung sowie der wissenschaftlichen Begründung im Epidemiologischen Bulletin 26/2018 am 28. Juni 2018 in Kraft.[63] Dennoch lag die Impfquote 2018 bei nur bei ca. 30 %, ein Grund lag in der Kommunikationsstrategie.[64]
Für Mädchen und Jungen gelten dieselben Empfehlungen: Hierbei sollen alle Kinder und Jugendliche im Alter von 9 bis 14 Jahren mit einem 2-Dosen-Impfschema mit einem Impfabstand von 5 Monaten mit Cervarix oder Gardasil-9 geimpft werden, diese Impfserie soll vor dem ersten Geschlechtsverkehr (Kohabitarche) abgeschlossen sein.[65] Bei Nachholimpfungen bei mindestens 15 Jahren oder bei einem Impfabstand von weniger als 5 Monaten zwischen der 1. und 2. Impfstoffdosis ist eine 3. Impfstoffdosis erforderlich. Das Alter bei Beginn der Impfserie ist für die Anzahl der erforderlichen Impfstoffdosen ausschlaggebend. Bis zum Alter von 17 Jahren sollen alle versäumten Impfungen gegen HPV nachgeholt werden.
Österreich
In Österreich wird die HPV-Impfung aller Jugendlichen zwischen dem vollendeten 9. und 20. Lebensjahr nach einem 2-Dosen-Schema mit dem 9-valenten Impfstoff empfohlen, vorzugsweise vor einem sexuell aktiven Alter.[66] Die zweite Dosis sollte frühestens nach 6 und spätestens nach 12 Monaten erfolgen. Falls die zweite Impfung trotzdem früher verabreicht wurde, besteht die Notwendigkeit einer 3. Impfung im Intervall von 6 Monaten.
Bei Personen nach dem vollendeten 20. Lebensjahr wird ein 3-Dosen-Schema empfohlen, hierbei erfolgt die zweite Dosis 2 Monate nach der Erstimpfung, und die dritte Dosis 6–8 Monate nach der zweiten Dosis (0/2/6 bis 0/2/8 Monate). Dieses 3-Dosen-Schema gilt auch für immunsupprimierte Menschen bis zum 15. Lebensjahr.[67]
Die Impfung von Frauen und Männern nach dem vollendeten 30. Lebensjahr ist optional.
Gemäß Impfplan ist die Impfung für beide Geschlechter nicht nur zur Unterbrechung der Infektionskette, sondern auch zur Erreichung eines Herdenschutzes wichtig.[68] Die Impfung kann auch dann empfohlen werden, wenn eine Infektion bzw. die Erkrankung mit einem durch die Impfung abgedeckten Virus-Subtyp erfolgt war.
Schweiz
Das Bundesamt für Gesundheit (BAG) und die Eidgenössische Kommission für Impffragen (EKIF) empfehlen die HPV-Impfung aller Jugendlichen allgemein im Alter von 11 bis 14 Jahren.[69] Der beste Zeitpunkt der Impfung ist vor Beginn der sexuellen Aktivität, vorzugsweise soll der 9-valenten Impfstoff verimpft werden (auch zur Vervollständigung einer bereits begonnene Impfserie mit einem anderen HPV-Impfstoff).[70] Da bei Frauen häufiger HPV-assoziierte Krankheiten vorkommen, wird die Impfung bei jungen Mädchen als Basisimpfung empfohlen, bei Jungen dagegen als Ergänzungsimpfung. Hierbei erhalten die Jugendlichen bis 14 Jahren ein Zwei-Dosis-Impfschema (Abstand ca. 6 Monate).[71]
Bei 15- bis 26-Jährigen dient die Maßnahme als Nachhol- (empfohlen für adoleszente Mädchen bis zum 20. Geburtstag) oder Ergänzungsimpfung.[71] In diesem Falle und zusätzlich falls Mädchen an einer Immunschwäche (bedingt durch Krankheit oder Medikamente) leiden, wird allgemein ein 3-Dosen-Schema empfohlen (0/2/6 Monate). Zwischen der 1. und der 2. Dosis ist ein Abstand von einem Monat, zwischen der 2. und 3. Dosis von drei Monaten indiziert.
Japan
Die HPV-Impfung war in Japan ab April 2013 als Routineimpfung empfohlen und ist seit diesem Zeitpunkt kostenfrei.[72] Die Empfehlung wurde aber im Juni 2013 ausgesetzt, nachdem monatelang Mutmaßungen zu schweren Nebenwirkungen von Impfgegnern verbreitet wurden.[72][73] So wurde das Auftreten eines Komplexen regionalen Schmerzsyndroms bei einem 14-jährigen Mädchen kausal der HPV-Impfung angelastet.[74] Dagegen sah das Paul-Ehrlich-Institut 2013 weder bei der Auswertung aller gemeldeten Verdachtsfälle noch in der Literatur ein Risikosignal für das Auftreten dieses Syndroms.[75] Dieser Einschätzung schloss sich die Europäische Arzneimittelagentur nach einem Review im November 2015 an.[76] Belege für einen Kausalzusammenhang wurden auch in Japan nie erbracht.[77] Erst 2017 plädierten die Mitglieder von 17 japanischen Fachgesellschaften für eine Erneuerung der Impfempfehlung.[78] Durch die Ereignisse sank die HPV-Impfrate in Japan von 70 % auf unter 1 % ab, nach Informationskampagnen der Regierung lag sie 2020 bei 10 %.[72] Obwohl die japanische Regierung 2013 ihre Empfehlung des HPV-Impfstoffs bis April 2022 aussetzte, war der Impfstoff im Rahmen des nationalen Routineimpfprogramms bis zur Wiederempfehlung weiterhin kostenfrei verfügbar.[77][79][80]
Die japanische Ärztin Riko Muranaka wurde für ihren Kampf gegen Desinformation im Zusammenhang mit der HPV-Impfung in Japan mit den John-Maddox-Preis 2017 ausgezeichnet. Sie konnte zeigen, dass die vom Impfgegner Shuichi Ikeda vorgebrachten Studien massive wissenschaftliche Defizite aufwiesen.[73]
Kosten
Mit Ausnahme von Finnland haben bislang alle westeuropäischen Länder eine Finanzierung der HPV-Impfung beschlossen.[81] Internationale Studien zeigen bei der Kosten-Nutzen-Analyse der Impfung unter Annahme einer lebenslangen Dauer des Impfschutzes ein Kosten-Effektivitäts-Verhältnis, welches unter dem Schwellenwert von 50.000 Euro pro zusätzlichem qualitätsadjustiertem Lebensjahr (QALY), einem Lebensjahr mit guter Lebensqualität, liegt. Daher kommen die meisten Studien zum Ergebnis, dass die HPV-Impfung kosteneffektiv ist.[42][82][83] Eine Bewertung kann jedoch derzeit nur über Modellrechnungen erfolgen, deren Ergebnis von den berücksichtigten Faktoren (wie etwa Annahmen zur unbekannten Wirkung gegen Gebärmutterhalskrebs und unbekannten Dauer des Impfschutzes) und den Rahmenbedingungen im jeweiligen Land abhängt. So kam man in den Niederlanden zu dem Ergebnis, dass die Impfung nicht kosteneffektiv ist.[84][85] Die Impfung von Frauen, die 35 Jahre und älter sind, ist in den USA nicht kosteneffektiv.[86] Nobelpreisträger Harald zur Hausen hat selbst „…bei jeder sich bietenden Gelegenheit darauf hingewiesen, dass der Impfstoff zurzeit zu teuer ist. Dies gilt in besonderer Weise für Entwicklungsländer, in denen Gebärmutterhalskrebs zum Teil die häufigste Krebserkrankung von Frauen darstellt.“[87] In Kenia kostet der Impfstoff etwa ein halbes durchschnittliches Jahreseinkommen.[88][89]
Deutschland
Die Kosten für den Impfstoff belaufen sich auf um die 150 Euro pro erforderlicher Einzeldosis.[22] Im Jahr 2008 gaben die Krankenkassen in Deutschland für die beiden Impfstoffe Gardasil und Cervarix 244 Millionen Euro aus, so die Zahlen aus dem Arzneiverordnungs-Report 2009. Die gesetzlichen Krankenkassen übernehmen nach Aufnahme der Impfung in die Richtlinie des Gemeinsamen Bundesausschusses über Schutzimpfungen nach § 20d Abs. 1 SGB V,[90] die Impfkosten für Mädchen zwischen 9 und 17 Jahren. Einige Krankenkassen übernehmen die Kosten für die Impfung von Frauen bis zum 26. Lebensjahr als freiwillige Satzungsleistung.
Seit 2018 wird eine Impfung bei 9- bis 14-jährigen Jungen durch die Ständige Impfkommission (STIKO) empfohlen,[91] die Kosten übernehmen alle gesetzlichen Krankenkassen bis zum 17. Lebensjahr, manche Krankenkassen übernehmen sie als freiwillige Satzungsleistung bis zum 26. Lebensjahr.[92][93]
Österreich
Die HPV-Impfung für Mädchen und Jungen wurde am 12. August 2013 ins Schulimpfprogramm aufgenommen und ist damit seit Februar 2014 kostenfrei für Kinder von 9 bis 12 Jahren. Vergünstigte Preise gelten für Jugendliche bis 18 Jahre.[68] Bereits zuvor konnte die Impfung in einzelnen Bundesländern im Rahmen von Schul- oder öffentlichen Impfaktionen vergünstigt bezogen werden.
Darüber hinaus übernehmen die ÖGK, die BVAEB sowie die SVS bei Frauen nach Konisation wegen hochgradiger zervikaler intraepithelialer Dysplasien (CIN 2-3) bis zum 45. Lebensjahr die Kosten für die HPV-Impfung.[68]
Schweiz
Für weibliche und männliche Jugendliche bzw. junge Erwachsene von 11 bis 26 Jahren werden die Kosten der HPV-Impfung durch die obligatorische Krankenpflegeversicherung (OKP) übernommen.[69] Voraussetzung ist, dass die Leistung im Rahmen eines kantonalen Impfprogrammes erbracht wird.[70] Hierbei regelt die Krankenpflege-Leistungsverordnung die Bedingungen für die Kostenübernahme durch die OKP (KLV SR 832.112.31, Artikel 12a, Buchstabe k).
Unerwünschte Wirkungen
Daten aus Studien
Zur Verträglichkeit der HPV-Impfung lagen zum Zeitpunkt der Zulassung Daten aus mehreren klinischen Studien mit über 20.000 Teilnehmerinnen vor. Seit der Zulassung von Gardasil wurden weltweit über 500 Millionen Personen geimpft.[6] Das Auftreten von unerwünschten Wirkungen, die möglicherweise durch die HPV-Impfung verursacht werden, wird in speziellen Überwachungsprogrammen registriert; es konnten keine schweren Nebenwirkungen während der Postmarketing-Überwachung festgestellt werden.[94]
Aufgrund der vorliegenden Studiendaten wird die HPV-Impfung im deutschen Health Technology Assessment, von der US-amerikanischen Zulassungsbehörde für Arzneimittel (FDA), den Centers for Disease Control and Prevention (CDC), der Europäischen Arzneimittel-Agentur (EMA), der Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) und dem Global Advisory Committee der Weltgesundheitsorganisation (WHO) als sicher und gut verträglich eingeschätzt.[95][17][42][96][97][98]
Die in den kontrollierten Studien am häufigsten aufgetretenen unerwünschten Wirkungen waren bei beiden Impfstoffen lokale Reaktionen (Rötung, Schwellung und Schmerzen) an der Einstichstelle. In den Studien zu Gardasil traten lokale Reaktionen bei etwa 83 % der Frauen in der Impfgruppe und bei 73 % der Frauen in der Placebogruppe auf. Als (aktives) Placebo erhielten die Studienteilnehmer in fast allen Fällen eine Mischung aus Wasser und dem Adjuvans amorphes Aluminiumhydroxyphosphatsulfat.[12] Die häufigsten systemischen Reaktionen waren Kopfschmerzen, Müdigkeit, Muskelschmerzen und Übelkeit; sie traten in gleicher Häufigkeit in der Impf- und Placebogruppe auf. Fieber wurde bei 10–15 % der Frauen sowohl in der Impf- als auch in der Placebogruppe gemessen. Schwerere unerwünschte Wirkungen traten ebenfalls gleich häufig in der Impf- und Placebogruppe auf und bestanden in einer Einengung der Atemwege (Bronchospasmus), Gastroenteritis, Erhöhung des Blutdrucks, starken Kopfschmerzen, Schmerzen an der Einstichstelle und verminderter Beweglichkeit im benachbarten Gelenk. In einer Studie, die das Auftreten von chronischen Krankheiten bis zu vier Jahre nach Gabe des HPV-Impfstoffs oder des Placebos untersuchte, zeigte sich, dass bei 3 % der Frauen in der Impfgruppe eine chronische Krankheit aufgetreten war. In der Placebogruppe lag der Anteil neu aufgetretener chronischer Krankheiten bei 5 %. Hinsichtlich aufgetretener Todesfälle zeigte eine Metaanalyse der klinischen Studien, dass Todesfälle gleich häufig in Impf- und Placebogruppe auftraten und zumeist durch Unfälle verursacht waren. Für keinen der Todesfälle wurde die Impfung als Ursache angesehen.[99][100]
Daten nach Zulassung
Seit der US-Zulassung des HPV-Impfstoffs Gardasil im Juni 2006 sind bei der FDA und bei den Centers for Disease Control and Prevention im Rahmen von Überwachungsprogrammen bis zum September 2009 17.160 Berichte über mögliche unerwünschte Arzneimittelwirkungen bei etwa 26 Millionen verabreichter Dosen Impfstoff eingegangen. Die überwiegende Zahl der unerwünschten Wirkungen (92 %) wurde als nicht schwerwiegend eingestuft und bestand in lokalen Reaktionen, Kopfschmerzen, Übelkeit, Fieber und Synkopen. 8 % der gemeldeten unerwünschten Wirkungen waren schwerwiegend. Als schwerwiegend wurden Fälle definiert, bei denen es zu einer Krankenhausaufnahme, zu einer lebensbedrohlichen Erkrankung, zu einer irreversiblen Behinderung oder zum Tod kam. Beispielsweise wurden im zeitlichen Zusammenhang mit der Impfung aufgetretene Erkrankungen an einem Guillain-Barré-Syndrom, Thrombosen sowie Todesfälle gemeldet. Alle schwerwiegenden Fälle wurden hinsichtlich einer möglichen Verursachung durch Gardasil untersucht; in keinem Fall konnte ein ursächlicher Zusammenhang zwischen der Impfung und der jeweiligen Erkrankung nachgewiesen werden.[96] Das vermutete erhöhte Thromboserisiko konnte durch eine dänische Fall-Kontroll-Studie nicht bestätigt werden.[101] Eine weitere große Kohortenstudie aus Skandinavien konnte zudem zeigen, dass die HPV-Impfung nicht mit einem erhöhten Risiko für Multiple Sklerose (MS) und anderen demyelinisierenden Erkrankungen verbunden ist.[102]
Cervarix weist ein zu Gardasil ähnliches Nebenwirkungsspektrum auf: die nach der Verabreichung am häufigsten beobachteten Nebenwirkungen waren Schmerzen an der Injektionsstelle (78 %) sowie Kopf- und Muskelschmerzen.[48] Für beide Impfstoffe wurden in Einzelfällen eine Schwellung der Lymphknoten (Lymphadenopathie) sowie anaphylaktoide Reaktionen berichtet. Ein kausaler Zusammenhang zwischen einer HPV-Impfung und einer Unfruchtbarkeit durch Ovarialinsuffizienz konnte nicht gezeigt werden.[103][104] Ein hierfür plausibler biologischer Entstehungsmechanismus ist nicht bekannt.
Im November 2015 gab die Europäische Arzneimittelagentur (EMA) bekannt, dass sie HPV-Impfstoffe in einem Review untersucht habe, bei dem nicht das Nutzen-Risiko-Verhältnis in Frage gestellt, sondern geprüft wurde, ob zwei selten im Zusammenhang mit der Impfung berichtete unerwünschte Wirkungen, das komplexe regionale Schmerzsyndrom (Complex Regional Pain Syndrome, CRPS) und das posturale orthostatische Tachykardiesyndrom (POTS), bei geimpften Frauen häufiger auftreten als bei ungeimpften. Die Auswertung aller verfügbaren wissenschaftlichen Informationen und Meldungen in Bezug auf die beiden Syndrome ergab, dass die im zeitlichen Zusammenhang mit HPV-Impfungen beobachteten Melderaten dieser Erkrankungen der erwarteten Häufigkeit des Auftretens in der untersuchten Altersgruppe (weibliche Jugendliche im Alter von 10 bis 17 Jahren) entspreche und sich somit kein Hinweis auf einen Zusammenhang ergebe.[76] Nach einer im Dezember 2015 publizierten Kritik der dänischen Wissenschaftlerin Louise Brinth an diesem Review[105] reichte der Direktor des Nordic Cochrane Centres, Peter C. Gøtzsche, im Mai 2016 eine formelle Beschwerde zu dem offiziellen Beurteilungsbericht der EMA ein.[106]
2018 hat ein Cochrane-Review die Impfung als wirksam und sicher beurteilt.[28] Dieses Review wurde von Gøtzsche und seinen Kollegen ebenfalls kritisiert.[107] Er wurde wegen „fortgesetztes schlechtes Benehmen, welches nicht mit den Prinzipien und der Steuerung von Cochrane vereinbar sei“ am 26. September 2018 aus der Cochrane Collaboration ausgeschlossen.[108][109]
Schwangerschaft und Stillzeit
Hinsichtlich der Sicherheit einer Impfung mit HPV-Impfstoffen während der Schwangerschaft existieren nur begrenzte Daten. Diese zeigten kein erhöhtes Risiko für den Embryo oder den Fetus. So hat man beispielsweise bei knapp 1.800 untersuchten, unabsichtlich während der Schwangerschaft geimpften Frauen keine Hinweise auf einen negativen Ausgang beobachtet.[110] Zum selben Ergebnis kommt eine ältere Studie von 2010.[111] Ein Cochrane-Review aus dem Jahre 2018 kommt zu den Schluss, dass eine HPV-Impfung während der Schwangerschaft weder das Risiko für eine Fehlgeburt noch für einen Schwangerschaftsabbruch erhöht; zur Einschätzung über das Risiko für Totgeburten und Neugeborenen mit Fehlbildungen fehlen aussagekräftige Daten.[28] Das RKI und die WHO raten, die HPV-Impfung während einer Schwangerschaft generell zu verschieben.[112][6] Die HPV-Impfung reduziert das Risiko einer Frühgeburt insbesondere unterhalb der 32. Schwangerschaftswoche[113] – dagegen tragen Frauen nach einer Konisation ein höheres Risiko für Frühgeburten[45].
Es gibt auch keine Hinweise für unerwünschte Wirkungen der Impfung während der Stillzeit für Gardasil 9.[114] Die Immunogenität des Impfstoffs bei stillenden Müttern war mit der Immunogenität des Impfstoffs bei Frauen, die zum Zeitpunkt der Impfung nicht gestillt haben, vergleichbar. Die Auswirkungen auf gestillte Kinder, deren Mütter Cervarix erhalten haben, sind in klinischen Studien noch nicht untersucht worden. Cervarix sollte darum während der Stillzeit nur verabreicht werden, wenn die möglichen Vorteile mögliche Risiken überwiegen.[48] Die Autoren der S3-Leitlinie Impfprävention HPV-assoziierter Neoplasien halten eine Impfung in der Stillzeit generell für vertretbar.[8]
Experimentelle HPV-Impfstoffe
Es wird an einem hitzestabilen HPV-Impfstoff geforscht, der auf dem HPV-L2-Kapsidprotein basiert. Dieses Nebenkapsidprotein ist hochkonserviert und ermöglicht zudem eine breitere Kreuzimmunität gegen mehr HPV-Typen als die HPV-L1-Kapsidprotein basierenden Impfstoffe.[115][116]
Zusätzlich zu den beiden präventiven Impfstoffen Gardasil 9 und Cervarix werden für bereits Infizierte therapeutische HPV-Impfstoffe entwickelt. Sie befinden sich in klinischer Testung und sind damit noch nicht zugelassen. Beispielsweise enthält VGX-3100 zwei DNA-Plasmide, die intramuskulär via Elektroporation injiziert werden.[117] Körpereigene Zellen exprimieren dann nach Aufnahme der Plasmide die Onkoproteine E6 und E7 der HPV-Typen 16 und 18. Das Immunsystem richtet sich damit gegen diese Proteine und bildet zytotoxische T-Zellen aus. Ein anderer Impfstoffkandidat ist ein Vektorimpfstoff, MVA-E2. Er enthält das Modified-Vaccinia-Ankara-Virus (MVA), das direkt in die Gebärmutter von Patientinnen injiziert wird, die von CIN-Zellveränderung betroffen sind.[118] MVA exprimiert das E2-Protein des Bovinen Papillomvirus Typ 1 (BPV-1).[119]
Wissenschaftler des Deutschen Krebsforschungszentrums entwickelten einen therapeutischen Impfstoff, mit dem im Tierversuch an Mäusen der durch HPV verursachte Gebärmutterhalskrebs bekämpft werden konnte. Bei der Hälfte der geimpften Tiere bildeten sich die Tumoren zurück.[120][121]
Literatur
- Gregory D. Zimet, Marcia L. Shew, Jessica A. Kahn: Appropriate use of cervical cancer vaccine. In: Annual Review of Medicine. Band 59, 2008, S. 223–236, doi:10.1146/annurev.med.59.092806.131644, PMID 18186704.
- Emily Farmer et al.: Vaccination Strategies for the Control and Treatment of HPV Infection and HPV-Associated Cancer. In: Recent results in cancer research. Fortschritte der Krebsforschung. Progres dans les recherches sur le cancer. Band 217, 2021, S. 157–195, doi:10.1007/978-3-030-57362-1_8, PMID 33200366, PMC 8564785 (freier Volltext).
Weblinks
- S3-Leitlinie Impfprävention HPV-assoziierter Neoplasien der Paul-Ehrlich-Gesellschaft für Chemotherapie (AG HPV-Management-Forum), der Deutschen STD-Gesellschaft und der Deutschen Dermatologischen Gesellschaft. In: AWMF online (Stand 05/2020)
- Informationen des Robert Koch-Instituts zu HPV-Impfstoffen
- HPV-Impfung: Antworten auf häufige Fragen – Wovor schützt die Impfung? Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg, 7. September 2020
- Veröffentlichungen der Europäischen Arzneimittelagentur zu Gardasil und zu Cervarix
- Human papillomavirus vaccines: WHO position paper (2022 update) (PDF, englisch), WHO, 16. Dezember 2022
- Martina Wegener: Update HPV-Impfung, Deutsche Apotheker Zeitung, 4. März 2024
Einzelnachweise
- ↑ a b c d e f g Humane Papillomviren. RKI-Ratgeber. In: RKI. 28. Juni 2018, abgerufen am 25. Januar 2022.
- ↑ a b HPV: Impfung gegen Humane Papillomviren. Was bringt die Tumorviren-Impfung? In: Deutsches Krebsforschungszentrum. 7. September 2020, abgerufen am 25. Januar 2022.
- ↑ Gebärmutterhalskrebs (Zervixkarzinom) beim Zentrum für Krebsregisterdaten (ZfKD) im Robert Koch-Institut, Stand: 29. November 2021
- ↑ WHO Model Lists of Essential Medicines. (PDF) In: WHO. 2019, abgerufen am 4. April 2020 (englisch).
- ↑ Schutzimpfung gegen Humane Papillomviren (HPV): Antworten auf häufig gestellte Fragen (FAQ) zu Erreger und Impfung. Ist die Nutzung von Kondomen eine Alternative zur HPV-Impfung? In: RKI. 12. September 2022, abgerufen am 9. Februar 2023.
- ↑ a b c d e f Human papillomavirus vaccines: WHO position paper (2022 update). (PDF) In: WHO. 16. Dezember 2022, abgerufen am 9. Februar 2023 (englisch).
- ↑ Stefanie J. Klug, Meike Hukelmann, Bettina Hollwitz, Nurgül Düzenli, Betti Schopp, Karl-Ulrich Petry, Thomas Iftner: Prevalence of human papillomavirus types in women screened by cytology in Germany. In: J Med Virol 79 (2007), S. 616–25, PMID 17385693.
- ↑ a b S3-Leitlinie Impfprävention HPV-assoziierter Neoplasien. In: AWMF online (Stand 05/2020)
- ↑ Über die Zulassung von Gardasil siehe: Zulassung eines neuen Impfstoffes: Gardasil. In: Swissmedic Journal, 6. Jahrgang, Nr. 1, 2007, S. 12–13; swissmedic.ch (PDF; 522 kB).
- ↑ Pressemitteilung zur Sicherheit von Gardasil. (PDF; 28 kB) Europäische Arzneimittelagentur, 24. Januar 2008
- ↑ a b Approved Products – Gardasil. In: fda.gov. Center for Biologics Evaluation and Research
- ↑ a b Fachinformationen Gardasil (PDF; 384 kB)
- ↑ FDA Approves New Indication for Gardasil to Prevent Genital Warts in Men and Boys. ( vom 10. Mai 2015 im Internet Archive) FDA, Pressemitteilung, 16. Oktober 2009.
- ↑ FDA: Gardasil approved to prevent anal cancer ( vom 7. August 2015 im Internet Archive) FDA, Pressemitteilung, 22. Dezember 2010
- ↑ Gardasil Procedural steps taken and scientific information after the authorisation (PDF; 339 kB) ema.europa.eu
- ↑ FDA-Zulassung von Cervarix.
- ↑ a b Cervarix – European Public Assessment Report. Europäische Arzneimittelagentur; abgerufen am 14. Februar 2009.
- ↑ Broad Spectrum HPV (Human Papillomavirus) Vaccine Study in 16-to 26-Year-Old Women (V503-001) auf ClinicalTrials.gov
- ↑ Warner K Huh, Elmar A Joura, Anna R Giuliano, Ole-Erik Iversen, Rosires Pereira de Andrade, Kevin A Ault, Deborah Bartholomew, Ramon M Cestero, Edison N Fedrizzi, Angelica L Hirschberg, Marie-Hélène Mayrand, Angela Maria Ruiz-Sternberg, Jack T Stapleton, Dorothy J Wiley, Alex Ferenczy, Robert Kurman, Brigitte M Ronnett, Mark H Stoler, Jack Cuzick, Suzanne M Garland, Susanne K Kjaer, Oliver M Bautista, Richard Haupt, Erin Moeller, Michael Ritter, Christine C Roberts, Christine Shields, Alain Luxembourg: Final efficacy, immunogenicity, and safety analyses of a nine-valent human papillomavirus vaccine in women aged 16–26 years: a randomised, double-blind Trial. Lancet 390 (2017), S. 2143–2159, PMID 28886907, doi:10.1016/S0140-6736(17)31821-4
- ↑ FDA approves Gardasil 9 for prevention of certain cancers caused by five additional types of HPV FDA News Release.
- ↑ Gardasil 9. In: ema.europa.eu. European Medicines Agency
- ↑ a b HPV-Impfung – Gebärmutterhalskrebs vorbeugen. In: www.krebsgesellschaft.de.
- ↑ Human papillomavirus vaccines: WHO position paper (2022 update). (PDF) In: WHO. 16. Dezember 2022, S. 654, abgerufen am 9. Februar 2023 (englisch).
- ↑ Julio Cesar González-Rodríguez et al.: Cervical cancer prevention by vaccination: review. In: Frontiers in Oncology. Band 14, 2024, S. 1386167, doi:10.3389/fonc.2024.1386167, PMID 38715779 (englisch).
- ↑ Schutzimpfung gegen Humane Papillomviren (HPV): Antworten auf häufig gestellte Fragen (FAQ) zu Erreger und Impfung. In: RKI. 31. Januar 2025, abgerufen am 25. Februar 2025.
- ↑ Rüdiger Meyer: Früher Rückgang der Zervixläsionen durch HPV-Impfung. Dt. Ärzteblatt 108 (2011), S. A-1458, aerzteblatt.de (PDF)
- ↑ Julia ML Brotherton, Masha Fridman, Cathryn L May, Genevieve Chappell, A Marion Saville, Dorota M Gertig: Early effect of the HPV vaccination programme on cervical abnormalities in Victoria, Australia: an ecological study. In: Lancet, 377, 2011, S. 2085–2092, doi:10.1016/S0140-6736(11)60551-5
- ↑ a b c Marc Arbyn et al.: Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors. In: Cochrane Database of Systematic Reviews. Band 2020, Nr. 3, 9. Mai 2018, doi:10.1002/14651858.CD009069.pub3, PMID 29740819, PMC 6494566 (freier Volltext) – (englisch).
- ↑ Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Die HPV-Impfung wirkt. 11. April 2019, abgerufen am 27. Mai 2019.
- ↑ Tim Palmer et al.: Prevalence of cervical disease at age 20 after immunisation with bivalent HPV vaccine at age 12-13 in Scotland: retrospective population study. In: BMJ. Band 365, 3. April 2019, S. l1161, doi:10.1136/bmj.l1161, PMID 30944092 (englisch).
- ↑ Mélanie Drolet et al.: Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis. In: The Lancet. Band 394, Nr. 10197, 10. August 2019, S. 497–509, doi:10.1016/S0140-6736(19)30298-3, PMID 31255301.
- ↑ Nancy M. McClung et al.: Declines in Vaccine-Type Human Papillomavirus Prevalence in Females Across Racial/Ethnic Groups: Data From a National Survey. In: Journal of Adolescent Health. Band 65, Nr. 6, 1. Dezember 2019, S. 715–722, doi:10.1016/j.jadohealth.2019.07.003.
- ↑ HPV prevalence in sexually active young females in England. Public Health England, 22. Januar 2020, abgerufen am 28. Januar 2020 (englisch).
- ↑ Jiayao Lei et al.: HPV Vaccination and the Risk of Invasive Cervical Cancer. In: The New England Journal of Medicine. Band 383, Nr. 14, 1. Oktober 2020, S. 1340–1348, doi:10.1056/NEJMoa1917338, PMID 32997908 (englisch).
- ↑ a b c Antworten auf häufig gestellte Fragen (FAQ) zu Erreger und Impfung. Gibt es Studien, die belegen, dass die HPV-Impfstoffe Gebärmutterhalskrebs (oder andere HPV-bedingte Krebsarten) verhindern? 12. September 2022, abgerufen am 9. Februar 2023.
- ↑ England: Weniger Zervixkarzinome bei jüngeren Frauen dank HPV-Impfung. In: Deutsches Ärzteblatt. 4. November 2021, abgerufen am 5. November 2021.
- ↑ Milena Falcaro et al.: The effects of the national HPV vaccination programme in England, UK, on cervical cancer and grade 3 cervical intraepithelial neoplasia incidence: a register-based observational study. In: The Lancet. 3. November 2021, doi:10.1016/S0140-6736(21)02178-4, PMID 34741816 (englisch).
- ↑ Susanne K. Kjaer et al.: Real-World Effectiveness of Human Papillomavirus Vaccination Against Cervical Cancer. In: Journal of the National Cancer Institute. Band 113, Nr. 10, 1. Oktober 2021, S. 1329–1335, doi:10.1093/jnci/djab080, PMID 33876216, PMC 8486335 (freier Volltext) – (englisch).
- ↑ Tim J. Palmer et al.: Invasive cervical cancer incidence following bivalent human papillomavirus vaccination: a population-based observational study of age at immunization, dose, and deprivation. In: Journal of the National Cancer Institute. 22. Januar 2024, S. djad263, doi:10.1093/jnci/djad263, PMID 38247547 (englisch).
- ↑ Marc Arbyn et al.: Linkage of individual-patient data confirm protection of prophylactic human papillomavirus vaccination against invasive cervical cancer. In: Journal of the National Cancer Institute. 19. März 2024, S. djae042, doi:10.1093/jnci/djae042, PMID 38501990 (englisch).
- ↑ Anna R. Giuliano et al.: Efficacy of Quadrivalent HPV Vaccine against HPV Infection and Disease in Males. In: New England Journal of Medicine. Band 364, Nr. 5, 3. Februar 2011, S. 401–411, doi:10.1056/NEJMoa0909537, PMID 21288094, PMC 3495065 (freier Volltext).
- ↑ a b c O Damm, M Nocon, S Roll, C Vauth, SN Willich, W Greiner: Impfung gegen humane Papillomaviren (HPV) zur Prävention HPV 16/18 induzierter Zervixkarzinome und derer Vorstufen. Schriftenreihe Health Technology Assessment, 2009, Band 83, 1. Auflage dimdi.de (PDF; 689 kB) abgerufen am 11. März 2009
- ↑ JF Smith, M Brownlow, M Brown et al.: Antibodies from women immunized with Gardasil cross-neutralize HPV 45 pseudovirions. Hum Vaccin 3 (2007), 109–115
- ↑ H M Hepburn, A M Kaufmann: Nobelpreis für die Impfung gegen Zervixkrebs. Aktuelle Daten- und Leitlinienlage. In: Internist, 50, 2009, S. 617–626, doi:10.1007/s00108-009-2388-9
- ↑ a b Antworten auf häufig gestellte Fragen (FAQ) zu Erreger und Impfung. Warum sollte man gegen HPV impfen? In: RKI. 2. März 2022, abgerufen am 25. März 2024.
- ↑ Paavonen J et al.: Efficacy of a prophylactic adjuvanted bivalent L1 virus-like-particle vaccine against infection with human papillomavirus types 16 and 18 in young women: an interim analysis of a phase III double-blind, randomised controlled trial. In: The Lancet. 369. Jahrgang, Nr. 9580, Juni 2007, S. 2161–70, doi:10.1016/S0140-6736(07)60946-5, PMID 17602732.
- ↑ Vera Zylka-Menhorn: HPV-Impfung: Die Studienwelt wurde erweitert. Dtsch Arztebl 106 (2009), A-1185.
- ↑ a b c Produktinformationstexte Cervarix (PDF; 467 kB) Europäische Arzneimittelagentur, Stand Februar 2014.
- ↑ Zwei-Dosen-Schema für HPV-Impfstoffe. In: apotheke-adhoc.de. 7. April 2014, abgerufen am 10. Juni 2018.
- ↑ Yvonne Deleré et al.: Effektivität und Dauer des Impfschutzes gegen humane Papillomviren: Systematische Literaturübersicht und Metaanalyse. In: Dtsch Arztebl Int, 111, 2014, S. 584–591, doi:10.3238/arztebl.2014.0584
- ↑ A R Kreimer et al.: Efficacy of fewer than three doses of an HPV-16/18 AS04-adjuvanted vaccine: combined analysis of data from the Costa Rica Vaccine and PATRICIA trials. In: The Lancet, online veröffentlicht am 10. Juni 2015 doi:10.1016/S1470-2045(15)70199-3
- ↑ Human Papillomavirus (HPV) ( vom 23. Februar 2016 im Internet Archive), Immunise Australia Program
- ↑ Government funds Gardasil. Australian Government Department of Health
- ↑ Human Papillomavirus (HPV) Prevention and HPV Vaccine: Questions and Answers. Public Health Agency of Canada
- ↑ Update On Human Papillomavirus (HPV) Vaccines. Public Health Agency of Canada
- ↑ Informationen zur HPV-Impfung in Neuseeland ( vom 30. Januar 2009 im Internet Archive) Ministry of Health
- ↑ Young-Tak Kim: Current status of cervical cancer and HPV infection in Korea. In: J Gynecol Oncol, 20, 2009, S. 1–7, PMID 19471667, doi:10.3802/jgo.2009.20.1.1
- ↑ HPV Vaccine: State Legislation. National Conference of State Legislatures.
- ↑ Jan Leidel: Stellungnahme an den Landtag Nordrhein-Westfalen. (PDF; 2,9 MB) 23. Februar 2009
- ↑ Impfung gegen humane Papillomaviren (HPV) für Mädchen von 12 bis 17 Jahren – Empfehlung und Begründung. In: RKI (Hrsg.): Epidemiologisches Bulletin. Nr. 12, 23. März 2007, S. 97–106 (rki.de [PDF]).
- ↑ HPV-Impfung: STIKO setzt Altersgrenze herab. In: univadis.de. 26. August 2014, archiviert vom (nicht mehr online verfügbar) am 12. Juni 2018; abgerufen am 12. Juni 2018.
- ↑ Urologen empfehlen: Die HPV-Impfung für Jungen. In: urologenportal.de. DGU, BDU, 23. Juni 2016, abgerufen am 10. Juni 2018.
- ↑ Wissenschaftliche Begründung für die Empfehlung der HPV-Impfung für Jungen im Alter von 9 bis 14 Jahren. (PDF; 806 kB) In: Epidemiologisches Bulletin, 26/2018, 28. Juni 2018.
- ↑ Julia Frisch: Traurige Bilanz der HPV-Impfung. In: Ärztezeitung. 11. April 2018, abgerufen am 12. Januar 2022.
- ↑ Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut 2024. (PDF) Epidemiologisches Bulletin 4 / 2024. RKI, 25. Januar 2024, S. 22, abgerufen am 27. März 2024.
- ↑ Impfplan Österreich 2023 (PDF). Dezember 2022, abgerufen am 6. Juli 2023.
- ↑ Anstieg bei HPV-Impfungen in Wien. 6. Juli 2023, abgerufen am 6. Juli 2023.
- ↑ a b c Impfplan Österreich 2022. (PDF) In: Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz. Januar 2022, S. 42-47, abgerufen am 26. Januar 2022.
- ↑ a b Humane Papillomaviren (HPV). In: Bundesamt für Gesundheit. 7. Oktober 2021, abgerufen am 27. Januar 2022.
- ↑ a b HPV-Impfung: Empfehlungen des BAG und der EKIF zum neuen Impfstoff Gardasil 9®. (PDF) In: BAG-Bulletin. BAG, 22. Oktober 2018, S. 10-15, abgerufen am 27. Januar 2022.
- ↑ a b Schweizerischer Impfplan. In: Bundesamt für Gesundheit BAG. 15. April 2021, abgerufen am 17. April 2021.
- ↑ a b c Yutaka Ueda et al.: The last strategy for re-dissemination of HPV vaccination in Japan while still under the suspension of the governmental recommendation. In: Scientific Reports. Band 10, Nr. 1, 30. September 2020, S. 16091, doi:10.1038/s41598-020-73120-1.
- ↑ a b Jonas Tauber und Matthias Wallenfels: HPV-Impfung in Japan verteufelt. In: Ärztezeitung. 6. März 2019, abgerufen am 10. Mai 2024.
- ↑ Doris Uhl: Japan setzt Empfehlung für HPV-Impfung aus. Deutsche Apothekerzeitung vom 20. Juni 2013.
- ↑ Kein Hinweis auf ein erhöhtes Risiko für Autoimmunerkrankungen nach HPV-Impfung. (PDF; 1,1 MB) In: Bulletin zur Arzneimittelsicherheit, Ausgabe 3. Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel (Paul-Ehrlich-Institut), September 2013, abgerufen am 18. März 2020.
- ↑ a b HPV-Impfstoffe – EMA bestätigt: Nachweise unterstützen nicht die Annahme, dass die Impfstoffe CRPS oder POTS verursachen. (PDF) In: EMA. 12. Januar 2016, abgerufen am 20. Dezember 2020.
- ↑ a b Keiko Kunitoki et al.: Access to HPV vaccination in Japan: Increasing social trust to regain vaccine confidence. In: Vaccine. Band 39, Nr. 41, 1. Oktober 2021, S. 6104–6110, doi:10.1016/j.vaccine.2021.08.085.
- ↑ Satoshi Iwata, Kenji Okada, Kei Kawana: Consensus statement from 17 relevant Japanese academic societies on the promotion of the human papillomavirus vaccine. Vaccine 35 (2017), S. 2291–2292, PMID 28325478, doi:10.1016/j.vaccine.2017.03.015, vaccine-kyogikai.umin.jp (PDF; 219 kB)
- ↑ Dennis Normile: Japan relaunches its HPV vaccination drive. For thousands of women, it may be too late. In: ScienceInsider. Abgerufen am 10. Mai 2022 (englisch).
- ↑ Natsuko Fukue: 'Finally we can protect women': Japan's HPV vaccine battle. In: The Japan Times. 12. April 2022, abgerufen am 10. Mai 2022 (englisch).
- ↑ Sepp Leodolter: Psychische und körperliche Belastung durch Krebsvorstufen und Konisation: Kombinierte Vorsorgestrategie könnte auch Großteil der Gebärmutterhalskrebs-Vorstufen verhindern. Österreichische Initiative gegen Gebärmutterhalskrebs, 3. Dezember 2008
- ↑ F Marra, K Cloutier, B Oteng, C Marra, G Ogilvie: Effectiveness and cost effectiveness of human papillomavirus vaccine: a systematic review. In: Pharmacoeconomics, 27, 2009, S. 127–147, PMID 19254046, doi:10.2165/00019053-200927020-00004
- ↑ M. Jit et al.: Economic evaluation of human papillomavirus vaccination in the United Kingdom. BMJ 337 (2008), 769, doi:10.1136/bmj.a769
- ↑ Inge M. C. M. de Kok, Marjolein van Ballegooijen, J. Dik F. Habbema: Cost-Effectiveness Analysis of Human Papillomavirus Vaccination in the Netherlands. Journal of the National Cancer Institute, doi:10.1093/jnci/djp183
- ↑ Roxanne Nelson: HPV Vaccination Is Not Cost-Effective in the Netherlands. Medscape Medical News
- ↑ Jane J. Kim: Cost-Effectiveness of Human Papillomavirus Vaccination and Cervical Cancer Screening in Women Older Than 30 Years in the United States. In: Annals of Internal Medicine. 151. Jahrgang, Nr. 8, 19. Oktober 2009, S. 538–545 (annals.org [abgerufen am 20. Oktober 2009]).
- ↑ Verhütung der nötigen Zervix-Ca-Vorstufen durch die Impfung ist eindeutig belegt. Interview mit Harald zur Hausen. In: Ärzte Zeitung, 3. Dezember 2008.
- ↑ Medical News Today, 5. September 2007 ( vom 3. Januar 2009 im Internet Archive) abgerufen am 22. Februar 2016
- ↑ The Economic Impact of AIDS in Kenya (S.11) (PDF; 230 kB), The POLICY Project, 1999.
- ↑ Richtlinie des Gemeinsamen Bundesausschusses über Schutzimpfungen nach § 20d Abs. 1 SGB V, zuletzt geändert am 5. Dezember 2013 (PDF; 380 kB).
- ↑ Vorabinformation: STIKO empfiehlt HPV-Impfung für Jungen. In: Empfehlungen der STIKO. RKI, abgerufen am 11. Juni 2018.
- ↑ Kassen zahlen HPV-Impfung auch für Jungen, auf spiegel.de
- ↑ Übersicht über Krankenkassen, die die Kosten einer HPV-Impfung übernehmen.
- ↑ Michael Wojcinski: 14 Jahre HPV-Impfung: was haben wir erreicht? In: Der Gynakologe. Band 54, Nr. 11, 2021, S. 801–809, doi:10.1007/s00129-021-04869-3, PMID 34658401, PMC 8512599 (freier Volltext).
- ↑ Gardasil – European Public Assessment Report. Europäische Arzneimittel-Agentur; abgerufen am 9. Februar 2016.
- ↑ a b This page has been moved HPV – Vaccines – Vaccine Safety – CDC. In: cdc.gov.
- ↑ FIGO Statement on HPV Vaccination Safety. (PDF; 85 kB) Fédération Internationale de Gynécologie et d’Obstétrique, 2. August 2013.
- ↑ Global Advisory Committee on Vaccine Safety Statement on the continued safety of HPV vaccination. (PDF; 173 kB) Global Advisory Committees der Weltgesundheitsorganisation (WHO), 12. März 2014.
- ↑ L. Rambout, L. Hopkins, B. Hutton, D. Fergusson: Prophylactic vaccination against human papillomavirus infection and disease in women: a systematic review of randomized controlled trials. In: CMAJ. 2007 Aug 28;177(5):469–79. PMID 17671238
- ↑ Francisco A. R. Garcia, Debbie Saslow: Prophylactic human papillomavirus vaccination: a breakthrough in primary cervical cancer prevention. In: Obstetrics and Gynecology Clinics of North America. Band 34, Nr. 4, Dezember 2007, S. 761–781, ix, doi:10.1016/j.ogc.2007.09.007, PMID 18061868.
- ↑ Nikolai Madrid Scheller, Björn Pasternak, Henrik Svanström, Anders Hviid: Quadrivalent human papillomavirus vaccine and the risk of venous thromboembolism. In: JAMA. Band 312, Nr. 2, Juli 2014, S. 187–188, doi:10.1001/jama.2014.2198, PMID 25005658.
- ↑ Nikolai Madrid Scheller, Henrik Svanström, Björn Pasternak, Lisen Arnheim-Dahlström, Karin Sundström, Katharina Fink, Anders Hviid: Quadrivalent HPV Vaccination and Risk of Multiple Sclerosis and Other Demyelinating Diseases of the Central Nervous System In: JAMA, 313, 2015, S. 54–61, doi:10.1001/jama.2014.16946.
- ↑ David Hawkes: Evidence evolves over time and should be based on data not opinion. In: BMJ Evidence-Based Medicine. Band 25, Nr. 6, 1. Dezember 2020, S. 191–192, doi:10.1136/bmjebm-2019-111222, PMID 31548208.
- ↑ Marco Torella et al.: Risk of Premature Ovarian Insufficiency after Human Papilloma Virus Vaccination: A PRISMA Systematic Review and Meta-Analysis of Current Evidence. In: Vaccines. Band 11, Nr. 1, 9. Januar 2023, S. 140, doi:10.3390/vaccines11010140, PMID 36679985, PMC 9866915 (freier Volltext) – (englisch).
- ↑ Louise Brinth: Responsum to Assessment Report on HPV-vaccines released by EMA November 26th 2015. (PDF; 1,3 MB)
- ↑ Complaint to the European Medicines Agency (EMA) over maladministration at the EMA. ( vom 15. Juni 2016 im Internet Archive) (PDF) Nordic Cochrane Center, 26. Mai 2016.
- ↑ L Jørgensen, PC Gøtzsche, T. Jefferson: The Cochrane HPV vaccine review was incomplete and ignored important evidence of bias. BMJ Evidence-Based Medicine 2018; 23, S. 165–168, doi:10.1136/bmjebm-2018-111012
- ↑ Statement from Cochrane’s Governing Board
- ↑ Statement from Cochrane’s Governing Board – 26th September 2018
- ↑ HPV-Impfung in Schwangerschaft ohne negative Folgen. Deutsches Ärzteblatt, 31. März 2017, abgerufen am 9. September 2019.
- ↑ HPV-Impfstoff keine Gefahr für Schwangerschaft. In: Ärzte Zeitung. 29. März 2010, abgerufen am 5. Januar 2022.
- ↑ Wissenschaftliche Begründung für die Empfehlung der HPV-Impfung für Jungen im Alter von 9 bis 14 Jahren. (PDF) In: Epidemiologisches Bulletin. RKI, 28. Juni 2018, S. 244, abgerufen am 5. Januar 2022.
- ↑ Ilkka Kalliala et al.: Preterm birth rate after bivalent HPV vaccination: Registry-based follow-up of a randomized clinical trial. In: Preventive Medicine. Band 146, Mai 2021, S. 106473, doi:10.1016/j.ypmed.2021.106473, PMID 33639181 (englisch).
- ↑ HPV-Impfung - Antworten auf häufige Fragen. DKFZ, 22. Juli 2019, abgerufen am 9. September 2019.
- ↑ Pola Olczak, Richard B. S. Roden: Progress in L2-Based Prophylactic Vaccine Development for Protection against Diverse Human Papillomavirus Genotypes and Associated Diseases. In: Vaccines. Band 8, Nr. 4, 1. Oktober 2020, S. 568, doi:10.3390/vaccines8040568, PMID 33019516, PMC 7712070 (freier Volltext) – (englisch).
- ↑ Christina Schellenbacher et al.: HPV-Impfstoffe – zugelassene Vakzinen und experimenteller RG1-VLP-Impfstoff der nächsten Generation. In: hautnah. Band 20, Nr. 3, 1. September 2021, S. 155–160, doi:10.1007/s12326-021-00453-7.
- ↑ Birgit Schindler: Gebärmutterhalskrebs durch therapeutische Impfung heilbar? In: Deutsche Apothekerzeitung. 7. Januar 2016, abgerufen am 5. Januar 2022.
- ↑ John T. Schiller et al.: Human Papillomavirus Vaccines. In: Stanley A. Plotkin et al. (Hrsg.): Plotkin’s Vaccines. 7. Auflage. Elsevier, Philadelphia 2017, ISBN 978-0-323-35761-6, S. 454, doi:10.1016/B978-0-323-35761-6.00030-4.
- ↑ Emily Farmer et al.: Vaccination Strategies for the Control and Treatment of HPV Infection and HPV-Associated Cancer. In: Recent results in cancer research. Fortschritte der Krebsforschung. Progres dans les recherches sur le cancer. Band 217, 2021, S. 157–195, doi:10.1007/978-3-030-57362-1_8, PMID 33200366, PMC 8564785 (freier Volltext).
- ↑ Impfung als Therapie: Experimenteller Impfstoff gegen Gebärmutterhalskrebs an Mäusen erfolgreich erprobt. Deutsches Krebsforschungszentrum, Pressemitteilung, 16. Januar 2019
- ↑ Sebastian Kruse et al.: Therapeutic vaccination using minimal HPV16 epitopes in a novel MHC-humanized murine HPV tumor model. In: OncoImmunology. Band 8, Nr. 1, 2. Januar 2019, S. e1524694, doi:10.1080/2162402X.2018.1524694, PMID 30546964, PMC 6287800 (freier Volltext).
Auf dieser Seite verwendete Medien
Autor/Urheber: Colorectal in der Wikipedia auf Griechisch Απόστολος Σταματιάδης, Lizenz: CC BY-SA 3.0
Κονδυλώματα πρωκτού
Autor/Urheber: SOA-AIDS Amsterdam, Lizenz: CC BY-SA 3.0
genital warts
Autor/Urheber: SOA-AIDS Amsterdam, Lizenz: CC BY-SA 3.0
genital warts