Influenza-A-Virus H5N1
| Influenza-A-Virus H5N1 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
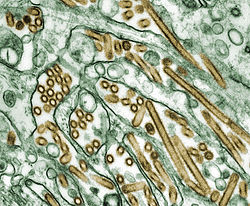 Elektronenmikroskopische Aufnahme von H5N1 | ||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||||
| Influenza A virus A/H5N1 | ||||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||||
| FLUAV/(H5N1) | ||||||||||||||||||||||
| Links | ||||||||||||||||||||||
|
Influenza-A-Virus H5N1 (A/H5N1) bezeichnet einen Subtyp des Influenza-A-Virus (Spezies Alphainfluenzavirus influenzae) aus der Familie der Orthomyxoviren.[3] Dieses Virus ist der Erreger einer gemeinsprachlich als Vogelgrippe bezeichneten Viruskrankheit. Einige Varianten des Erregers werden zu den hoch pathogenen aviären („von Vögeln stammenden“) Influenza-Viren (HPAIV) gestellt. Zu diesen Varianten gehört insbesondere der zunächst in China aufgetretene sogenannte Asia-Typ, der als besonders virulent gilt und mehrfach auch auf den Menschen übergegangen ist (→Fallzahlen). In der zunächst minder pathogenen Form ist das Virus bereits seit 1959 bekannt,[4] alle sich ab 1997 weltweit verbreitenden hochpathogenen H5N1-Varianten haben einen gemeinsamen „Vorfahren“ in der 1996 gesicherten Virusprobe A/Goose/Guangdong/1/96.[5][6]
Informationen über weitere Influenza-Viren, die ebenfalls unter Geflügel verbreitet sind, siehe unter Geflügelpest und in der Liste von Subtypen des Influenza-A-Virus; zur weltweiten Ausbreitung seit 2004 siehe Vogelgrippe H5N1.
Besondere Merkmale
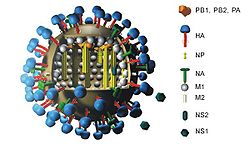
Wie bei allen anderen Influenzaviren auch, kodieren die acht Genomsegmente dieses Subtyps zehn oder elf virale Proteine: Hämagglutinin (HA), Neuraminidase (NA), Nukleoprotein (NP), die Matrixproteine (M1) und (M2), die Polymerase Proteine (PB1), (PB2) und (PA), die Nichtstrukturproteine (NS1) und (NS2) und vereinzelt auch PB1-F2. Drei der acht Gensegmente (M, NS und PB1) codieren durch alternatives Spleißen für jeweils zwei Proteine. Das NS-Segment enthält das NS-Gen, aus welchem die beiden Nichtstrukturproteine (NS1) und (NS2) gebildet werden, während aus dem M-Segment die Matrixproteine 1 und 2 und aus dem PB1-Segment PB1 und PB1-F2 gebildet werden.

Verschiedene Mutationen in Genen des Influenzavirus H5N1 wurden in Bezug auf die im Vergleich zu anderen Influenzaviren erhöhte Pathogenität beschrieben. Influenzaviren vom Serotyp H5N1 können nach ihrer Pathogenität in niedrigpathogene aviäre Influenzaviren (englisch low-pathogenic avian influenza, LPAI) und hochpathogene aviäre Influenzaviren (englisch highly pathogenic avian influenza, HPAI) eingeteilt werden. Eine charakteristische Eigenschaft der HPAI ist die multibasische Schnittstelle (englisch multi-basic cleavage site) im Hämagglutinin, die eine proteolytische Aktivierung der Fusionsdomäne und somit die Penetration der Wirtszelle erleichtert.[7] Manche H5N1-Subtypen führen bei einer Infektion zu einer übermäßigen Aktivierung der angeborenen Immunantwort durch das Hämagglutinin (HA5), einzelsträngige und doppelsträngige virale RNA,[8] was sich in einer verstärkten Ausschüttung von Zytokinen durch Immunzellen äußert und als Zytokinsturm bezeichnet wurde.[9] Die Mutation I227S im Hämagglutinin wurde mit einer erhöhten Pathogenität in Mäusen assoziiert.[10] Die Änderung von Glykosylierungen im Hämagglutinin kann die Replikation erleichtern.[11] Eine in manchen H5N1-Viren beobachtete Mutation in der Neuraminidase (H274Y) führt zu einer Resistenz gegen Oseltamivir.[12] Manche Varianten des PB1-F2 (Mutante N66S) führen verstärkt zur Apoptose in infizierten Zellen.[13] An einem Ende des NS-Gens befindet sich ein Abschnitt, der vermutlich mit über die Heftigkeit eines Infektionsverlaufs entscheidet. Änderungen in diesem Genabschnitt führen zu einer Variation in einem variablen Bereich auf dem NS1-Protein. Bei A/H5N1 besitzt dieser variable Proteinbereich eine Struktur, die sich besonders beim Menschen sehr effektiv an sogenannte PDZ-Domänen (spezieller Teilbereich von Zellproteinen) bindet und dadurch die Signalübermittlung in den Zellen besonders stark stört. Eine derartige Störung der Signalübermittlung bewirkt dann eine Überstimulation des Immunsystems, bei der viele Entzündungsbotenstoffe ausgeschüttet werden.
In einer Studie, die Mitte März 2006 in der Fachzeitschrift Nature veröffentlicht wurde,[14] argumentierten Forscher, dass sich A/H5N1 im Gegensatz zu den humanen Influenzaviren an Rezeptoren binde, welche sich bei Mensch und Tier vor allem in den Lungenbläschen befinden, aber kaum in den oberen Atemwegen. Dies sei der Grund, dass bisher eine Mensch-zu-Mensch-Übertragung sehr selten auftritt, da bei einer so genannten Tröpfcheninfektion überwiegend Substanzen aus Hals und Rachen über die Atemluft verbreitet werden. Gleichzeitig ist die Vermehrung im unteren Lungenbereich teilweise für den schwereren Krankheitsverlauf und die erhöhte Letalität bei Menschen verantwortlich.[15] Weiterhin wurden Mutationen beschrieben, die gehäuft in Menschen oder in Vögeln auftreten und die Replikation im jeweiligen Wirt erleichtern.[11]
Umweltstabilität
Je nach Temperatur ist die Umweltstabilität (Tenazität) der Influenzaviren und damit auch des Subtyps A/H5N1 mit all seinen weiteren Varianten relativ gering im Vergleich zu anderen Viren. Bei einer normalen sommerlichen Tagestemperatur von etwa 20 °C können an Oberflächen angetrocknete Viren in der Regel zwei bis acht Stunden überdauern. Bei 22 °C überstehen sie sowohl in Exkrementen wie auch in Geweben verstorbener Tiere und in Wasser mindestens vier Tage, bei einer Temperatur von 0 °C mehr als 30 Tage, und in Eis sind sie nahezu unbegrenzt infektionsfähig. Oberhalb der Körpertemperatur verringert sich allerdings die Umweltstabilität auch von A/H5N1 sehr deutlich. Bei 56 °C werden die Viren innerhalb von 3 Stunden und bei 60 °C innerhalb von 30 Minuten inaktiviert.[16] Ab 70 °C werden die Viren zerstört und verlieren damit auch endgültig ihre Infektiosität.[17]
Klassifikation der Subtypen
Die Influenzaviren gehören taxonomisch zur Familie der Orthomyxoviridae, die fünf Gattungen umfasst: Influenza-A, Influenza-B, Influenza-C, Thogotovirus und Isavirus. Vögel werden nur von Influenza-A-Viren und deren Varianten bzw. Subtypen befallen.
Durch ständige Genveränderungen (Mutationen) entstehen fortwährend neue Varianten der Grippeviren. Diese werden nach bestimmten Oberflächeneigenschaften in Subtypen eingeteilt. Bisher wurden serologisch 16 H-Untertypen und 9 N-Untertypen erkannt. Der Subtyp A/H5N1 etwa hat auf seiner Oberfläche die Variante 5 des Hämagglutinins (H5) sowie die Variante 1 der Neuraminidase (N1). Diese Untertypen befallen üblicherweise jeweils nur bestimmte Wirte, während sie von einer weiteren Anzahl an Infektionsvektoren verbreitet werden können, ohne dass diese Tiere erkranken. Der Subtyp A/H5N1 ist im Menschen aggressiver als A/H7N7 oder SARS.
Innerhalb des Subtyps A/H5N1 werden zudem weitere Kladen (englisch clades) unterschieden, die weiter in die einzelnen Stämme unterteilt sind und sich in ihrer relativ hohen Virulenz teilweise deutlich unterscheiden. Besonders die asiatische H5N1-Variante (A/Vietnam/H5N1/1203/2004) ist durch ihre gesteigerte Aggressivität und Pathogenität aufgefallen. Einer Hongkonger Forschergruppe zufolge setzt diese Variante in besonders starkem Maße vor allem in der Lunge bestimmte entzündungsfördernde Stoffe (Zytokine, speziell Interleukin-6) frei, die normalerweise ganz allgemein die Immunantwort des Körpers gegen eingedrungene Erreger aktivieren. Diese übermäßige (exzessive) Zytokinfreisetzung (englisch cytokine storm) führt jedoch zu einer Überreaktion des Immunsystems und damit zu einer zusätzlichen Immunpathogenese durch die Zerstörung vor allem des Lungengewebes und in der Regel rasch zu einem schweren toxischen Schock und zu Multiorganversagen.
Im Frühjahr 2008 gab die Weltgesundheitsorganisation (WHO) ein neues, einheitliches Regelwerk für die Benennung der H5N1-Stämme bekannt.[18] So soll künftig der Fundort nicht mehr Bestandteil des Namens sein; seitdem wird beispielsweise der Fujian-Stamm als Clade 2.3.4 bezeichnet und der Qinghai-Stamm als Clade 2.2. Ziel des Regelwerks ist vor allem eine leichtere internationale Verständigung über die zahlreichen Varianten von A/H5N1.[19]
Nachweismethoden
Zum Nachweis von A/H5N1 kommt in der Regel eine abgestufte virologische Diagnostik zum Einsatz.
So stehen Schnelltests zum Nachweis von Influenza-A-Viren zur Verfügung, die auch in der Lage sind, A/H5N1-Viren zu erkennen. Als Untersuchungsmaterial werden hierfür Nasen- und Rachenabstriche genommen. Erste Ergebnisse liegen dann innerhalb von 20 bis 30 Minuten vor.
Unter Verwendung der für die Serologie geläufigen Antikörper können mit Hilfe von Sekundärantikörpern, die mit kolloidalen Goldpartikeln markiert wurden, die Serotypen im Transmissionselektronenmikroskop ebenfalls in weniger als einer halben Stunde unterschieden werden.
Für einen – genaueren – Labornachweis wird zunächst aus einer organischen Probe mit Hilfe der Polymerase-Kettenreaktion (qRT-PCR) das wegen der Funktionsvorgaben der beiden durch alternatives Spleißen erzeugten Proteine hochkonservierte Matrix-Gen (M-Gen) nachzuweisen versucht, welches in allen Influenza A-Viren vorkommt. Als Probenmaterial dienen meist Rachen- und Kloakenabstriche, welche von toten als auch lebenden Tieren gewonnen werden können. Bei toten Tieren können auch Gewebeproben (z. B. Lunge, Trachea, Gehirn) entnommen werden, welche aufgrund der höheren Viruslast ein sichereres Analysenergebnis erlauben.
Konnte auf diese Weise eine Infektion mit Influenza-A-Viren bestätigt werden, wird die PCR erneut eingesetzt, um mithilfe ausgewählter Erkennungssequenzen die Hämagglutinin-Variante 5 (H5) nachzuweisen sowie – parallel dazu – die Variante 1 der Neuraminidase (N1). Sind auch diese beiden Befunde positiv, folgt im dritten Schritt eine molekularbiologische Differenzierung zwischen niedrig pathogenen (LPAI) und hoch pathogenen (HPAI) Influenzaviren basierend auf der durch RT-PCR und DNA-Sequenzierung erhaltenen DNA-Sequenz der Hämagglutinin-Spaltstelle. Dies kann durch Sequenzierung der H5-Spaltstelle oder auch durch Sondenhybridisierung in einer qRT-PCR erfolgen. Das folgende Beispiel zeigt eine DNA- und Aminosäuresequenz von A/H5N1: AGA GAG AGA AGA AGA AAA AAG AGA*GGA CTA TTT / RERRRKKR*GLF. Die basische Aminosäuresequenz (Arginin, Lysin) an der Spaltstelle (*) deutet auf ein hochpathogenes Influenzavirus hin.[20] Die Unterscheidung zwischen hoch pathogenen und niedrig pathogen Influenzaviren kann auch über die Bestimmung des Pathogenitätsindex im Tierversuch erfolgen.
Zusätzlich zur molekularbiologischen Diagnostik – zumindest bei einem Erstausbruch – erfolgt die Virusisolierung im embryonierten Hühnerei. Klassisch erfolgt die Auswertung mittels Hämagglutinationshemmtest, welcher die Fähigkeit der Influenzaviren nachweist, Erythrozyten zu agglutinieren. Anschließend erfolgt eine Subtypisierung des Oberflächenproteins Hämagglutinin mit dem Hämagglutinations-Hemmtest gegen polyklonale Referenzseren. Analog kann der Neuraminidase-Typ mittels Neuraminidase-Hemmtest bestimmt werden.
Des Weiteren kommen serologische Tests zum Nachweis von Antikörpern gegen Influenzaviren zum Einsatz. Diese Tests können auch länger zurückliegende Erkrankungen erfassen, da nach der Erkrankung Antikörper (vor allem gegen H5 und N1) und zytotoxische T-Zellen (vor allem gegen NP und PB1) im Rekonvaleszenten nachweisbar sind. Die meistverwendete Methode ist der ELISA, welcher aufgrund der einfachen Handhabung und Automatisierbarkeit die Untersuchung großer Probenmengen bei niedrigen Kosten erlaubt. Solche ELISA-Tests können sowohl Subtyp-spezifisch (H5) als auch Virus-spezifisch Influenza-A-Viren nachweisen.
Der Hämagglutionationshemmtest kann in Kombination mit Referenzantigenen Antikörper gegen die Hämagglutinin-Typen H1 bis H16 feststellen.
Beim Plaque-Assay für Influenzaviren wird meistens die Zelllinie MDCK (englisch Madine Darby Canine Kidney) verwendet.
Herkunft
Chinesischen Forschern war es einer im Februar 2006 veröffentlichten Studie zufolge offenbar gelungen, den Entstehungsort der hochpathogenen H5N1-Variante einzugrenzen. Die Forscher hatten von Anfang 2004 bis Mitte 2005 auf Märkten in sechs südostchinesischen Provinzen mehr als 51.000 Enten, Gänse und Hühner untersucht und dabei festgestellt, dass ungefähr 2 von 100 Enten und Gänsen das Virus unauffällig in sich trugen. Auch in einigen Hühnern (0,26 %) kam das Virus vor. Sie konnten ferner drei regionale Cluster (Unterschiede) in den Genen der Viren nachweisen, und zwar mit Schwerpunkt in den südchinesischen Provinzen Guangdong, Hunan und Yunnan. Diese Unterschiede deuten den Forschern zufolge darauf hin, dass die Viren schon geraume Zeit zur Verfügung hatten, um sich zu verändern. Die chinesischen Forscher vermuten, dass A/H5N1 bereits seit mehr als 10 Jahren in Südchina zirkuliert, obwohl es erst 1997 den ersten großen Ausbruch in der Geflügelhaltung gegeben hat. Im Gegensatz zu den offiziellen politischen Institutionen Chinas gehen die Forscher auch davon aus, dass sich die Viren in Südchina in die heute bestehende hoch pathogene Variante entwickelt haben und von dort in die Nachbarstaaten gelangt sind; Virusproben aus Thailand ähneln nämlich sehr stark den Proben aus Guangdong.[21] Der beachtliche Durchseuchungsgrad der chinesischen Geflügelbestände mit A/H5N1 wird von Forschern auf die dort übliche Impfung vieler Tiere gegen Geflügelpest-Viren zurückgeführt, aufgrund derer viele Virusträger vor auffälligen Krankheitssymptomen geschützt sind.
Abstriche aus der Nase von 702 asymptomatischen indonesischen Schweinen, die zwischen 2005 und 2007 analysiert worden waren, erbrachten den Nachweis, dass 52 Tiere (7,4 %) mit A/H5N1-Viren infiziert waren.[22] Die Viren zeigten jeweils eine große Ähnlichkeit mit Vergleichsproben, die zur gleichen Zeit in der Nachbarschaft aufgrund von H1N1-Ausbrüchen unter Geflügel gewonnen worden waren; hieraus leiteten die Autoren die Vermutung ab, die Viren seien vom Geflügel auf die Schweine übergegangen. Eines der Virusisolate (A/swine/Banten/UT3062/2005) war aufgrund einer Mutation in der Lage, an einen Rezeptor zu binden, der sowohl bei Vögeln als auch beim Menschen in der Nase vorkommt. Diese Mutation war bis dahin aus Virusproben von Vögeln nicht bekannt, sondern mutmaßlich eine im Schwein vollzogene Anpassung an diese Tierart; die Mutation könne möglicherweise als Marker dienen für das Abschätzen des pandemischen Potentials auch anderer H5N1-Isolate.
Genveränderungen
Der Subtyp A/H5N1 gilt auch aus den schon oben dargestellten Erkenntnissen heute als besonders aggressiv (HPAI, Highly Pathogenic Avian Influenza). Der Virologe Robert G. Webster hebt als besondere Eigenschaft dieses Subtyps hervor, dass er, wie die Variante H7 und anders als alle anderen Subtypen, zuerst die Lunge befällt und sich anschließend im ganzen Körper ausbreitet und bei Vögeln auch Herz, Leber und Gehirn zerstört. Deshalb tötet er heute sehr schnell befallene Vögel, die nicht zu seinem Virusreservoir gehören, und er wird daher von Wissenschaftlern wegen seiner pathogenen Eigenschaften auf Interdependenzen mit anderen Stämmen und Überschreitungen der Artenbarriere aufmerksam beobachtet.
Vor der erwähnten und vor zwei weiteren nachgewiesenen Genveränderungen (die nach Expertenmeinung Ende 1996/Anfang 1997 und 2003 geschahen) war der Erreger bereits mehrfach in Europa aufgetreten, er galt aber als wenig aggressiv. Auch heute noch werden vereinzelt Wildvögel gefunden, die mit dieser minder pathogenen Variante infiziert sind, aber kaum Krankheitssymptome zeigen, so u. a. im Jahr 2004 in Frankreich und Mitte November 2005 bei einer Ente in der Nähe von Padua.
Erste Befunde
Eine der zunächst 2003 in Hongkong und in Vietnam und dann wieder Anfang 2006 bei den in der Türkei verstorbenen Kindern nachgewiesenen Genveränderungen (bezüglich einer Aminosäure an Position 223 des Hämagglutinin-Rezeptorproteins) erlaubt es den Viren laut einem Bericht in der Fachzeitschrift Nature[23], sich leichter als zuvor an menschliche Zellen zu binden. Eine zweite, ebenfalls bei den türkischen Kindern nachgewiesene Genveränderung bewirkt den Austausch von Glutaminsäure gegen Lysin in Position 627 seines Polymerase-Proteins, das den Viren dazu dient, ihr genetisches Material zu vervielfältigen. Diese Mutation wurde andernorts gleichfalls schon früher nachgewiesen, allerdings noch nie in Kombination mit der Mutation an Position 223 des Hämagglutinin-Rezeptorproteins. Sie war auch 2003 in den Niederlanden nachgewiesen worden, als dort ein Mann an einer A/H7N7-Infektion starb, und ist eine von insgesamt 10 Mutationen, die dem Virus der Spanischen Grippe die Fähigkeit zum weitgehend unbehinderten Übertritt auf den Menschen verliehen haben sollen. Die Veränderung am Polymerase-Protein erlaubt es den Viren, längere Zeit als zuvor in der relativ kühlen Nase eines Menschen zu überdauern, während das veränderte Rezeptorprotein eine erleichterte Bindung an die Schleimhautzellen der Nase ermöglicht. Die Weltgesundheitsorganisation hatte diese Befunde im Februar 2006 allerdings insoweit relativiert, als sie darauf hinwies, dass man nicht sicher wisse, welche spezifischen Mutationen nötig seien, damit A/H5N1 leichter und nachhaltig von Mensch zu Mensch übergehen könne.[24]
Einem Bericht der Zeitschrift New Scientist zufolge gingen britische Forscher im Jahr 2008 davon aus, dass bereits zwei bestimmte Mutationen am H5-Protein geeignet seien, die Bindung der Viren an Schleimhautzellen von Säugetieren deutlich zu erleichtern. Keine dieser Mutationen sei bisher aber in den umlaufenden Virusstämmen nachweisbar gewesen. Daraus könne man schließen, dass keine dieser Veränderungen einen selektiven Vorteil für die Viren bedeute, was das Risiko minimiere, dass beide Veränderungen zugleich aufträten.[25]
Ein Forscherteam um James Stevens vom Scripps Research Institute in La Jolla, Kalifornien, äußerte 2006 die Ansicht, dass die Influenza A/H5N1-Viren inzwischen den Erregern der humanen Influenza stärker ähneln, als zuvor vermutet. Die Oberflächen-Eiweiße von A/H5N1 würden mittlerweile mit denen der Erreger der Spanischen Grippe auffallende Ähnlichkeiten aufweisen. Bei dem im Jahre 1997 bei Enten isolierten H5N1-Stamm konnten sie weniger Gemeinsamkeiten feststellen. Sie befürchteten daher, dass nur noch wenige weitere Veränderungen auf der Oberfläche der A/H5N1-Viren ausreichen könnten, um sie hoch gefährlich für den Menschen zu machen.[26]
Umstrittene Experimente mit Frettchen
In einem Experiment niederländischer Forscher um Ron Fouchier vom Erasmus Medical Center in Rotterdam gelang es im Jahr 2011, Frettchen mit A/H5N1-Viren zu infizieren und die Viren danach aus den erkrankten Tieren auf Artgenossen zu übertragen. Von den beteiligten Forschern unwidersprochen blieben im Herbst und Winter 2011 Berichte, denen zufolge sich die Viren nach der zehnten derartigen Übertragung über die Luft verbreiteten und Frettchen in benachbarten Käfigen infizierten, die alsbald verendeten. Frettchen gelten in der Influenzaforschung als ein dem Menschen ähnliches Tiermodell, da die Verteilung und die Spezifität der Rezeptoren des Hämagglutinins sich gleichen, welche das Influenzavirus benutzt, um an die Zelle zu binden und mit dieser zu fusionieren. Diese besteht aus Sialinsäure-modifizierten Proteinen, welche beim Frettchen und dem Menschen in den oberen Atemwegen über eine α-2,6-glykosidische Bindung mit Galactose verbunden sind, in den aviären Stämmen ist diese gehäuft α-2,3-verknüpft. Beim Menschen kommt die α-2,3-Verknüpfung gehäuft jedoch vor allem in den unteren Atemwegen vor, was eine Freisetzung neugebildeter Virionen durch Husten und somit auch die Transmission erschwert.[27] Auf Grund dieser verschiedenen Verknüpfung können aviäre Influenzastämme (Vogelgrippe H5N1) nur schlecht auf und durch den Menschen übertragen werden. Daher liegt die Vermutung nahe, dass die Ergebnisse, welche man bei den Tests mit den Frettchen gewonnen hat, auch auf Menschen übertragbar sind.[28] Der Ausgangsstamm der Viren hatte bereits drei Mutationen aufgewiesen, von denen bekannt ist, dass sie A/H5N1 an einen Aufenthalt in Säugetieren anpassen. Durch die zehnfache Übertragung waren zwei neue Mutationen hinzugekommen, die sich in Kombination mit den drei Anfänglichen als fatal erwiesen.[29] Alle fünf Mutationen waren zuvor bereits einzeln in Vögeln nachgewiesen worden. Ab Ende 2011 führte dieses Experiment zu einer Diskussion über bioterroristische Risiken, falls Details der Studie veröffentlicht würden.[30][31][32][33][34][35]
Ende Januar 2012 gaben 39 Influenza-Forscher bekannt, ihre Arbeit 60 Tage lang freiwillig zu unterbrechen und auf weitere Experimente zur Übertragbarkeit von A/H5N1 zu verzichten. Die Gesundheitsbehörden sollten so Zeit zum Beschließen schärferer Sicherheitsmaßnahmen bekommen.[36][37] Wenige Tage später erklärten Mitglieder des US-amerikanischen National Science Advisory Board for Biosecurity (NSABB), dass auf eine vollständige Publikation der Forschungsergebnisse verzichtet werden solle. Das NSABB war von der US-Regierung beauftragt worden, eine Risikoabschätzung bezüglich Dual Use vorzulegen.[38] Zugleich hatte die Regierung der Niederlande darauf bestanden, dass Ron Fouchier seine geplante Veröffentlichung sich offiziell als „Export“ im Rahmen der EU-Bestimmungen zur Verhinderung der Verbreitung von Massenvernichtungswaffen genehmigen lassen müsse.[39]
Im Februar 2012 korrigierte Ron Fouchier die bis dahin diskutierten, angeblichen Ergebnisse seiner später in Science[40] publizierten Studie: Tatsächlich habe sich das mutierte Virus keineswegs wie ein pandemisches oder saisonales Virus in Aerosolen verbreitet. Nur wenn man die Viren gezielt in die Luftröhre oder in die Nasenwege eingebracht habe, seien die Frettchen verendet.[41] Anfang April 2012 wurde dann vom US National Science Advisory Board for Biosecurity die Erlaubnis zur Veröffentlichung der Forschungsergebnisse gegeben.[42]
Danach gab auch Yoshihiro Kawaoka von der School of Veterinary Medicine der University of Wisconsin–Madison Details zu einer ähnlichen Studie bekannt, die zuvor ebenfalls von der US-Behörde für Biosicherheit überprüft worden war; auch diese – im Mai 2012 in Nature veröffentlichte – Studie hatte zum Ergebnis, dass in Frettchen herangezogene H5N1-Viren leichter von Tier zu Tier übertragbar waren.[43][44]
Bekämpfungs- und Schutzmaßnahmen
Impfstoffentwicklung
Die Entwicklung von Impfstoffen gegen ein Virus kann umso rascher gelingen, je genauer dessen Aufbau den Forschern bekannt ist. Daher werden seit Jahrzehnten Proben neu aufgetretener Virusvarianten von den nationalen Gesundheitsbehörden über die Weltgesundheitsorganisation (WHO) kostenlos an Forschungseinrichtungen weitergegeben. Ab Ende 2006 weigerte sich Indonesien allerdings mehrere Monate, seine Virenproben der WHO zur Verfügung zu stellen, da das Land im Fall einer Pandemie keinen Nutzen von seinem Handeln habe: Alle bedeutenden Impfstoffproduzenten hätten ihren Sitz in Industrieländern, die nach Ausbruch einer Pandemie voraussichtlich Handelsverbote erlassen würden, um ihre eigene Bevölkerung mit dem dann mutmaßlich knappen Impfstoff zu versorgen. Im Mai 2007 kam es zu finanziellen Zusagen durch die WHO, worauf Indonesien bekundete, seine Kooperation mit der WHO wieder aufzunehmen.[45] Diese Zusage wurde aber erst im Mai 2008 konkretisiert, als Indonesien ankündigte, die relevanten Daten seiner Virusproben an der WHO vorbei einer neu errichteten Online-Datenbank zur Verfügung zu stellen.[46] Für die Impfstoffentwicklung sind jedoch normalerweise Virusproben nötig, deren Herausgabe Indonesien weiterhin behinderte.[47] Erst im April 2011 berichtete die WHO von einer „richtungsweisenden Übereinkunft“ („landmark agreement“), der zufolge die Impfstoffproduzenten – als Kompensation für die Weitergabe von Virenproben – mindestens zehn Prozent der im Pandemiefall produzierten Impfstoffmenge der WHO zur Weitergabe an bedürftige Regionen zur Verfügung stellen oder die lizenzfreie Produktion von Impfstoffen in den Entwicklungsländern erlauben sollen. Zudem sollen die mit der Auswertung von Virusproben befassten Forscher der Industrieländer „aktiv suchen“ nach Fachkollegen aus den Entwicklungsländern, mit denen sie gemeinsam wissenschaftliche Originalarbeiten in renommierten Fachzeitschriften veröffentlichen könnten.[48]
Aktive Immunisierung

Sowohl ein Forscherteam um Andrea Gambotto der University of Pittsburgh als auch eine Gruppe um Suryaprakash Sambhara von den Centers for Disease Control and Prevention (CDC) in Atlanta, beide USA, haben Anfang Februar 2006 neuartige Prototypen eines bislang bei Mäusen und Hühnern zuverlässig wirksamen Vogelgrippe-Impfstoffs gegen A/H5N1 vorgestellt.
Die Mitarbeiter von Andrea Gambotto nahmen harmlose Erkältungsviren (Adenoviren) und bauten diesen ein spezielles Gen des A/H5N1-Virus ein, das auf der Virusoberfläche Teile oder die Vollversion eines bestimmten Proteins des Vogelgrippevirus herstellt (exprimiert). Dabei handelt es sich um das so genannte Hämagglutinin (HA), welches sich auf der Oberfläche aller Grippeviren findet und ihnen dabei hilft, an die Wirtszellen anzudocken, damit sie anschließend in sie eindringen können.

Bei Mäusen, die mit derart gentechnisch erzeugtem Impfstoff behandelt wurden, waren sechs Tage nach der anschließenden Infektion mit der Virusvariante A/Vietnam/H5N1/1203/2004 keine Erreger mehr nachweisbar, und nach 70 Tagen war auch eine Immunität gegenüber A/H5N1 zu beobachten. Hühner waren sogar schon nach 21 Tagen vor der Vogelgrippe H5N1 geschützt, wenn ihnen dieser Impfstoff unter die Haut (subkutan) gespritzt wurde. Nach Aussagen der Wissenschaftler basiert der Wirkstoff auf gentechnisch veränderten Komponenten des lebenden Virus und aktiviere daher das Immunsystem effektiver als herkömmliche Grippeimpfungen.
Da die für den neuen Impfstoff verwendeten veränderten Viren nicht wie die herkömmlichen Grippe-Impfstoffe in befruchteten Hühnereiern, sondern in Zellkulturen gezüchtet werden, könne man sie nunmehr sehr schnell und in großen Mengen produzieren und auch ebenso schnell auf erfolgte Virusveränderungen zuschneiden. Damit sei eine vereinfachte und beschleunigte Impfstoffherstellung möglich geworden. Nach eigenen Angaben benötigten die Wissenschaftler in Pittsburgh nur 36 Tage bis zur Produktion ihrer Seren.
Die Forscher um Suryaprakash Sambhara in Atlanta benutzten ebenfalls Erkältungsviren als „Transporter“ für ein Gen des Virus. Bei ihnen überlebten alle mit diesem Impfstoff behandelten Mäuse eine anschließende Infektion mit A/H5N1, wobei sämtliche Viren innerhalb von vier Tagen in den Lungen der Tiere nicht mehr nachweisbar waren. Nach Angaben der Wissenschaftler sei ihr Impfstoff für verschiedene Untervarianten des Vogelgrippe-Virus einsetzbar und von den Mitarbeitern innerhalb von fünf bis sieben Wochen herzustellen.
Experten sind allerdings der Ansicht, dass noch viele zeitaufwändige Tests notwendig sind, bis eine wirksame Impfung von Menschen möglich wird. So könnten bis zur Marktreife der Impfstoffe drei bis vier Jahre vergehen.
Ein Forscherteam um John Treanor von der University of Rochester, US-Bundesstaat New York, hat Anfang 2006 einen auf herkömmliche Weise in Hühnereiern hergestellten Impfstoff gegen A/H5N1 auf seine Wirksamkeit beim Menschen getestet. Im Gegensatz zu der bei Impfstoffen gegen die humane Influenza verwendeten Dosis von 15 Mikrogramm erhielten die Probanden von diesen Wissenschaftlern nunmehr zwei Impfungen mit entweder 7,5 oder aber 90 Mikrogramm im Abstand von vier Wochen. In der Hochdosisgruppe erreichten 54 Prozent der Probanden nach der zweiten Impfung einen mittels Blutproben festgestellten Antikörperspiegel, der nach Expertenvermutung vermutlich vor einer Erkrankung schützt. Allerdings bewertet der Forscher Gregory Poland von der Mayo-Klinik in Rochester die von seinen Kollegen erzielte Schutzwirkung beim Menschen als schwach oder höchstens mittelmäßig. Außerdem weist er darauf hin, dass man für die mittlerweile kursierenden unterschiedlichen Varianten von A/H5N1 auch mit Sicherheit mehrere unterschiedliche Vakzine benötigt. Deshalb hält Poland viel eher die Förderung von moderneren Impfstoffproduktionsverfahren mittels Zellkulturen für erforderlich.
Ein Team um Thomas Mettenleiter vom Friedrich-Loeffler-Institut auf der Insel Riems hat 2005 den Prototyp für einen Impfstoff gegen Vogelgrippe H5N1 entwickelt, der Hühner vor dieser Viruserkrankung schützt und im Gegensatz zu herkömmlichen Impfstoffen eine eindeutige Unterscheidung von geimpften und infizierten Tieren erlaubt.[49]
Für ihre Experimente wandelten die Forscher ein vorhandenes Impfvirus gegen die Newcastle-Krankheit ab, welche durch ein RNA-Virus der Familie Paramyxoviridae, dem Newcastle disease virus (NDV) verursacht wird. Hierfür wurde durch reverse genetics eine Mutante des Hämagglutinin-Gens eines H5N2 Influenza-Virus in das NDV-Genom integriert; nach einer Transfektion konnten aktive Viruspartikel isoliert werden, welche neben den NDV-Oberflächenproteinen auch das H5-Protein besaßen. Die Effizienz der Versuche bei Hühnern deutete darauf hin, dass der Impfstoff sowohl vor der Newcastle-Krankheit wie auch der Vogelgrippe H5N1 schützt, da die so behandelten Tiere anschließend die Infektion hoher Mengen von Vogelgrippe- und ND-Viren überstanden und Antikörper gegen beide Erregerarten bildeten. Da mit diesem Impfstoff geimpfte Tiere nur Antikörper gegen Proteine des ND-Virus sowie des Hämagglutinins des Influenza-Virus bilden, können geimpfte Tiere von ungeimpften Tieren unterschieden werden. Hierfür wird mittels ELISA versucht, Antikörper gegen das Influenza-Nucleoprotein nachzuweisen, welches nicht im Impfvirus vorhanden ist. Sollte der Nachweis positiv sein, deutet dies auf eine Infektion des Tieres mit einem Influenzavirus hin. Der neue Impfstoff soll in weiteren Tests überprüft werden, kann jedoch günstigstenfalls um 2011 zugelassen werden.
Nach einem Forschungsbericht des Teams um Gary Nabel vom Vaccine Research Center der National Institutes of Health in Bethesda (USA) wäre es durchaus möglich, einen Impfstoff gegen eine möglicherweise in der Zukunft ausbrechende H5N1-Influenza-Pandemie zu entwickeln, noch bevor eine von Mensch zu Mensch direkt übertragbare Variante des Vogelgrippevirus in der Umwelt entstanden ist. Die Wissenschaftler haben sich auf einen kleinen Bereich des Hämagglutinin-Moleküls einer ungefährlichen H5N1-Laborvariante konzentriert, mit dem sich die Erreger an die Oberfläche der Wirtszelle anheften und in sie eindringen. Hierbei konnte man nachweisen, dass der wirtsseitige Bindungspartner, der sogenannte Sialinsäure-Rezeptor, bei Vögeln und Menschen aus einer anderen Salinsäurevariante besteht. Daher vermutet man, dass eine virusseitige Anpassung der HA-Bindungsstelle an diesen Unterschied einen wichtigen und notwendigen Schritt vom Vogel- zum Menschenvirus darstellt. Unter Vorwegnahme möglicher Evolutionsschritte haben die Forscher bei ihrer Virusvariante durch gezielte Mutationen mehrere Viren mit unterschiedlicher Anpassung der HA-Bindungsstelle an den menschlichen SA-Rezeptorer halten. Bei weiteren Versuchen stellten sie fest, dass Mäuse als Immunreaktion auf diese neuen Virusvarianten unter anderem auch Antikörper produzierten, welche gegen die spezielle Bindungsstelle des jeweiligen Virus gerichtet waren.
Darauf folgend konnte beobachtet werden, dass diese Antikörper einen guten Immunschutz gegenüber der jeweils verwendeten Virusvariante bewirkten. Damit könnten die veränderten Laborviren als Impfviren geeignet sein. Einer Resistenzentwicklung gegen einen derartigen Impfstoff steht die Tatsache entgegen, dass die Erreger die HA-Bindungsstelle nicht beliebig verändern können, da diese auch eine wichtige Funktion in ihrem Lebenszyklus besitzt. Nach Ansicht der Forscher könne man mit dem von ihnen erprobten Verfahren eine Reihe von Impfstoffprototypen herstellen, auf die im Ernstfall sehr schnell zurückgegriffen und mit denen große Vakzinmengen für flächendeckende Impfungen produziert werden können.[50]
Neue Impfstoffe
Daronrix war ein Pandemie-Impfstoff mit inaktivierten Grippeviren des Herstellers GlaxoSmithKline Biologicals. Ähnlich wie Prepandrix als präpandemischer Impfstoff handelt es sich um ein Spaltvakzin. Als erster Impfstoff seiner Art war er mit dem Virenstamm A/H5N1 (A/Vietnam/1194/2004) von der Europäischen Arzneimittelagentur am 21. März 2007 für die 27 EU-Staaten zugelassen worden, die Richtlinie CPMP/VEG/4986/03 ermöglicht es, den enthaltenen Stamm bei Vorliegen einer Pandemie durch den tatsächlich zirkulierenden Stamm auszutauschen.[51]
Focetria war ein Pandemie-Impfstoff mit dem Adjuvans MF59 des schweizerischen Unternehmens Novartis Vaccines and Diagnostics. In Vorstudien und einem ersten Zulassungsantrag wurde mit Influenza A/H5N3 und Influenza A/H9N2 gearbeitet, dann wurde in einem neuen Antrag auf Influenza A/H5N1 umgestellt. Als zweiter Impfstoff seiner Art ist er mit dem Virenstamm Influenza A/H5N1 (A/Vietnam/1194/2004) von der Europäischen Arzneimittelagentur am 8. Mai 2007 für die 27 EU-Staaten sowie Norwegen und Island zugelassen worden, die Richtlinie CPMP/VEG/4986/03 ermöglicht es, den enthaltenen Stamm bei Vorliegen einer Pandemie durch den tatsächlich zirkulierenden Stamm auszutauschen.[52]
Passive Immunisierung
Anfang 2006 hat ein Forschungsteam um Jaihai Lu von der Sun-Yat-sen-Universität in Guangzhou, Volksrepublik China, eine passive Impfung gegen A/H5N1 für Mäuse entwickelt. Die Forscher infizierten Pferde mit abgeschwächten A/H5N1-Viren und gewannen anschließend die gegen diese Erreger gebildeten Antikörper aus ihrem Blut. Danach schnitten sie mit einem Enzym ein bestimmtes Teilstück aus diesen Antikörpern, welches von dem Immunsystem der Mäuse nicht abgestoßen wird. Dieses Antikörperfragment wurde nun Mäusen injiziert, die 25 Stunden zuvor mit einer für sie normalerweise tödlichen H5N1-Virusdosis infiziert worden waren. Nach Angaben der chinesischen Forscher schützten 100 Mikrogramm der Antikörperfragmente alle Mäuse vor dem sonst sicheren Tod, denn sämtliche nur mit einem Placebo behandelten Tiere der Kontrollgruppe verstarben in der Regel nach etwa neun Stunden. Experten äußern jedoch hinsichtlich einer möglichen Anwendung dieses Verfahrens beim Menschen erhebliche Bedenken, da ein solcher passiver Impfstoff sich zwar schneller herstellen ließe als ein aktiver, er aber andererseits eine schlechtere Verträglichkeit besitzen und nur einen geringeren Immunschutz bewirken würde.
Gentechnische Ansätze
Britische Wissenschaftler von der Universität Cambridge, Universität Edinburgh und der Veterinary Laboratories Agency haben – laut einem Bericht in Science vom Januar 2011 – transgene Hühner entwickelt, welche die Geflügelpest nicht übertragen können. Die Hühner wurden mit einer Expressionskassette ausgestattet, welche ein Stück RNA produziert, die als Köder für Polymerase dient. Anstatt an das Virusgenom zu binden und dem Virus damit zur Replikation zur verhelfen, hängt sich die Polymerase dann an diesen Köder. Die transgenen Hühner starben zwar noch an der Geflügelpest, infizierten aber keine anderen Hühner mehr. Ziel ist die komplette Immunisierung von Hühnern gegen A/H5N1.[53][54]
Meldepflicht
In Österreich sind Infektionen mit dem Influenzavirus A/H5N1 oder einem anderen Vogelgrippevirus auch eine anzeigepflichtige Krankheit gemäß § 1 Abs. 1 Epidemiegesetz 1950. Die Meldepflicht bezieht sich auf Verdachts-, Erkrankungs- und Todesfälle. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz).
In Deutschland ist eine „zoonotische Influenza“ eine meldepflichtige Krankheit nach § 6 Absatz 1 des Infektionsschutzgesetzes (IfSG). Die namentliche Meldepflicht besteht bei Verdacht, Erkrankung und Tod. Sie betrifft vor allem die feststellenden Ärzte (vgl. § 8 IfSG). Zudem ist der direkte Nachweis von (jeglichen) Influenzaviren namentlich meldepflichtig nach § 7 IfSG, soweit der Nachweis auf eine akute Infektion hinweist. Diese Meldepflicht für den Erreger betrifft in erster Linie Labore bzw. deren Leitungen (vgl. ebenfalls § 8 IfSG).
Siehe auch
Literatur
- Xiyan Xu u. a.: Genetic characterization of the pathogenic Influenza A/Goose/Guangdong/1/96 (H5N1) Virus: Similarity of its hemagglutinin gene to those of H5N1 viruses from the 1997 outbreak in Hong Kong. In: Virology. Band 261, Nr. 1, 1999, S. 15–19, doi:10.1006/viro.1999.9820, Volltext (PDF)
- M. Hugh-Jones: Biological disasters of animal origin: the role and preparedness of veterinary and public health services. In: Revue scientifique et technique (International Office of Epizootics). Band 25, Nummer 1, April 2006, S. 421–7, 429, PMID 16796065 (Review).
Weblinks
- Robert Koch-Institut: Vorgehen bei Verdacht auf Erkrankung eines Menschen. (PDF; 112 kB) In: Epidemiologisches Bulletin. Nr. 8, Februar 2006
- Friedrich-Loeffler-Institut: Antworten auf Fragen zur hoch pathogenen Aviären Influenza (HPAI, Geflügelpest, „Vogelgrippe“). (PDF) Stand: 19. Juli 2007
- Bundesinstitut für Risikobewertung: Fragen und Antworten zur Hygiene bei Lebensmitteln und Bedarfsgegenständen in Zeiten der Vogelgrippe - Wie kann ich mich und meine Familie schützen?
- Weltorganisation für Tiergesundheit (OIE): Avian Influenza Portal. Aktuelle Daten zur weltweiten Situation bezüglich der aviären Influenza (englisch)
- A/H5N1-Datenbank des US-amerikanischen National Center for Biotechnology Information (NCBI)
Einzelnachweise
- ↑ a b ICTV Taxonomy history: Akabane orthobunyavirus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- ↑ ICTV Master Species List 2018b.v2. ( vom 30. März 2019 im Internet Archive) MSL #34, März 2019
- ↑ Negative Sense RNA Viruses: Orthomyxoviridae, in: ICTV 9th Report (2011)
- ↑ siehe Vogelgrippe H5N1#Übertragungswege von Tier zu Tier und Verbreitung von H5N1
- ↑ Josanne H. Verhagen et al.: How a virus travels the world. In: Science, Band 347, Nr. 6222, 2015, S. 616–617; doi:10.1126/science.aaa6724 (englisch).
- ↑ Xiyan Xu et al.: Genetic characterization of the pathogenic Influenza A/Goose/Guangdong/1/96 (H5N1) Virus: Similarity of its hemagglutinin gene to those of H5N1 viruses from the 1997 outbreak in Hong Kong. In: Virology, Band 261, 1999, S. 15–19; Volltext (PDF, englisch)
- ↑ Yoshi Kawaoka, Robert G. Webster: Sequence requirements for cleavage activation of influenza virus hemagglutinin expressed in mammalian cells. In: Proceedings of the National Academy of Sciences of the United States of America. Band 85, Nummer 2, Januar 1988, S. 324–328, ISSN 0027-8424. PMID 2829180. PMC 279540 (freier Volltext).
- ↑ S. Fukuyama, Y. Kawaoka: The pathogenesis of influenza virus infections: the contributions of virus and host factors. In: Current Opinion in Immunology. Band 23, Nummer 4, August 2011, S. 481–486, ISSN 1879-0372. doi:10.1016/j.coi.2011.07.016. PMID 21840185. PMC 3163725 (freier Volltext).
- ↑ I. Ramos, A. Fernandez-Sesma: Innate immunity to H5N1 influenza viruses in humans. In: Viruses. Band 4, Nummer 12, Dezember 2012, S. 3363–3388, ISSN 1999-4915. PMID 23342363. PMC 3528270 (freier Volltext).
- ↑ M. Hatta, P. Gao, P. Halfmann, Y. Kawaoka: Molecular basis for high virulence of Hong Kong H5N1 influenza A viruses. In: Science. Band 293, Nummer 5536, September 2001, S. 1840–1842, ISSN 0036-8075. doi:10.1126/science.1062882. PMID 11546875.
- ↑ a b E. de Wit, Y. Kawaoka, M. D. de Jong, R. A. Fouchier: Pathogenicity of highly pathogenic avian influenza virus in mammals. In: Vaccine. Band 26 Suppl 4, September 2008, S. D54–D58, ISSN 0264-410X. PMID 19230161. PMC 2605681 (freier Volltext).
- ↑ Q. M. Le, M. Kiso, K. Someya, Y. T. Sakai, T. H. Nguyen, K. H. Nguyen, N. D. Pham, H. H. Nguyen, S. Yamada, Y. Muramoto, T. Horimoto, A. Takada, H. Goto, T. Suzuki, Y. Suzuki, Y. Kawaoka: Avian flu: isolation of drug-resistant H5N1 virus. In: Nature. Band 437, Nummer 7062, Oktober 2005, S. 1108, ISSN 1476-4687. doi:10.1038/4371108a. PMID 16228009.
- ↑ G. M. Conenello, D. Zamarin, L. A. Perrone, Terence Tumpey, Peter Palese: A single mutation in the PB1-F2 of H5N1 (HK/97) and 1918 influenza A viruses contributes to increased virulence. In: PLoS pathogens. Band 3, Nummer 10, Oktober 2007, S. 1414–1421, ISSN 1553-7374. doi:10.1371/journal.ppat.0030141. PMID 17922571. PMC 2000966 (freier Volltext).
- ↑ Kyoko Shinya et al.: Avian flu: Influenza virus receptors in the human airway. In: Nature, Band 440, S. 435–436; doi:10.1038/440435a
- ↑ C. Korteweg, J. Gu: Pathology, molecular biology, and pathogenesis of avian influenza A (H5N1) infection in humans. In: The American journal of pathology. Band 172, Nummer 5, Mai 2008, S. 1155–1170, ISSN 1525-2191. doi:10.2353/ajpath.2008.070791. PMID 18403604. PMC 2329826 (freier Volltext).
- ↑ Handreichung für Krankenhäuser und niedergelassene Ärzte: Infektionen des Menschen mit aviären Influenzaviren. Maßnahmen und Vorgehen. (PDF; 1,7 MB), Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit (Hrsg.), 3. Ausgabe vom 15. März 2006, Erlangen 2006, S. 5
- ↑ Was ist Vogelgrippe? Grundlagen. Auf: lungeninformationsdienst.de, Dump vom 25. März 2018
- ↑ cdc.gov vom 7. Juli 2008: Towards a unified nomenclature system for the highly pathogenic H5N1 avian influenza viruses.
Siehe dazu auch: who.int vom Oktober 2011: Updated unified nomenclature system for the highly pathogenic H5N1 avian influenza viruses. - ↑ www.who.int (PDF; 42 kB) (PDF): Antigenic and genetic characteristics of H5N1 viruses and candidate H5N1 vaccine viruses developed for potential use as pre-pandemic vaccines.
- ↑ Hoffmann et al.: Rapid and Highly Sensitive Pathotyping of Avian Influenza A H5N1 Virus by Using Real-Time Reverse Transcription-PCR. In: J. Clin. Microbiol., Band 45, Nr. 2, 2007, S. 600–603.
- ↑ Dennis Normile: Evidence Points to Migratory Birds in H5N1 Spread. In: Science, Band 311, Nr. 5765, 2006, S. 1225
- ↑ Chairul A. Nidom et al.: Influenza A (H5N1) Viruses from Pigs, Indonesia. In: Emerging Infectious Diseases, Band 16, Nr. 10, 2010, doi:10.3201/eid1610.100508
- ↑ Declan Butler: Alarms ring over bird flu mutations. Turkish virus shows increased affinity for humans. In: Nature, Band 439, 2006, S. 248–249, doi:10.1038/439248a
- ↑ who.int vom 20. Februar 2006: Avian influenza: significance of mutations in the H5N1 virus.
- ↑ Bird flu is out there just biding its time. In: New Scientist, 20. September 2008, S. 8
- ↑ wörtlich: „the species barrier […] can be circumvented by changes at only two positions“. James Stevens et al.: Glycan Microarray Analysis of the Hemagglutinins from Modern and Pandemic Influenza Viruses Reveals Different Receptor Specificities. In: J. Mol. Biol., Band 355, 2006, S. 1143–1155; doi:10.1016/j.jmb.2005.11.002, Volltext (PDF)
- ↑ L. Yao, C. Korteweg, W. Hsueh, J. Gu: Avian influenza receptor expression in H5N1-infected and noninfected human tissues. In: FASEB J. (2008), Band 22(3), S. 733–40. PMID 17925493.
- ↑ Martin Enserink: Controversial Studies Give a Deadly Flu Virus Wings. In: Science, Band 334, Nr. 6060, 2011, S. 1192–1193, doi:10.1126/science.334.6060.1192
- ↑ Debora MacKenzie: Five easy steps to bird flu pandemic. In: New Scientist, 24. September 2011, S. 14.
- ↑ nature.com: Mutant Flu. Übersicht über Veröffentlichungen in der Fachzeitschrift Nature.
sciencemag.org: Public Health, Biosecurity, and H5N1. Übersicht über Veröffentlichungen in der Fachzeitschrift Science - ↑ Ulrich Bahnsen: Bioterrorismus-Debatte: Tödliche Viren zu erschaffen ist heikel, aber richtig. In: Zeit Online. 29. November 2011.
- ↑ Heidi Ledford: Call to censor flu studies draws fire. In: Nature. 481, 2012, S. 9–10, doi:10.1038/481009a.
- ↑ Peter Palese: Don’t censor life-saving science. In: Nature. 481, 2012, S. 115–115, doi:10.1038/481115a.
- ↑ Thomas V. Inglesby: Engineered H5N1: A Rare Time for Restraint in Science. In: Annals of Internal Medicine. Band 156, Nr. 6, 2012, S. 460–462, Volltext ISSN 1539-3704. PMID 22282173.
- ↑ Andrew T. Pavia: Laboratory Creation of a Highly Transmissible H5N1 Influenza Virus: Balancing Substantial Risks and Real Benefits. In: Annals of internal medicine. Band 156, Nr. 6, S. 463–465, Volltext. ISSN 1539-3704. PMID 22282172.
- ↑ Ron A. M. Fouchier et al.: Pause on Avian Flu Transmission Research. In: Science; doi:10.1126/science.1219412.
- ↑ Vogelgrippe-Forscher stoppen Arbeit am Supervirus. Zeit Online, 21. Januar 2012.
- ↑ Kenneth I. Berns et al.: Adaptations of Avian Flu Virus Are a Cause for Concern. In: Science, 31. Januar 2012; sciencemag.org (PDF; 284 kB) doi:10.1126/science.1217994
- ↑ sciencemag.org vom 25. September 2013: Flu Researcher Ron Fouchier Loses Legal Fight Over H5N1 Studies.
- ↑ Sander Herfst et al.: Airborne Transmission of Influenza A/H5N1 Virus Between Ferrets. In: Science, Band 336, Nr. 6088, 2012, S. 1534–1541; doi:10.1126/science.1213362
Second mutant-flu paper published. Just five mutations allow H5N1 to spread between ferrets. nature.com, 21. Juni 2012. - ↑ Avian-flu review. In: Nature, Band 483, 2012, S. 128
nature.com ( vom 7. März 2012 im Internet Archive) vom 28. Februar 2012: Biosecurity group to review new avian flu data. Zitat: „Fouchier did say that the mutant virus ‚does not spread yet like a pandemic or seasonal flu virus‘ and that ferrets do not die when infected through aerosol transmission. Only when the virus was physically implanted into the trachea or nasal passages of ferrets did the infected animals die.“ - ↑ nature.com vom 30. März 2012: US biosecurity board revises stance on mutant-flu studies.
- ↑ Masaki Imai et al.: Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. In: Nature; Online-Vorabveröffentlichung, 2. Mai 2012, doi:10.1038/nature10831
- ↑ Mutations behind flu spread revealed. ( vom 6. April 2012 im Internet Archive) nature.com, 4. April 2012.
- ↑ zur Übersicht siehe: Martin Enserink, Indonesia earns flu accord at world health assembly. In: Science, Band 316, Nr. 5828, 2007, S. 1108, doi:10.1126/science.316.5828.1108
- ↑ web.resourceshelf.com ( vom 9. August 2014 im Internet Archive) „Indonesia rebuffs WHO, hands bird flu data to new public database instead.“ Meldung der Nachrichtenagentur ap vom 15. Mai 2008
- ↑ New Scientist vom 24. Mai 2008, S. 5. An gleicher Stelle heißt es, Indonesien habe von den bis Mitte Mai im Land bekannt gewordenen 16 Erkrankungsfällen des Jahres 2008 nur zwei Virusproben der WHO zur Verfügung gestellt.
- ↑ Martin Enserink: ‚Breakthrough‘ Deal on Flu Strains Has Modest Provisions. In: Science, Band 332, Nr. 6029, S. 525, doi:10.1126/science.332.6029.525
- ↑ Jutta Veits et al.: Newcastle disease virus expressing H5 hemagglutinin gene protects chickens against Newcastle disease and avian influenza. In: PNAS, Band 103, Nr. 21, 2006, S. 8197–8202; doi:10.1073/pnas.0602461103
- ↑ Zhi-Yong Yang et al.: Immunization by Avian H5 Influenza Hemagglutinin Mutants with Altered Receptor Binding Specificity. In: Science. Band 317, Nr. 5839, 2007, S. 825–828; doi:10.1126/science.1135165.
- ↑ Öffentlicher Beurteilungsbericht und Produktinformation zu Daronrix. (Seite nicht mehr abrufbar, festgestellt im Juli 2025. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. Dump vom 23. Dezember 2015.
- ↑ Öffentlicher Beurteilungsbericht und Produktinformation zu Focetria. Dump vom 23. Dezember 2015
- ↑ Martin Enserink: Transgenic Chickens Could Thwart Bird Flu, Curb Pandemic Risk. In: Science. Band 331, Nr. 6014, 2011, S. 132–133, doi:10.1126/science.331.6014.132-a.
- ↑ Jon Lyall et al.: Suppression of Avian Influenza Transmission in Genetically Modified Chickens. In: Science. Band 331, Nr. 6014, 2011, S. 223–226; doi:10.1126/science.1198020.
Auf dieser Seite verwendete Medien
- Bildbeschreibung: 3D Modell Influenzavirus
Colorized transmission electron micrograph of Avian influenza A H5N1 viruses (seen in gold) grown in MDCK cells (seen in green). Avian influenza A viruses do not usually infect humans; however, several instances of human infections and outbreaks have been reported since 1997. When such infections occur, public health authorities monitor these situations closely.
Hemagglutinin. Ribbon diagram of hemagglutinin molecule. Source: The National Center for Biotechology Information.
The National Center for Biotechology Information is a division of the National Library of Medicine, which is a division of the National Institutes of Health, which come under the jurisdiction of the US Department of Health and Human Services. Material made available by these institutions on line may be freely used as with all other US Federal government agencies.
The NCBI runs several biomedical databases of enormous importance to doctors and scientists around the world. One of them is MMDB, a bank of "experimentally determined three-dimensional biomolecular structures." These are freely available on their website in an open access fashion. The NCBI places no restrictions on their access and use, except to ask that appropriate crediting is observed. The structures database consists of 3d video imagery of important proteins and other structures that can be visualized with Cn3D software. The above image is a still that I captured from one of the dozens of free files of Hemagglutinin. In this sense, this image is derivative. I hereby declare that I claim no copyright whatsoever over this image, for my part. As far as the source of the image is concerned, this was as stated released freely by the NCBI with no restriction on its use. I am placing the NIH and HHS tags below (there is no NCBI tag on Wikipedia yet).Description: This transmission electron micrograph (TEM), taken at a magnification of 150,000x, revealed the ultrastructural details of an avian influenza A (H5N1) virion, a type of bird flu virus which is a subtype of avian influenza A. At this magnification, one may note the stippled appearance of the roughened surface of the proteinaceous coat encasing the virion.
Photo Credit: Cynthia Goldsmith/ Jackie Katz
Copyright Restrictions: None - This image is in the public domain and thus free of any copyright restrictions. As a matter of courtesy we request that the content provider be credited and notified in any public or private usage of this image.



