Gold(III)-chlorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Gold(III)-chlorid | |||||||||||||||
| Andere Namen | Goldtrichlorid | |||||||||||||||
| Summenformel | AuCl3 (Au2Cl6) | |||||||||||||||
| Kurzbeschreibung | dunkelorangerote Kristallnadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 303,33 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 3,9 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | gut in Wasser (680 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | noch nicht festgelegt[1] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | −117,6 kJ/mol[3] | |||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gold(III)-chlorid mit der Verhältnisformel AuCl3 (und der Summenformel Au2Cl6) ist eine der wichtigsten Goldverbindungen. Andere Goldchloride sind AuCl und AuCl2. AuCl2 ist allerdings keine Gold(II)-Verbindung, sondern eine gemischtvalente Au(I)-/Au(III)-Verbindung.
Gewinnung und Darstellung
Gold(III)-chlorid wird durch Überleiten von Chlorgas über feinverteiltes Gold bei 250 °C hergestellt.[4]
Eigenschaften
Physikalische Eigenschaften

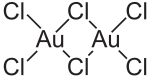
AuCl3 liegt sowohl im Festkörper als auch in der Dampfphase als Dimer Au2Cl6 vor. Gleiches gilt auch für das Goldbromid AuBr3. Im Gegensatz zum ebenfalls dimeren Aluminiumchlorid sind die Gold(III)-chlorid-Dimere eben angeordnet, die AuCl4-Einheit ist quadratisch-planar. Bei (AlCl3)2 ist sie tetraedrisch aufgebaut und die Brückenatome liegen ober- und unterhalb der Ebene. Die Kristallstruktur ist monoklin mit der Raumgruppe P21/c (Raumgruppen-Nr. 14) und den Gitterparametern a = 6,57 Å, b = 11,04 Å, c = 6,44 Å und β = 113,3°.[5] Die Au-Cl-Bindung ist stark kovalent aufgebaut, dies ist durch die (vergleichsweise) hohe Elektronegativität des Goldes und die hohe Oxidationsstufe bedingt.
Gold(III)-chlorid ist sehr hygroskopisch und gut in Wasser und Ethanol löslich.
Chemische Eigenschaften

Mit +3 ist dies die stabilste Oxidationsstufe von Gold in Verbindungen und Komplexen.
Bei Temperaturen über 250 °C zerfällt AuCl3 in AuCl und Cl2.
AuCl3 ist eine Lewis-Säure und bildet viele Komplexe der Form M+AuCl4− (Tetrachloroaurate). M kann beispielsweise Kalium sein (Kaliumtetrachloroaurat(III)). Das AuCl4−-Ion ist in wässriger Lösung nicht sehr stabil.
In Salzsäure löst sich AuCl3 unter Bildung von Tetrachloridogoldsäure.
In wässriger Lösung reagiert AuCl3 mit Alkalihydroxiden (beispielsweise Natriumhydroxid) zu Au(OH)3. Dieses reagiert beim Erhitzen an der Luft zu Gold(III)-oxid Au2O3 und weiter zu metallischem Gold.
Verwendung
Gold(III)-chlorid dient häufig als Ausgangssubstanz zur Herstellung anderer Goldverbindungen und Komplexe. Ein Beispiel ist die Herstellung des Cyanid-Komplexes KAu(CN)4
Anwendungen in der organischen Chemie:
Gold(III)-Salze, vor allem NaAuCl4 (aus AuCl3 und Natriumchlorid) können in der organischen Synthese als Katalysator in Reaktionen mit Alkinen eingesetzt werden. Sie dienen dort als ungiftiger Ersatz für Quecksilber(II)-Salze. Ein wichtiges Beispiel ist die Hydratation von terminalen Alkinen zu Methylketonen in hoher Ausbeute. Auch Amine kann man auf ähnliche Weise herstellen.[6]

Gold(III)-chlorid kann als milder Katalysator für die Alkylierung von aromatischen und heteroaromatischen Verbindungen genutzt werden. Ein Beispiel ist die Alkylierung von 2-Methylfuran mit Methylvinylketon.[7]

Aus Furanderivaten und Alkinen kann in einer Umlagerung unter Katalyse von Gold(III)-chlorid ein Phenol gebildet werden.[8]

Literatur
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 780.
Einzelnachweise
- ↑ a b c d Eintrag zu Gold(III)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c Datenblatt Gold(III)-chlorid bei Alfa Aesar, abgerufen am 18. Januar 2010 (Seite nicht mehr abrufbar).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-5.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1013.
- ↑ E.S. Clark, D.H. Templeton, C.H. MacGillavry: The crystal structure of gold(III)chloride. In: Acta Crystallographica, 11, 1958, S. 284–288, doi:10.1107/S0365110X58000694.
- ↑ Y. Fukuda, K. Utimoto: Effective Transformation of Unactivated Alkynes into Ketones or Acetals by Means of Au(III) Catalyst. In: J. Org. Chem., 1991, 56, S. 3729–3731, doi:10.1021/jo00011a058.
- ↑ Gerald Dyker: An Eldorado for Homogeneous Catalysis? In: Organic Synthesis Highlights V, H.-G. Schmalz, T. Wirth (eds.), Wiley-VCH, Weinheim 2003, S. 48–55.
- ↑ A. S. K. Hashmi, T. M. Frost, J. W. Bats: Highly Selective Gold-Catalyzed Arene Synthesis. In: J. Am. Chem. Soc., 2000, 122, S. 11553–11554, doi:10.1021/ja005570d
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
An unusual reaction between a furan and a tethered alkyne in the presence of w:gold(III) chloride, to form a new aromatic system as a phenol. Example chosen from G. Dyker, An Eldorado for Homogeneous Catalysis?, in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.), pp 48-55, Wiley-VCH, Weinheim, 2003. Originally uploaded gif: File:AuCl3 phenol synthesis.gif
Alkylierung von 2-Methylfuran mit Methylvinylketon katalysiert durch Gold(III)-chlorid in Acetonitril als Lösungsmittel
Struktur von Gold(III)-chlorid
Autor/Urheber: Diese Vektorgrafik wurde von v mit Adobe Illustrator erstellt., Lizenz: CC0
The structure of w:gold(III) chloride in the solid state.
Concentrated aqueous solution of gold(III) chloride (auric chloride)
Beispiel einer NaAuCl4-katalysierten Alkin-Hydratationsreaktion in einem Methanol-Wasser-Gemisch als Lösungsmittel








