Glucocerebrosidase
| Glucocerebrosidase | ||
|---|---|---|
 | ||
| Bändermodell des GBA-Tetramer, nach PDB 3GXI | ||
Vorhandene Strukturdaten: 1OGS, 1Y7V, 2F61, 2J25, 2NSX, 2NT0, 2NT1, 2V3D, 2V3E, 2V3F, 2VT0, 2WCG, 2WKL, 2XWD, 2XWE, 3GXD, 3GXF, 3GXI, 3GXM, 3KE0, 3KEH, 3RIK, 3RIL | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 536 Aminosäuren | |
| Kofaktor | Saposin-C, anionische Phospholipide | |
| Isoformen | 3 | |
| Bezeichner | ||
| Gen-Namen | GBA GBA1; GCB; GLUC | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | A16AB01 A16AB02 | |
| DrugBank | DB00053 | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.2.1.45, Glycosidase | |
| Reaktionsart | glycolytische Spaltung | |
| Substrat | Glucocerebrosid (D-Glucosyl-N-Acylsphingosin), Wasser | |
| Produkte | D-Glucose und N-Acylsphingosin | |
| Vorkommen | ||
| Homologie-Familie | Glycosylceramidase | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2629 | 14466 |
| Ensembl | ENSG00000177628 | ENSMUSG00000028048 |
| UniProt | P04062 | P17439 |
| Refseq (mRNA) | NM_000157 | NM_001077411 |
| Refseq (Protein) | NP_000148 | NP_001070879 |
| Genlocus | Chr 1: 155.23 – 155.24 Mb | Chr 3: 89.2 – 89.21 Mb |
| PubMed-Suche | 2629 | 14466 |
Glucocerebrosidase (im deutschen Sprachraum auch Glukozerebrosidase, chemisch auch Glucosylceramidase) ist ein Enzym, das die Hydrolyse der β-glucosidischen Bindung von Glucocerebrosid (D-Glucosyl-N-Acylsphingosin), einer Zwischenstufe des Glycolipid-Stoffwechsels, katalysiert. Die Glucosylceramidase ist ein lysosomales Protein.
Mutationen in dem entsprechenden Gen sind die Ursache des Morbus Gaucher, einer lysosomalen Speicherkrankheit. Die vom Enzym abgeleiteten Wirkstoffe Alglucerase, Velaglucerase und Imiglucerase werden als Ersatz bei dieser Mangelkrankheit verabreicht.[1]
Mittlerweile wird auch ein erhöhtes Risiko von heterozygoten Trägern von Glucocerebrosidasemutationen für Morbus Parkinson beobachtet. Insbesondere tritt die Erkrankung früher auf als bei der Normalbevölkerung. Die bei Parkinson feststellbare Anhäufung von α-Synuclein in den Lysosomen ist direkt auf einen Glucosylceramidase-Mangel zurückzuführen.[2][3][4]
Katalysierte Reaktion
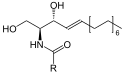
Von β-D-Glucosylceramid wird Glukose abgespalten.
Literatur
- S. Lesage, M. Anheim u. a.: Large-scale screening of the Gaucher's disease-related glucocerebrosidase gene in Europeans with Parkinson's disease. In: Human molecular genetics. Band 20, Nummer 1, Januar 2011, S. 202–210, doi:10.1093/hmg/ddq454. PMID 20947659.
- V. Cullen, S. P. Sardi u. a.: Acid β-glucosidase mutants linked to Gaucher disease, Parkinson disease, and Lewy body dementia alter α-synuclein processing. In: Annals of neurology. Band 69, Nummer 6, Juni 2011, S. 940–953, doi:10.1002/ana.22400. PMID 21472771.
- K. Brockmann, K. Srulijes u. a.: GBA-associated PD presents with nonmotor characteristics. In: Neurology. Band 77, Nummer 3, Juli 2011, S. 276–280, doi:10.1212/WNL.0b013e318225ab77. PMID 21734182.
Einzelnachweise
- ↑ Horowitz M, Zimran A: Mutations causing Gaucher disease. In: Hum. Mutat. 3. Jahrgang, Nr. 1, 1994, S. 1–11, doi:10.1002/humu.1380030102, PMID 8118460.
- ↑ Aharon-Peretz J, Rosenbaum H, Gershoni-Baruch R: Mutations in the glucocerebrosidase gene and Parkinson's disease in Ashkenazi Jews. N Engl J Med. 2004 Nov 4;351(19):1972-7. PMID 15525722
- ↑ T. M. Dawson, V. L. Dawson: A lysosomal lair for a pathogenic protein pair. In: Science Translational Medicine. Band 3, Nummer 91, Juli 2011, S. 91ps28, doi:10.1126/scitranslmed.3002808. PMID 21753118.
- ↑ J. R. Mazzulli, Y. H. Xu u. a.: Gaucher disease glucocerebrosidase and α-synuclein form a bidirectional pathogenic loop in synucleinopathies. In: Cell. Band 146, Nummer 1, Juli 2011, S. 37–52. doi:10.1016/j.cell.2011.06.001. PMID 21700325. PMC 3132082 (freier Volltext).
Weblinks
- Proteopedia: Acid-β-glucosidase (engl.)
Auf dieser Seite verwendete Medien
Struktur von beta-D-Glucosylceramid
Grafik des Molekularstruktur von jenem Protein, das mit 3gxi code registriert ist.
Struktur von Ceramid