Gassman-Indol-Synthese
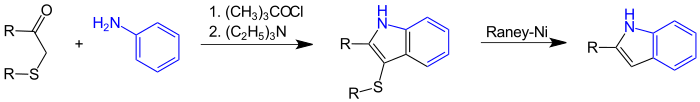
Die Gassman-Indol-Synthese ist eine Variante der Gassman-Reaktion, die – ausgehend von Anilin oder Anilin-Derivaten – zu substituierten Indolen führt. Sie wurde erstmals 1973 von Paul G. Gassman veröffentlicht.[1] Dabei wird unter aufeinanderfolgender Einwirkung von tert-Butylhypochlorit und Triethylamin ein Thioether mit einem 3-Indolylring gebildet, der mit Raney-Nickel zu dem entsprechenden Indol-Derival entschwefelt werden kann:
In dem folgenden Schema ist ein möglicher Reaktionsmechanismus beschrieben:

Anilin oder mono-N-alkylierte Aniline werden in einer ersten Stufe mit tert-Butylhypochlorit (1) zum entsprechenden N-Chloranilin (3) umgesetzt, das wiederum mit einem β-Carbonylsulfid zur Reaktion gebracht wird. Das entstehende Zwischenprodukt 4 kann anschließend durch Zugabe einer Base, üblicherweise Triethylamin, in das Endprodukt 9 überführt werden. Die ganze Synthese kann als Eintopfreaktion ohne Isolation der Zwischenprodukte geführt werden. Der Thioether 9 kann durch Hydrogenolyse, zum Beispiel mit Raney-Nickel, einfach entschwefelt werden unter Bildung des 2-substituierten Indols 10.[2]
Einzelnachweise
- ↑ Paul G. Gassman, T. J. Van Bergen, Gordon. Gruetzmacher: Use of halogen-sulfide complexes in the synthesis of indoles, oxindoles, and alkylated aromatic amines. In: Journal of the American Chemical Society. Band 95, Nr. 19, September 1973, S. 6508–6509, doi:10.1021/ja00800a088.
- ↑ Jie Jack Li: Name reactions. Springer, Berlin 2006, ISBN 978-3-540-30030-4, S. 257–258, doi:10.1007/3-540-30031-7_114.
Auf dieser Seite verwendete Medien
Autor/Urheber: Jü, Lizenz: CC BY-SA 4.0
Gassman-Indol-Synthese (Übersichtsreaktion)
Autor/Urheber: Jü, Lizenz: CC BY-SA 4.0
Mechanismus der Gassman-Indol-Synthese

