Fulvestrant
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
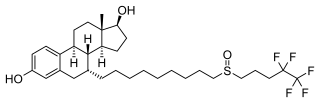 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Fulvestrant | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C32H47F5O3S | |||||||||||||||||||||
| Kurzbeschreibung | weißer, geruchloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | L02BA03 | |||||||||||||||||||||
| Wirkstoffklasse | Antiestrogene (selektive Estrogenrezeptor-Degrader[3]), antineoplastische Wirkstoffe[4] | |||||||||||||||||||||
| Wirkmechanismus | Estrogenrezeptor-Antagonismus[5] | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 606,77 g·mol−1[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | löslich in DMSO und Ethanol,[2] praktisch unlöslich in Wasser (20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | 0,0000057 mg·L−1 (LC50, Fisch (Pimephales promelas), 42 Tage)[8] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Fulvestrant ist ein Arzneistoff aus der Klasse der Estrogenrezeptor-Antagonisten und wird bei bestimmten Patientinnen mit Brustkrebs eingesetzt.[5]
Eigenschaften
Fulvestrant ist eine Verbindung aus der Gruppe der Steroide. Es hat sechs chirale C-Atome und eine stereogene Sulfoxidgruppe in der Seitenkette. Der Wirkstoff ist ein Gemisch zweier Diastereomere (Epimer A und B), die sich in der Konfiguration am S-Atom unterscheiden. Pharmazeutische Qualitäten der Substanz bestehen zu 42 bis 48 % aus dem Epimer A und zu 52 bis 58 % aus dem Epimer B. Die Substanz ist ein weißes bis fast weißes Pulver, das praktisch unlöslich in Wasser und leicht löslich in Ethanol und Methylenchlorid ist.[9]
Präparate und Darreichungsform
Fulvestrant wurde durch Astra Zeneca im März 2004 unter der Bezeichnung Faslodex als Fertigspritze mit 250 mg/ 5 ml Fulvestrant auf dem deutschen Markt eingeführt.[10] Seit 2015 sind in Deutschland auch Generika verfügbar.[11] Fulvestrant liegt in diesen Präparaten in Ethanol und Rizinusöl gelöst vor, weiterhin sind Benzylalkohol und Benzylbenzoat enthalten.[12]
Die Lösung des Fertigarzneimittels ist klar, viskos und farblos bis gelb.[12]
Anwendungsgebiete
Als Monotherapie wird Fulvestrant angewendet bei Mammakarzinom (Brustkrebs) bei postmenopausalen Patientinnen mit Estrogenrezeptor-positivem, lokal fortgeschrittenem oder metastasiertem Tumor ohne vorangegangene antiestrogene Therapie sowie bei Rezidiv nach oder während adjuvanter Antiestrogen-Therapie oder bei Progress (Fortschreiten) unter der Behandlung mit einem anderen Antiestrogen.[5]
In Kombination mit Palbociclib ist Fulvestrant zudem zugelassen zur Therapie des Estrogenrezeptor-positiven und HER2-negativen, lokal fortgeschrittenen oder metastasierten Mammakarzinoms nach vorangegangener antiestrogenen Therapie.[12]
Bei der Anwendung vor oder während der Menopause kommt die Kombinationstherapie mit Palbociclip zum Einsatz, wobei zusätzlich ein LHRH-Agonist wie Goserelin gegeben wird.[12]
Art der Anwendung
Fulvestrant wird entsprechend der Dosierungsangaben der Arzneimittelfachinformation des jeweiligen Präparates als intramuskuläre Injektion am Gesäß verabreicht. Anwendungen (Erhaltungsdosis) erfolgen in einem Intervall von vier Wochen.[12]
Pharmakokinetik
Die Bioverfügbarkeit von Fulvestrant liegt nach intramuskulärer Applikation bei etwa 90 %, peroral erfolgt nur eine sehr geringfügige Resorption.[12] Die Freisetzung aus dem Muskelgewebe erfolgt nach der Injektion nur langsam.[5][12] Maximale Plasmaspiegel (tmax) liegen nach etwa 5 Tagen,[12] anderen Angaben zufolge nach 7 bis 9 Tagen,[13] vor. Expositionslevel annähernd in Höhe des Steady State werden innerhalb eines Monats erreicht. Die Plasmaproteinbindung beträgt circa 99 %, Bindungspartner sind insbesondere VLDL, LDL und HDL. Die Verstoffwechslung erfolgt vor allem in der Leber. Dabei spielen Oxidation, aromatische Hydroxylierung und Konjugation mit Glukuronsäure oder Sulfatierung eine Rolle. CYP3A4 ist das einzige P450-Enzym, das an der Oxidation beteiligt ist. Der Metabolismus von Fulvestrant erfolgt jedoch vorwiegend über P450-unabhängige Stoffwechselwege. Die terminale Plasmahalbwertszeit liegt bei circa 50 Tagen. Die Elimination erfolgt in Form der Metaboliten (Stoffwechselprodukte) über Galle und Fäzes, renal werden weniger als 1 % der Metaboliten ausgeschieden.[12]
Im Tierversuch (Ratte, Kaninchen) war Fulvestrant nach intramuskulärer Verabreichung plazentagängig. Bei laktierenden Ratten ging die Substanz zudem in die Muttermilch über.[14]
Wirkmechanismus
Fulvestrant wirkt als reiner Estrogenrezeptor-Antagonist (kompetitiver Antagonismus) ohne partiell-agonistische Wirkung und mit einer dem Estradiol ähnlichen Affinität zum Estrogenrezeptor. Durch beide Eigenschaften (reiner Antagonist, höhere Affinität) grenzt sich Fulvestrant von Tamoxifen ab. Eine lange Seitenkette des Fulvestrant-Moleküls unterbindet Konformitätsänderung des Rezeptormoleküls, wodurch Transkriptionsfaktoren (Transkriptions-Aktivierungsfaktoren AF1 und AF2) nicht mehr aktiviert werden können. Weiterhin wird die Dimerisierung des Rezeptors blockiert und somit eine vollständige Inaktivierung des Rezeptors erreicht. Zudem erfolgt ein beschleunigter Abbau des Komplexes aus Fulvestrant und Rezeptor, dadurch kommt es zur Rezeptor-Downregulation, die Anzahl und Dichte an Rezeptoren nimmt also ab.[5][10]
Es sind keine Kreuzresistenzen zu anderen Antiestrogenen oder Aromatasehemmern bekannt.[10]
Wechselwirkungen
Fulvestrant beeinflusst das Ergebnis von Untersuchungen, die mit Hilfe des radioaktiven Diagnostikums Fluoroestradiol F-18 durchgeführt werden (PET-Scans). Eine entsprechende Untersuchung sollte vor dem Beginn der Behandlung mit Fulvestrant erfolgen.[15] Weiterhin kann Fulvestrant Immunoassays von Estrogenen stören, indem es mit den dort verwendeten Antikörpern kreuzreagiert. Das Ergebnis sind erhöhte Estradiolmesswerte oder Fehlinterpretationen des Menopausenstatus. Eine alternative Messmethode wäre eine HPLC-MS.[12] Die Kombination von Fulvestrant und Agomelatin kann mit einer erhöhten Lebertoxizität einhergehen.[12]
Wechselwirkungen mit CYP3A4-Hemmern oder -Induktoren sind nicht zu erwarten; Rifampicin (Induktor von CYP3A4) und Ketoconazol (Inhibitor von CYP3A4) führen klinisch nicht zu relevanten Veränderungen der Clearance von Fulvestrant. Fulvestrant hemmt seinerseits CYP3A4 nicht, wie klinische Untersuchungen mit Midazolam nahelegen.[12]
Nebenwirkungen
Als häufigere Nebenwirkungen können beispielsweise Hitzewallungen, Störungen des Magen-Darm-Trakts (Übelkeit, Erbrechen, Durchfall), Schwindel, Dyspnoe, Appetitlosigkeit, Erhöhung der Leberenzymwerte, Harnwegsinfekte, Hautausschlag, Knochenschmerzen, Arthritis, Schwächegefühl, Müdigkeit oder Fieber auftreten.[12] Auf Anzeichen thromboembolischer Ereignisse, etwa tiefe Venenthrombosen, muss geachtet werden.[10]
Gegenanzeigen
Fulvestrant soll nicht angewendet werden, wenn schwere Leberfunktionsstörungen,[5] eine Schwangerschaft oder Überempfindlichkeit gegenüber einen der Bestandteile des Arzneimittels vorliegen. Es darf während der Behandlung mit Fulvestrant nicht gestillt werden. Bei eingeschränkter Nierenfunktion mit einer Kreatinin-Clearance unterhalb von 30 ml / min soll Fulvestrant mit Vorsicht angewandt werden.[12]
Studiendaten
In den Zulassungsstudien wurden Fulvestrant (250 mg i. m. monatlich) und Anastrozol verglichen. Die Wirksamkeit der Substanzen und das Nebenwirkungsprofil waren ähnlich, nach 27 Monaten war die durchschnittliche Überlebenszeit gleich. Fulvestrant erwies sich gegenüber Anastrozol als leicht überlegen mit Blick auf das Auftreten einer kompletten und partiellen Remission (19,2 % gegenüber 16,5 %) sowie kompletter plus partieller Remission und Stabilisierung der Krankheit über mindestens 24 Monate (43,7 % gegenüber 41,1 %). Die Ansprechdauer unter Fulvestrant lag durchschnittlich bei 16,7 Monaten und unter Anastrozol bei 13,7 Monaten.[10]
In Studien kommt es unter Fulvestrant im Vergleich mit Anastrozol häufiger zu Therapieabbrüchen aufgrund von Nebenwirkungen (Fulvestrant: 2,8 %; Anastrozol: 1,9 %).[10]
Toxikologie
Im Tierversuch erweist sich Fulvestrant als reproduktionstoxisch. Bei trächtigen Versuchstieren treten gehäuft fetale Anomalien und Todesfälle auf.[14]
Handelsnamen
Faslodex (EU, CH, USA, CA), diverse Generika. In den USA ist Faslodex seit 2002 zugelassen,[16] in der Schweiz seit 2004.[17]
Einzelnachweise
- ↑ a b c d Sigma Aldrich, Sicherheitsdatenblatt zu Fulvestrant, aufgerufen am 21. Januar 2024.
- ↑ a b c d LGC Germany, Sicherheitsdatenblatt zu Fulvestrant, aufgerufen am: 21. Januar 2024.
- ↑ Gelbe Liste online, Selektive Estrogenrezeptor Degrader, aufgerufen am: 21. Januar 2024.
- ↑ American Society of Health-System Pharmacists/ drugs.com: Monographie zu Fulvestrant, aufgerufen am: 21. Januar 2024.
- ↑ a b c d e f Mutschler et al. (2008): Mutschler Arzneimittelwirkungen; Lehrbuch der Pharmakologie und Toxikologie, Wissenschaftliche Verlagsgesellschaft, 9. Auflage.
- ↑ PubChem/ NCBI: Fulvestrant, aufgerufen am: 21. Januar 2024.
- ↑ a b c Cayman Chemicals, Sicherheitsdatenblatt zu Fulvestrant, aufgerufen am: 21. Januar 2024.
- ↑ Astra Zeneca, Sicherheitsdatenblatt zu Faslodex Solution for Injection, aufgerufen am: 21. Januar 2024.
- ↑ Monographie „Fulvestrant“, European Pharmacopoeia 11th Edition, 1st Supplement (Ph. Eur. 11.1), EDQM Council of Europe, 2022.
- ↑ a b c d e f Pharmazeutische Zeitung online, Arzneistoffprofil: Fulvestrant, Informationsstand: 17. Juni 2016; aufgerufen am: 21. Januar 2024.
- ↑ Fulvestrant nun auch als Generikum verfügbar. In: springermedizin.de. 27. Januar 2024, abgerufen am 27. Januar 2024.
- ↑ a b c d e f g h i j k l m n Arzneimittelfachinformation (Faslodex; Fulvestrant: AL, Heumann, Onkovis, Teva), Zugriff über Datenbank MMI Pharmindex Plus 2023.4
- ↑ Kommentar zur Ph. Eur. 8.6. In: F. Bracher u. a. (Hrsg.): Arzneibuch-Kommentar, 54. Lfg., WVG 2016.
- ↑ a b Europäische Kommission: Faslodex, Zusammenfassung der Merkmale des Arzneimittels, 21. Oktober 2022. Abgerufen am 27. Januar 2024.
- ↑ UpToDate/ Lexicomp – Fulvestrant, Version 39.0.
- ↑ NDA 21344, FDA, abgerufen am 27. Januar 2024.
- ↑ © Copyright Swissmedic 2019: Faslodex® Fertigspritzen mit Injektionslösung zu 250 mg/5 ml. In: swissmedic.ch. Abgerufen am 27. Januar 2024.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances


