Frühe akustisch evozierte Potentiale
Frühe akustisch evozierte Potentiale (FAEP) sind eine Untergruppe der akustisch evozierten Potentiale. Sie haben ihre elektrische Quelle in der Hörbahn zwischen Hörschnecke, dem Hörnerven bis zu verschiedenen Kerngebieten im Hirnstamm (Oberer Olivenkern (Nucleus olivaris superior), Laterale Schleife (Lemniscus lateralis), Unterer Vierhügelkern (Colliculus inferior)). Das FAEP-Signal besteht aus 7 Wellen[1], von denen meist die letzten beiden nicht erkennbar sind. Nach den Erstbeschreibern Jewett und Williston (1971) wurden die ersten fünf mit J I bis J V durchgezählt werden.[2] Heute werden u. a. im deutschen Sprachraum diese Wellen meist mit I bis V benannt. Klinisch ordnet man den Ursprung jeder Welle einem Kerngebiet im Hirnstamm zu, obwohl intraoperative Messungen diese Interpretation nicht stützen.[3]
Die FAEP bzw. deren Messung werden auch als BERA (brainstem-evoked response audiometry; deutsch: Hirnstammaudiometrie), ABR (auditory brainstem response) oder AEHP (akustisch evozierte Hirnstammpotentiale) bezeichnet.
Einsatzgebiete
FAEP haben zwei grundsätzliche Anwendungsgebiete:
- Diagnostik des Hörsystems (sogen. „audiologische“ Indikation, dann werden sie meist BERA oder ABR genannt),
- Diagnostik der Nervenbahnen (sogen. „neurologische“ Indikation, dann ist die Bezeichnung meist FAEP oder AEHP).
Die medizinischen Verwendungsgebiete überschneiden sich somit zwischen den Fachgebieten der Audiologie bzw. der Pädaudiologie einerseits und der Neurologie andererseits.
- Topodiagnostik: Durch Laufzeitvergleich gegenüber Normwerttabellen und durch intraindividuellen Seitenvergleich lassen sich Erkrankungen des Hörnerven untersuchen. Nach Hörsturz, Schwindel, Tinnitus werden routinemäßig FAEP zum Ausschluss eines Akustikusneurinoms durchgeführt, aber zunehmend durch bildgebende Verfahren (MRT) abgelöst. Auch führen degenerative oder entzündliche Erkrankungen wie z. B. eine Multiple Sklerose als Frühzeichen einer Hörnervenbeteiligung zu Veränderungen der Laufzeiten und Potentiale.
- Hörschwellenbestimmung: Besonders in der Pädaudiologie, aber generell bei unkooperativen Patienten, werden FAEP zur Bestimmung der Hörschwelle eingesetzt, da sie gerade auch in Sedierung oder Narkose ableitbar sind. Aber auch zur Verifikation der subjektiv von Patienten angegebenen Hörschwellen im Tonaudiogramm bspw. vor einer Versorgung mit einem Cochlea-Implantat. Der Reizpegel, bei dem das Potential J V nicht mehr nachweisbar ist, entspricht der Hörschwelle. Durch Reizfilterverfahren (früher meist notched noise-Verfahren, seit neuerer Zeit eher Toneburst-, Tonepip- oder Chirp-Reize) können auch frequenzspezifische Messungen vorgenommen werden.
- Neugeborenenhörscreening: Eine automatisierte Ableitung der FAEP (sogenannte Automated Auditory Brainstem Response, AABR-Messung[4]) wird durch einen Auswertealgorithmus der Geräte ermöglicht. Bei Erkennung von korrekten Potentialen beim definierten Reizpegel wird als Ergebnis ein „pass“ angezeigt, sonst bei Störung oder fehlenden Potentialen ein „refer“. Bei Kombigeräten kann im Anschluss an die AABR sofort in den Diagnostikmodus gewechselt werden.
- Neuromonitoring: vor allem in der Neurochirurgie.
Stimulation
Standardmäßig wird mit einem Clickreiz (auch tone-burst) über Kopfhörer mit Kapsel gearbeitet. Einsteckhörer mit Schlauch oder Lautsprecher werden seltener benutzt, weil durch die längere Laufzeit des Stimulus bis zum Trommelfell die Synchronisation im Hörnerven schlechter werden kann. Eine frequenzspezifische Hörschwellenbestimmung kann über eine Notched-Noise-Stimulation (Kerbrauschen, der Stimulus wird durch ein Rauschen mit Aussparung der Zielfrequenz überdeckt),[5] oder mit Chirps erreicht werden. Übliche Messfrequenzen sind 500 Hz, 1000 Hz, 2000 Hz und 4000 Hz.
Ableitung / Elektrodenposition
Das aktive Hirnareal, die „Quelle“, sollte möglichst zwischen den Ableitungselektroden (1) und (2) liegen: (1) Haarwirbel auf dem Kopf (Cz im 10-20-System; „Vertex“); (2) hinter dem Ohr („Mastoid“). Eine dritte Elektrode (3) wird als Referenz genutzt („Masse“), meist Stirn oder Nacken.
Auswertung

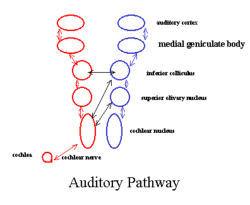
Die Hörbahn generiert die folgenden Antworten:[6]
- Welle I – den peripheren Anteil des Hirnnerven VIII
- Welle II – der zentrale Anteil des Nervus vestibulocochlearis
- Welle III – Nucleus cochlearis
- Welle IV – der Kernkomplex des Nucleus olivaris superior bzw. des Lemniscus lateralis
- Welle V – Lemniscus lateralis bzw. Colliculi inferiores

Die Form der fünf FAEP-Wellen (J I bis J V) hängt von der Lautstärke des Reizes ab (Stimulations-Pegel). Als Latenz bezeichnet man die Zeit zwischen Stimulusanfang („onset“) und Wellenmaximum, als Amplitude die Differenz zwischen Maximum und nachfolgendem Minimum.
Für die audiologische BERA werden Absolut-Latenzen gemessen (Stimulus bis Wellen-Maximum, bezeichnet mit LV, LIII oder LI), und über dem Stimulationspegel aufgetragen (Pegel-Latenz-Diagramm, PLD). Aus dem Vergleich des individuellen PLD mit Normkurven kann man auf die Hörschwelle – und im Fall einer Schwerhörigkeit – auf den Ort der Schwerhörigkeit schließen.
Für die neurologischen FAEP vergleicht man bei festem Pegel die Messkurven von rechtem und linkem Ohr. Sollten dabei Seitendifferenzen oder Formveränderungen der Wellen auffallen, misst man Relativ-Latenzen (z. B. LV LI, sog. „Hirnstammlaufzeit“).
Nur wenn die Messparameter identisch sind, lassen sich Messergebnisse aus verschiedenen Labors miteinander vergleichen.
Technische Details der Messapparatur
Die Unterschiede der einzelnen technischen Parameter der Messapparaturen für die beiden Einsatzgebiete zeigt die Tabelle:
| FAEP | BERA | |
|---|---|---|
| Filtertyp | Butterworth | Bessel |
| Filtergrenzen | 150 / 1500 Hz | 30 / 3000 Hz |
| Interstimulusintervall (ISI) | 100 ms | 20–50 ms |
| Min. Anzahl Mittelungen | 1000 | 2000–4000 |
| Reizgeber | Kopfhörer, Einsteckhörer | Kopfhörer, Einsteckhörer, Knochenleitungshörer |
| Reizform | Click (nicht standardisiert) | Click n. IEC 645-3, Toneburst, Tonepip oder Chirp |
| Reizpegel | 70 – 90 dB HL bzw. 105 dB HL | 10–100 dB HL |
| Elektroden | Oberflächen- oder Nadelelektroden (intraop.) Vertex-Mastoid | Oberflächen- oder Nadelelektroden (intraop.) Vertex-Mastoid |
| Elektrodenimpedanz | 5 kΩ | 3 kΩ |
ASSR
ASSR steht für Auditory steady-state responses (übersetzt: Dauerantworten auf Hörreize).
Akustisch evozierte Hirnstammpotentiale sind normalerweise transiente („flüchtige“) Potentiale einer Hirnstammantwort auf einen Ton- oder Klickreiz mit einer Latenz von 1–20 ms nach dem Stimulus. ASSR werden durch Klicks, bevorzugt aber durch amplituden- (AM) und frequenzmodulierte (FM) Stimuli (meist Chirps) ausgelöst, die mit einer solch hohen Wiederholrate angeboten werden, so dass sich die transienten Antworten im Hirnstamm überlappen und so eine scheinbare Dauerantwort entsteht. Durch statistische Messungen werden die ASSR aus dem Signal-Rausch-Verhältnis (SNR, signal-to-noise ratio) errechnet. Üblicherweise wird die Amplitude der Reizantwort mit dem Hintergrundrauschen des EEGs oder dessen Phasenvariabilität verglichen. Eine Möglichkeit, die ASSR zu „messen“ ist es, eine Anzahl von Antworten oder eine gemittelte Antwort einer FFT zu unterwerfen, um Amplituden und Phase untersuchen zu können. Die ASSR-Komponente wird dabei bei den Spektrallinien erwartet, die der Reizrate oder Vielfachen davon entsprechen. Wenn die Amplitude der ASSR eine signifikante SNR aufweist, wird die Antwort als „vorhanden“ gewertet. Dabei wird nicht erkannt, welche Abschnitte der Hörbahn zur Antwort beigetragen haben. Im Gegensatz zu den klassischen FAEP ist bei der Beurteilung der ASSR keine visuelle, subjektive Kurvenbeurteilung durch den Untersucher erforderlich. Bei Reizdarbietung von Chirps unterschiedlicher Frequenz mit gering unterschiedlicher Dauer der Wiederholrate können zeitgleich beide Ohren mit mehreren Frequenzen simultan gemessen werden, was gegenüber der herkömmlichen frequenzspezifischen FAEP-Ableitung einen deutlichen Zeitvorteil bedeutet. Mittels gerätespezifischer Normwertkurven kann aus den ASSR ein frequenzspezifisches Audiogramm „errechnet“ werden.
Literatur
- Helmut Buchner: Praxisbuch Evozierte Potenziale: Grundlagen, Befundung, Beurteilung und differenzialdiagnostische Abgrenzung. Thieme, 2014, ISBN 978-3-13-175941-2.
- James W. Hall: New Handbook of Auditory Evoked Potentials. Pearson, Boston, Mass. 2006, ISBN 0-205-36104-8.
- Konrad Maurer, Nicolas Lang, Joachim Eckert: Praxis der evozierten Potentiale. Steinkopff-Verlag, 2005, ISBN 3-7985-1500-X.
Weblinks
- Henning Joachim Stegmann: BERA-Screeningverfahren im Einsatz bei Hochrisikokindern. (PDF; 2,1 MB). Inaugural-Dissertation. Fachbereich Medizin der Philipps-Universität Marburg, 2009.
Siehe auch
Einzelnachweise
- ↑ NIHON KOHDEN: NeuroNavi: AEP: ABR. Ausgabe 1, 2003.
- ↑ D. L. Jewett, J. S. Williston: Auditory far fields averaged from the scalp of humans. In: Brain. 94, 1971, S. 681–696.
- ↑ A. R. Møller: Evoked potentials in intraoperative monitoring. Williams & Wilkins, Baltimore 1988, ISBN 0-683-06115-1.
- ↑ J. I. Benito-Orejas, B. Ramírez, D. Morais, A. Almaraz, J. L. Fernández-Calvo: Comparison of two-step transient evoked otoacoustic emissions (TEOAE) and automated auditory brainstem response (AABR) for universal newborn hearing screening programs. In: Int J Pediatr Otorhinolaryngol. 72(8), Aug 2008, S. 1193–1201.
- ↑ E. Stürzebecher u. a.: Frequenzspezifische Hörschwellenmessung mittels «Notched-noise»-BERA bei Kindern. In: ORL Nova. Nr. 5, 1995, S. 300–306, doi:10.1159/000313227 (karger.com [PDF; abgerufen am 8. Oktober 2018]).
- ↑ James W. Hall: New handbook of auditory evoked responses. Pearson, Boston 2007, ISBN 978-0-205-36104-5.
Auf dieser Seite verwendete Medien
I created this image using Microsoft PowerPoint