Fmoc-Schutzgruppe

Fluorenylmethoxycarbonyl (Fmoc) ist eine Schutzgruppe, die zum Schützen von Aminen verwendet wird. Ein Einsatzgebiet ist die Synthese von Peptiden. Mit dieser Schutzgruppe ist es möglich, die nächste Aminosäure im Kettenwachstum in Richtung des N-terminalen Endes des Peptids zu schützen. Die Kombination aus N-Fmoc und tert-Butylestern bzw. seinen chemisch verwandten polymergebundenen Analoga ist eine ideale orthogonale Schutzgruppen-Kombination und findet breite Anwendung in der Festphasen-Peptid-Synthese.
Bedeutung
Die Fluorenylmethoxycarbonyl-Gruppe bildet ein zentrales Element in der Strategie der Festphasen-Peptidsynthese.[1] Idealerweise sollten sich in einer automatisierbaren Synthese, wie der genannten, alle nötigen Schutzgruppen getrennt und ungestört voneinander entfernen lassen können. Dieses Konzept nennt man Orthogonalität der Schutzgruppen.
In der Peptidsynthese hat man es in der Regel mit drei Typen von Schutzgruppen zu tun: Zunächst die Schutzgruppe in der Richtung des zukünftigen N-terminalen Endes, beispielsweise Fmoc. Des Weiteren eine Schutzgruppe für das C-terminale Ende; diese wird in der Festphasen-Peptid-Synthese durch ein Harz gebildet, an welchem die erste Aminosäure gebunden ist. Ein verfrühtes Ablösen des wachsenden Peptides würde die Ausbeuten erheblich senken. Der dritte Typ sind die Schutzgruppen für die eventuell vorhandenen störenden funktionellen Gruppen in den Aminosäuren, die in das Peptid eingebaut werden sollen.
Hier stellt Fmoc durch seine außergewöhnliche Eigenschaft, im Sauren stabil, dagegen jedoch im Basischen labil zu sein, eine Ausnahme unter den Schutzgruppen dar. Der Großteil der weiteren Schutzgruppen wird unter sauren Bedingungen abgespalten.
In der Festphasen-Peptid-Synthese werden Peptide an Harzen nach Merrifield und Weiterentwicklungen dieser Technik automatisiert mit Hilfe von Syntheserobotern hergestellt. Die dabei angewandten Standardprotokolle ermöglichen Peptidkupplung in Ausbeuten von über 99,99 %, was nötig ist, um Peptide im 10-kDa-Bereich synthetisieren und später aufreinigen zu können. Allerdings verliert durch die Fortschritte anderer Methoden der Peptidsynthese, speziell gentechnischer Methoden, die Merrifield-Synthese stark an Bedeutung und ist nur noch für Sonderfälle wie den Einbau von nichtkanonischen Aminosäuren von Interesse.
Entschützen
Die Schutzgruppe kann unter schwach basischen Bedingungen wieder entfernt werden, ist jedoch unter sauren Bedingungen stabil.[1] Daher kann sie gut in Verbindung mit der sogenannten Boc-Schutzgruppe (tert-Butyloxycarbonyl) und der in diesem Zusammenhang gebräuchlichen Schutzgruppe für Carbonsäuren, dem tert-Butylester, eingesetzt werden und ist komplementär dazu, weil die Boc- und auch die tert-Butylester-Gruppe sauer (normalerweise mit konzentrierter Trifluoressigsäure) entfernt wird. Beim Entschützen von Fmoc wird das saure Wasserstoff-Atom mit Hilfe einer Base (meist ein sekundäres Amin) entfernt. In einem E1cb genannten Mechanismus kollabiert das Schutzgruppensystem zu einem quasi-aromatischen System und dem freien Amin (z. B. Ester eines Peptides), wie im Reaktionsmechanismus gezeigt:
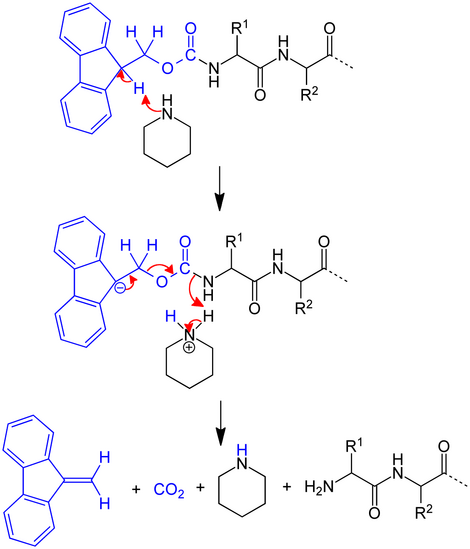
Das Proton in der 9-Position des Fluorenyl-Ringes (pKa = 22,6 in Dimethylsulfoxid) kann unter verhältnismäßig milden Bedingungen entfernt werden. Dadurch ist es möglich, dass die Entschützung mit 20 % Piperidin, einer relativ schwachen Base, in Dimethylformamid (DMF) innerhalb weniger Minuten (30 min) erfolgen kann. Aufgrund von charakteristischen UV-Absorptionen bei 295 nm (ε=7800) kann man den korrekten Verlauf der Entschützung verfolgen und dadurch bei Peptidsynthesen mittels eines Synthesizers problematische Peptidkupplungen anhand der langsamen oder schlechten Abspaltung der Schutzgruppe erkennen.
Schutz der Aminofunktion
Normalerweise erfolgt der Schutz der Aminofunktion, bei Abwesenheit von anderen störenden Gruppen seitens der Aminosäure, durch die Umsetzung mit Fluorenylmethoxycarbonylchlorid (Fmoc-Cl) oder N-(9-Fluorenylmethoxycarbonyloxy)-succinimid (Fmoc-OSu) in Gegenwart einer wässrigen Natriumhydrogencarbonatlösung mit der entsprechenden Aminosäure. Die Fmoc-Derivate aller gängigen Aminosäuren sind kommerziell erhältlich.[2]
Literatur
W. Chan (Autor), W. C. Chan (Herausgeber), Peter D. White. In: Fmoc Solid Phase Peptide Synthesis: A Practical Approach (Taschenbuch), Oxford University Press Oxford New York 2000, ISBN 0-19-963724-5.
Einzelnachweise
- ↑ a b Louis A. Carpino: The 9-Fluorenylmethoxycarbonyl Family of Base-Sensitive Amino-Protecting Groups. In: Accounts of Chemical Research 20 (1987) S. 401–407.
- ↑ Paul B. W. ten Kortenaar, Benno G. van Dijk, Marjolijn Peeters, Bert J. Raaben, P. J. Hans M. Adams und Godefridus I. Tesser: Rapid and efficient method for the preparation of Fmoc-amino acods starting from 9-fluorenylmethanol. In: Int. J. Peptide Protein Res. Band 27, 1986, S. 398–400. (doi.org/10.1111/j.1399-3011.1986.tb01034.x)
- Commons: Fmoc – Sammlung von Bildern, Videos und Audiodateien
Auf dieser Seite verwendete Medien
Fmoc_Schutzgruppe_Allgemeine_Formel

