5-Fluoruracil
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
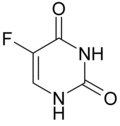 | ||||||||||||||||||||||
| Strukturformel des Dioxo-Tautomers | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | 5-Fluorouracil | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H3FN2O2 | |||||||||||||||||||||
| Kurzbeschreibung | weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | L01BC02 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 130,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | löslich in Wasser (11,1 g·l−1 bei 22 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
5-Fluoruracil (5-FU), auch Fluorouracil (INN), ist eine heterocyclische organische Verbindung mit einem Pyrimidingrundgerüst und zwei Carbonylgruppen an den Positionen 2 und 4 sowie einem Fluor an Position 5. Es ist ein Derivat der Nukleinbase Uracil.
Es ist ein Arzneistoff, welcher als Zytostatikum in der Chemotherapie, vor allem beim kolorektalen Karzinom und bei Brustkrebs verwendet wird. Es wurde von dem amerikanischen Chemiker Charles Heidelberger entwickelt und 1962 von der Pharmafirma Hoffmann-La Roche auf den Markt gebracht. Ausschlaggebend für die Synthese von 5-FU waren Heidelbergers Überlegungen zum tumorhemmenden Potential von Fluoracetat, dem Salz der Fluoressigsäure.[4] Später beschrieb Heidelberger die Metabolisierung von 5-FU unter Bezugnahme auf das vom britischen Biochemiker und Kampfstoffforscher Sir Rudolph Peters entwickelte Prinzip der letalen Synthese (Biotransformation von Fluoracetat zu Fluorcitrat).[5]
In geringer Dosierung und in Wirkstoffkombination mit Salicylsäure wird 5-Fluoruracil auch zur äußeren Anwendung als Warzen-Therapeutikum unter Handelsnamen wie Verrumal® eingesetzt.
Des Weiteren kommt es auch umgewidmet in der Veterinärmedizin zur Behandlung des equines Sarkoids beim Pferd zum Einsatz.[6]
Eigenschaften
5-Fluoruracil ist ein Feststoff, der bei 282–286 °C unter Zersetzung schmilzt.[1]
Von 5-Fluoruracil gibt es sechs mögliche tautomere Formen im festen Zustand, wobei die Dioxo-Form (1) bevorzugt ist.
Pharmakologische Eigenschaften
Wirkung
5-Fluoruracil ist ein Antimetabolit, der bei der Zellteilung aufgrund der Strukturähnlichkeit mit den Pyrimidinbasen Cytosin und Thymin (DNA-Nukleotide) beziehungsweise Uracil (RNA-Nukleotid) anstatt dieser in die DNA und RNA eingebaut wird. So wandelt das Enzym UMP-Pyrophosphorylase (EC 2.4.2.9) 5-Fluoruracil in 5-Fluor-UMP um, das dann weiter zu 5-Fluor-UTP phosphoryliert und in die RNA eingebaut wird. Dieses bewirkt die Synthese fehlerhafter RNA, wodurch die Protein-Biosynthese gehemmt wird.
5-Fluor-dUMP hemmt darüber hinaus auch die Thymidylat-Synthase (EC 2.1.1.45), was letztendlich dazu führt, dass die DNA-Synthese und die Zellteilung inhibiert werden.[7]

katalysiert, dabei wird N5,N10-Methylentetrahydrofolat (2) zu 7,8-Dihydrofolat (3) umgesetzt.
5-Fluor-dUMP inhibiert das Enzym und damit diese Reaktion.
Es wirkt insbesondere in der Interphase des Zellzyklus. Neben einer Hemmung der DNA- und RNA-Synthese inhibiert es auch den sogenannten Exosomkomplex, der für die Zelle lebensnotwendig ist.
5-Fluoruracil wird intravenös oder in Form der Prodrugs Capecitabin oder Tegafur verabreicht; letztere werden erst in der Zelle zum aktiven 5-Fluoruracil umgewandelt. 5-Fluorcytosin ist ebenfalls ein Prodrug von 5-Fluoruracil, das als systemisches Antimykotikum verwendet wird. Es wird durch eine Cytosin-Permease in die Zelle aufgenommen und dort sofort durch eine nur in Pilzen vorhandene Cytosin-Desaminase zu 5-Fluoruracil desaminiert.[8]
Wirkung abhängig von Genetik
Einer Studie zufolge ist die Wirksamkeit abhängig von der Genetik des Patienten. Der Einzelnukleotid-Polymorphismus rs2612091 bestimmt danach bei lokal fortgeschrittenem Magenkrebs wesentlich das Überleben. Die Variante A/A ist dabei mit einer guten Wirksamkeit, die Varianten A/G und G/G sind mit deutlich geringerer Wirksamkeit verbunden[9]. Es ist denkbar, dass das auch auf andere Krebserkrankungen übertragbar ist. Eine genetische Testung z. B. in Form von Genotypisierung ist derzeit nicht Standard bei der Behandlung.
Nebenwirkungen
Die Nebenwirkungen (Übelkeit, Erbrechen, Schleimhautentzündungen, Knochenmarkschädigung) können beträchtlich sein (siehe Abschnitt Nebenwirkungen im Artikel Zytostatikum).
Als langfristige Nebenwirkungen wurden bei Tierexperimenten und Patientenuntersuchungen Gehirnschäden durch Schädigung von Gliazellen ausgemacht.[10] Neuro- und kardiotoxische Nebenwirkungen werden auf den 5-FU-Metaboliten Fluoracetat zurückgeführt.[11][12][13][14][15]
Durch die zusätzliche Gabe von Tetrahydrofolsäure bzw. Folinsäure ist eine höhere Dosierung von 5-FU möglich, man nutzt diesen Effekt für Kombinationstherapien. Eine Wirkungsverstärkung bewirkt auch Interferon-α.
Der Abbau von 5-Fluoruracil geschieht über das Enzym Dihydropyrimidin-Dehydrogenase (DPD).[16] Bei Patienten, die von der seltenen angeborenen Stoffwechselerkrankung Dihydropyrimidin-Dehydrogenase-Mangel betroffen sind, kann die Behandlung mit 5-Fluorouracil zu schwersten Intoxikationen führen.[17] Betroffene Personen sind häufig asymptomatisch. Die Ausschlussdiagnostik erfolgt durch die Analyse der Purine & Pyrimidine und den konkreten Untersuchungsauftrag „Ausschluss DPD bei geplanter 5-Fluorouracil-Therapie“ aus Urin.
Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) der Europäischen Arzneimittelagentur EMA empfiehlt, dass Patienten auf das Fehlen bzw. den partiellen Mangel von DPD getestet werden sollten, bevor sie eine Krebsbehandlung mit fluorouracilhaltigen Arzneimitteln beginnen, die durch Injektion oder Infusion (Tropf) verabreicht werden. Diese Empfehlung gilt entsprechend für die Behandlung mit den verwandten Wirkstoffen Capecitabin und Tegafur, die im Körper in Fluorouracil umgewandelt werden (Prodrug).[18]
Siehe auch
- FOLFOX Therapieschema
- FOLFIRI Therapieschema
Handelsnamen
Benda-5 FU (D), Efudix (D, CH), Haemato-fu (D), Neofluor (D), Onkofluor (D), Ribofluor (D), diverse Generika (D, A, CH)
Verrumal (D, A, CH)
Einzelnachweise
- ↑ a b c Datenblatt 5-Fluorouracil bei Sigma-Aldrich, abgerufen am 2. Dezember 2013 (PDF).
- ↑ a b c Eintrag zu Fluorouracil in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Eintrag zu 5-Fluoruracil in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ Charles Heidelberger: Fluorinated Pyrimidines and Their Nucleosides. In: Antineoplastic and Immunosuppressive Agents (= Handbuch der experimentellen Pharmakologie / Handbook of Experimental Pharmacology). Springer, Berlin, Heidelberg 1975, ISBN 3-642-65808-3, S. 193–231, doi:10.1007/978-3-642-65806-8_12.
- ↑ Katherine Elliott, Joan Birch (Hrsg.): Carbon-Fluorine Compounds. Chemistry, Biochemistry and Biological Activities. Associated Scientific Publishers, Amsterdam 1972, ISBN 0-470-71985-0, S. 130.
- ↑ Johanna Dorothea Loschelder-Ostrowski: Therapie Equiner Sarkoide durch Immuntherapie mit Interleukin 2 - Inaugural-Dissertation zur Erlangung des Grades eines Doktors der Veterinärmedizin an der Freien Universität Berlin. In: FU-Berlin. Gedruckt mit Genehmigung des Fachbereichs Veterinärmedizin der Freien Universität Berlin, 23. Juni 2021, abgerufen am 2. Dezember 2024 (deutsch).
- ↑ Joachim Morschhäuser: Resistenzen und Resistenzmechanismen: Wie entkommen Pilze der Therapie? in: Pharmazie in unserer Zeit, 2003, 32 (2), S. 124–129 (doi:10.1002/pauz.200390029).
- ↑ F. von Bruchhausen: Hagers Handbuch der Pharmazeutischen Praxis: Drogen A-K, 5. Auflage, Springer Verlag, Berlin 1998, ISBN 3-540-61618-7, S. 226.
- ↑ D. Meulendijks, E. A. Rozeman, A. Cats, K. Sikorska, M. Joerger: Pharmacogenetic variants associated with outcome in patients with advanced gastric cancer treated with fluoropyrimidine and platinum-based triplet combinations: a pooled analysis of three prospective studies. In: The Pharmacogenomics Journal. Band 17, Nr. 5, Oktober 2017, S. 441–451, doi:10.1038/tpj.2016.81.
- ↑ Ruolan Han, Yin M Yang, Joerg Dietrich, Anne Luebke, Margot Mayer-Pröschel, Mark Noble: Systemic 5-fluorouracil treatment causes a syndrome of delayed myelin destruction in the central nervous system. In: Journal of Biology. 7, 2008, S. 12, doi:10.1186/jbiol69.
- ↑ Harold Koenig: Biochemical Basis for Fluorouracil Neurotoxicity. In: Archives of Neurology. Band 23, Nr. 2, 1. August 1970, S. 155, doi:10.1001/archneur.1970.00480260061008 (jamanetwork.com [abgerufen am 30. April 2018]).
- ↑ H. Koenig, A. Patel: The acute cerebellar syndrome in 5-fluorouracil chemotherapy: a manifestation of fluoroacetate intoxication. In: Neurology. Band 20, Nr. 4, April 1970, S. 416, PMID 5535078.
- ↑ Kazumasa Yamashita, Hideaki Yada, Toshihiko Ariyoshi: Neurotoxic effects of alpha-fluoro-beta-alanine (FBAL) and fluoroacetic acid (FA) on dogs. In: The Journal of Toxicological Sciences. Band 29, Nr. 2, Mai 2004, S. 155–166, PMID 15206584.
- ↑ M. Arellano, M. Malet-Martino, R. Martino, T. Spector: 5-Ethynyluracil (GW776): effects on the formation of the toxic catabolites of 5-fluorouracil, fluoroacetate and fluorohydroxypropionic acid in the isolated perfused rat liver model. In: British Journal of Cancer. Band 76, Nr. 9, 1997, S. 1170–1180, PMID 9365165, PMC 2228116 (freier Volltext).
- ↑ M. Arellano, M. Malet-Martino, R. Martino, P. Gires: The anti-cancer drug 5-fluorouracil is metabolized by the isolated perfused rat liver and in rats into highly toxic fluoroacetate. In: British Journal of Cancer. Band 77, Nr. 1, 1998, S. 79–86, PMID 9459149, PMC 2151255 (freier Volltext).
- ↑ S. Maurer, J. Thödtmann: Das Mammakarzinom: Diagnostik und Therapie. Govi-Verlag, Eschborn 2003, ISBN 978-3-7741-0996-4.
- ↑ Van Kuilenburg ABP (2004) Dihydropyrimidine dehydrogenase and the efficacy and toxicity of 5-fluorouracil. European Journal of Cancer 40: 939–950.
- ↑ Fluorouracil, Capecitabin, Tegafur und Flucytosin: Empfehlung zur Testung und Behandlung, Risikobewertungsverfahren des BfArM, Meldung vom 16. März 2020, abgerufen am 18. März 2020
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Desaminierung von 5-Fluorcytosin zu 5-Fluoruracil
Die Synthese von dTMP (1a) aus dUMP (1b) wird durch die Tyhmidylat-Synthase (A) katalysiert. Die Methylgruppe stammt aus N5,N10-Methylentetrahydrofolat (2), das zu 7,8-Dihydrofolat (3) umgesetzt wird.
Die tautomeren Strukturen des 5-Fluoruracils
chemical structure of Fluorouracil







