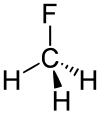
Fluormethan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Fluormethan | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | CH3F | |||||||||||||||
| Kurzbeschreibung | leicht entzündliches farbloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 34,03 g·mol−1 | |||||||||||||||
| Aggregatzustand | gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | −78,4 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | gut in Wasser (2,3 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Dipolmoment | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential | 141 (bezogen auf 100 Jahre)[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Fluormethan ist eine bei Raumtemperatur gasförmige, leicht entzündliche chemische Verbindung aus der Gruppe der Fluorkohlenwasserstoffe.
Eigenschaften
Das Fluormethanmolekül ist aufgrund der hohen Elektronegativität des Fluor stark polar, was zu einer Löslichkeit von 2,3 g·l−1 Wasser (bei 20 °C) führt.[2] Fluormethan hat eine kritische Temperatur von 44,55 °C, der kritische Druck liegt bei 58,742 bar und die kritische Dichte bei 0,30 kg/l. Die Tripelpunkt-Temperatur liegt bei −137,8 °C, was der Schmelztemperatur entspricht. Seine spezifische Wärmekapazität bei 25 °C beträgt Cp = 38,171 Jmol−1K−1.[1] Die Verbindung hat ein Treibhauspotenzial von 141.
Verwendung
Fluormethan wird in der Produktion von Halbleitern als Ätzgas und beim Plasmaätzen verwendet.[2] Es wurde auch als Kältemittel eingesetzt.
Sicherheitshinweise
Fluormethan bildet mit Luft ein explosionsfähiges Gemisch. Durch den fehlenden Geruch ist eine Belastung in der Luft nicht wahrnehmbar. Toxische Auswirkungen auf Organismen sind nicht bekannt.[5] Bei der Verbrennung kann hochgiftiger Fluorwasserstoff entstehen. Wie bei anderen Fluor- und Fluorchlorkohlenwasserstoffen wird eine narkotische Wirkung vermutet.[1]
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu Fluormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Februar 2017. (JavaScript erforderlich)
- ↑ a b c Produktdatenblatt Fluormethan bei AirLiquide, abgerufen am 9. Februar 2017.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (englisch, ipcc.ch [PDF]).
- ↑ Sicherheitsdatenblatt Fluormethan (PDF; 38 kB). Air Liquide, abgerufen am 15. Juli 2017.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure
Fluormethan; Methylfluorid




