Fibrinstabilisierender Faktor
| Fibrinstabilisierender Faktor | ||
|---|---|---|
 | ||
| Bändermodell des Dimer der A-Kette von Faktor XIII, nach PDB 1EVU | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 2670 = 2*694+2*641 Aminosäuren | |
| Sekundär- bis Quartärstruktur | 2A+2B | |
| Kofaktor | Calcium (A) | |
| Präkursor | A: (731 Aminosäuren) | |
| Bezeichner | ||
| Gen-Namen | F13A1 ; F13B | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | B02BD07 | |
| Enzymklassifikation | ||
| EC, Kategorie | 2.3.2.13, Transferase | |
| Reaktionsart | Übertragung von Alkylresten innerhalb oder zwischen Proteinen | |
| Substrat | Xaa-Gln-Xaa + Yaa-Lys-Yaa | |
| Produkte | Xaa-Glu(Xaa)-Lys(Yaa)-Yaa + NH3 | |
| Vorkommen | ||
| Homologie-Familie | Transglutaminase | |
| Übergeordnetes Taxon | Chordatiere | |
Der Fibrin-Stabilisierende Faktor (Faktor XIII oder Laki-Lorand-Faktor) ist ein Enzym und als Gerinnungsfaktor Teil der Blutgerinnung. Er besteht aus zweimal zwei Untereinheiten, je zwei A und zwei B. Seine normale Konzentration im Blutplasma beträgt 10 μg/ml, seine Halbwertszeit 5–9 Tage.
Genetik
Die zwei Untereinheiten des Faktor XIII werden von zwei verschiedenen Genen kodiert:
- Das Gen für die A-Untereinheit liegt auf dem 6. Chromosom (6p25-p24): F13A1
- Das Gen für die B-Untereinheit liegt auf dem 1. Chromosom (1q31-q32.1): F13B
Physiologie
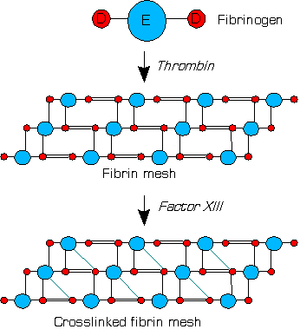
Thrombin konvertiert Fibrinogen zu Fibrin. Dieses besteht aus einer D-Einheit und zwei beidseitig an diese gebundene E-Einheiten. Fibrin formt ein Netzwerk, in dem jedes seiner E-Einheiten Verbindungen zu nur einer D-Einheit eines anderen Fibrinmoleküls hat. Faktor XIII wird ebenso von Thrombin, zusammen mit Calcium aktiviert und verknüpft die D-Einheit des Fibrin noch mit den E-Einheiten weiterer Fibrinmoleküle. Dies wird als Retraktionsphase der Blutgerinnung bezeichnet. Eine weitere wichtige Funktion von Faktor XIIIa liegt in der Fixierung der Fibrinolyseinhibitoren TAFI (Thrombin Aktivierter Fibrinolyse Inhibitor) und alpha-2-Antiplasmin im Fibringerinnsel. Dadurch wird das Gerinnsel vor vorzeitiger Fibrinolyse geschützt und damit ebenfalls Blutungen vermieden. Weiterhin bindet Faktor XIIIa verschiedene andere Substrate an Zelloberflächen, darunter Thrombospondin, Fibronectin und andere Proteine.
Erkrankungen
Erblicher Faktor-XIII-Mangel ist äußerst selten und verursacht eine starke Neigung zu Blutungen. Erworbene Mangelzustände sind dagegen nicht selten.
Literatur
- L. Muszbek, R. A. Ariëns, A. Ichinose: Factor XIII: recommended terms and abbreviations. In: J. Thromb. Haemost. 5 (1), Januar 2007, S. 181–183. doi:10.1111/j.1538-7836.2006.02182.x. PMID 16938124.
- K. Laki, L. Lóránd: On the Solubility of Fibrin Clots. In: Science. 108, 2802, September 1948, S. 280. doi:10.1126/science.108.2802.280. PMID 17842715.
Weblinks
- A-Einheit: Fibrinstabilisierender Faktor. In: Online Mendelian Inheritance in Man. (englisch)
- B-Einheit: Fibrinstabilisierender Faktor. In: Online Mendelian Inheritance in Man. (englisch)
Auf dieser Seite verwendete Medien
Autor/Urheber: 5-HT2AR, Lizenz: CC0
Inactive human blood clotting factor XIII (PDB: 1EVU), a transglutaminase. Homodimer of catalytic A1 peptides (gene F13A1) is shown. XIII in human blood is actually a heterotetramer of 2 A1 peptides and 2 B peptides (gene F13B). B peptides are not shown, but would form a ring-like structure around the A1 dimer.
N- & C-terminals are shown as "N" and "C". Protein on the left is rotated 90° about its y-axis and the result is on the right.
Domains:
- Magenta (N-terminal): activation peptide, which is removed when XIII is activated to XIIIa
- Cyan: β-sandwich
- Green: catalytic core (orange: catalytic amino acid residues C314, H373-D396 and W279 are shown)
- Blue: β-barrel 1
- Red (C-terminal): β-barrel 2
Sructure from www.rcsb.org. Source for info:
- Muszbek L et al (2011). Physiological Reviews. 91 (3): 931–972. Doi:10.1152/physrev.00016.2010
Autor/Urheber: Jfdwolff, Lizenz: CC BY-SA 3.0
Stabilisation de la fibrine par le facteur XIII.