Fexofenadin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
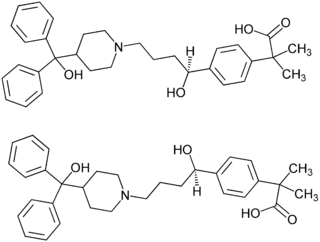 | ||||||||||||||||||||||
| (S)-Enantiomer (oben) und (R)-Enantiomer (unten) 1:1-Enantiomerengemisch (Racemat) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Fexofenadin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C32H39NO4 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | R06AX26 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 501,66 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Fexofenadin ist ein Arzneistoff und wird als Antihistaminikum der dritten Generation bei Heuschnupfen und ähnlichen allergischen Symptomen angewendet. Fexofenadin reduziert solche allergischen Erscheinungen durch eine Verdrängung des Histamins vom Histamin-H1-Rezeptor.[3]
Klinische Wirkungen
Zugelassene Anwendungsgebiete
Fexofenadin ist zur Linderung der Beschwerden bei Heuschnupfen (saisonale allergische Rhinitis) sowie bei chronischer idiopathischer Nesselsucht zugelassen, allerdings nicht in den unterschiedlichen Wirkstärken, die auf dem Markt verfügbar sind, bei denen pro Wirkstärke jeweils nur eine Indikation zugelassen ist.
Nebenwirkungen
Mögliche Nebenwirkungen sind Kopfschmerzen, Müdigkeit, Schläfrigkeit, Schwindel, Übelkeit, Magen-Darm-Störungen, Menstruationsbeschwerden, Rachenentzündung, Brechreiz, Erbrechen, Gewichtszunahme.
Wie bei anderen H1-Antihistaminika der zweiten oder dritten Generation überwindet nur ein kleiner Teil des Arzneistoffs die Blut-Hirn-Schranke. Fexofenadin kann als hydrophobe Substanz die Blut-Hirn-Schranke überwinden, wird jedoch über das Multidrug-Resistance-Protein 1 wieder zurück in das Blut befördert, daher hat Fexofenadin eine vergleichsweise geringe sedierende Wirkung.
Wechselwirkungen mit anderen Substanzen
In kontrollierten klinischen Studien wurden bisher keine Wechselwirkungen mit anderen Arzneimitteln beobachtet, die die Sicherheit oder Wirksamkeit von Fexofenadin signifikant beeinflussen. Grapefruit-Saft reduziert die Wirksamkeit.[4]
Überdosierung
Berichte von Überdosierungen sind selten und daher sind die Symptome einer Überdosierung kaum bekannt. Die LD50 bei Mäusen betrug 5000 mg/kg, was die empfohlene Dosierung für einen Erwachsenen um das 110-fache übersteigt. Untersuchungen am Menschen mit einer Dosierung von einmal 800 mg bis zu 690 mg zweimal täglich über einen Zeitraum von einem Monat zeigten keine signifikant nachteilig klinischen Effekte bei Vergleich mit einem Placebo.
Chemie
Stereochemie
Fexofenadin wird, wie viele andere Antihistaminika, als Racemat eingesetzt. Das ist insofern von Bedeutung, als seit dem Contergan-Skandal der unterschiedlichen Pharmakologie und Pharmakokinetik von Enantiomeren große Bedeutung beigemessen wird. Bei Fexofenadin weist eine Studie auf eine unterschiedliche Stereoselektivität des P-Glykotransportproteins gegenüber den (R)- und (S)-Enantiomeren hin.[5] Zur Verwendung von racemischen Arzneistoffen gibt es kritische Stimmen.[6]
Synthese
Fexofenadin kann man ausgehend von Piperidin-4-carbonsäureethylester und (4-Bromphenyl)-acetonitril synthetisieren.[7]

Um den Piperidinteil zu erhalten, werden zuerst zwei Phenylgruppen (Ph) über eine Grignard-Reaktion am Ester eingeführt. Die Aminogruppe wird dann mit dem geschützten Aldehyd 2-(4'-Brombutyl)-dioxolan (einem Acetal) alkyliert, dessen Schutzgruppe anschließend wieder mit Säure entfernt wird.
Der andere Teil des Fexofenadin-Moleküls wird durch doppelte Alkylierung des sich vom Nitril ableitenden Carbanions mit Iodmethan synthetisiert. Die Nitril-Gruppe wird nun zur Carbonsäure hydrolysiert. Das Arylbromid wird anschließend durch Lithiierung mit z. B. n-Butyllithium zur Organolithiumverbindung umgesetzt, die zusammen mit dem Aldehydteil nach Aufarbeitung Fexofenadin ergibt.
Sonstige Informationen
Geschichte
Fexofenadin wurde zunächst als Nachfolger von Terfenadin entwickelt und ersetzte es danach in vielen Ländern, da Terfenadin dort wegen schwerwiegender Nebenwirkungen vom Markt genommen wurde (Ausnahme: Deutschland; siehe auch Terfenadin, Abschnitt »Geschichte«).
Der ältere Wirkstoff Terfenadin wird im Körper zur Carbonsäure Fexofenadin oxidiert. Dieses Stoffwechselprodukt besitzt die gleiche biologische Aktivität wie Terfenadin, verursacht aber weniger Nebenwirkungen. Fexofenadin wurde von Hoechst Marion Roussel (inzwischen Teil von Sanofi-Aventis) entwickelt und erstmals 1996 in den USA zugelassen. Die Patente für die Produktion von Fexofenadin und dessen Zwischenprodukten werden von den Firmen Sanofi-Aventis und Albany Molecular Research (AMRI) gehalten.
Handelsnamen und Darreichungsformen
Fexofenadin wird in Deutschland und der Schweiz unter dem Warenzeichen Telfast sowie unter generischen Handelsnamen vertrieben. In Österreich ist es als Allegra erhältlich. Die Tabletten enthalten das Hydrochloridsalz des Arzneistoffs. Während in Deutschland und der Schweiz drei verschiedene Tablettenstärken angeboten werden, wird in Österreich nur eine mittlere Tablettenstärke vertrieben. In manchen EU-Mitgliedsstaaten ist Fexofenadin rezeptfrei erhältlich. In den USA wird es unter dem Handelsnamen Allegra ebenfalls rezeptfrei verkauft. Andere Handelsnamen: Fastofen, Tilfur, Vifas, Telfexo und Allerfexo.
Einzelnachweise
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 693.
- ↑ Datenblatt Fexofenadine hydrochloride bei Sigma-Aldrich, abgerufen am 22. September 2018 (PDF).
- ↑ F. E. Simons, K. J. Simons: Peripheral H1-blockade effect of fexofenadine. In: Ann Allergy Asthma Immunol. 79, 1997, S. 530–532. PMID 9433369.
- ↑ Nicole Schuster: Neuer Interaktionsmechanismus entdeckt. In: Pharmazeutische Zeitung. 2008, abgerufen am 9. November 2014.
- ↑ T. Tateishi, M. Miura, T. Suzuki, T. Uno: The different effects of itraconazole on the pharmacokinetics of fexofenadine enantiomers. In: Br J Clin Pharmacol. 65, 2008, S. 693–700. PMID 18294330.
- ↑ E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: Eur J Clin Pharmacol. 26, 1984, S. 663–668. PMID 6092093.
- ↑ Daniel Lednicer: The Organic Chemistry of Drug Synthesis. Band 6. Wiley Interscience, New York 1999, ISBN 0-471-24510-0, S. 38–40.
Auf dieser Seite verwendete Medien
Autor/Urheber: Jürgen Martens, Lizenz: CC BY-SA 3.0
Fexofenadin-Racemat Strukturformeln der Enantiomere
Fexofenadinsynthese

