Ferrochelatase
| Ferrochelatase | ||
|---|---|---|
 | ||
| Ferrochelatase homodimer, Human nach PDB 1HRK | ||
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 369 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | (2Fe-2S) | |
| Bezeichner | ||
| Gen-Name | FECH | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.99.1.1, Lyase | |
| Reaktionsart | Elimination | |
| Substrat | Protoporphyrin IX + Fe2+ | |
| Produkte | Häm b + 2 H+ | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2235 | 14151 |
| Ensembl | ENSG00000066926 | ENSMUSG00000024588 |
| UniProt | P22830 | Q544X6 |
| Refseq (mRNA) | NM_001012515 | NM_007998 |
| Refseq (Protein) | NP_001012533 | NP_032024 |
| Genlocus | Chr 18: 57.54 – 57.59 Mb | Chr 18: 6.45 – 64.49 Mb |
| PubMed-Suche | 2235 | 14151 |
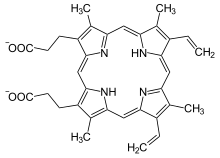
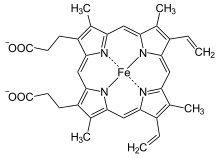
Ferrochelatase (auch: Häm-Synthase) ist ein Enzym in Eukaryoten und den meisten Bakterien, das den letzten Teilschritt der Synthese des Häm, die Chelatierung von Protoporphyrin IX mit einem Eisen-II-Ion, katalysiert. Da die Reaktion bei Eukaryoten in den Mitochondrien bzw. Chloroplasten stattfindet, muss Protoporphyrin zuvor in diese Kompartimente transportiert werden; der genaue Ablauf des Transports ist noch unklar. Beim Menschen führen Mutationen am FECH-Gen zu Ferrochelatasemangel, welcher für die seltene Erbkrankheit erythropoetische Protoporphyrie verantwortlich ist.[1][2][3] In Archaeen und sulfatreduzierenden Bakterien, die Häm nach einem alternativen Syntheseweg herstellen, wurde das Eisen-chelierende Enzym noch nicht identifiziert.[4]
Katalysierte Reaktion
Protoporphyrin IX wird mit Eisen-II cheliert, Protonen werden abgespalten, Häm b entsteht. Umgekehrt kann das Enzym auch die Entfernung des Metallions beim Abbau verschiedener Häme katalysieren. Als Cofaktor fungiert ein Eisen-Schwefel-Cluster. Rekombinante Ferrochelatase ist in der Lage, auch andere zweiwertige Metallionen wie Kobalt, Nickel, Zink oder Kupfer zu chelieren.[5][6]
Weblinks
- Jassal, D’Eustachio / reactome: Ferrous iron is inserted into protoporphyrin IX to form heme
Einzelnachweise
- ↑ a b BRENDA-Eintrag
- ↑ Jassal, D’Eustachio / reactome: Protoporphyrin IX is transported from the mitochondrial intermembrane space into the mitochondrial matrix.
- ↑ UniProt P22830
- ↑ M. Kühner et al.: The Alternative Route to Heme in the Methanogenic Archaeon Methanosarcina barkeri. In: Archaea. 2014. Jahrgang, 2014, doi:10.1155/2014/327637.
- ↑ S. Taketani, M. Ishigaki, A. Mizutani, et al.: Heme synthase (ferrochelatase) catalyzes the removal of iron from heme and demetalation of metalloporphyrins. In: Biochemistry. 46. Jahrgang, Nr. 51, Dezember 2007, S. 15054–61, doi:10.1021/bi701460x, PMID 18044970.
- ↑ Hunter GA, Sampson MP, Ferreira GC: Metal ion substrate inhibition of ferrochelatase. In: J. Biol. Chem. 283. Jahrgang, Nr. 35, August 2008, S. 23685–91, doi:10.1074/jbc.M803372200, PMID 18593702.
Auf dieser Seite verwendete Medien
Autor/Urheber:
Deposition authors: Wu, C.K., Dailey, H.A., Rose, J.P., Burden, A., Sellers, V.M., Wang, B.-C.;
visualization author: User:Astrojan, Lizenz: CC BY-SA 4.0Ferrochelatase homodimer + 4 cholate (green-red) + 2 Fe2S2 (brown-yellow), Human
Struktur von Protoporphyrin IX
Struktur von Häm b (Fe-Protoporphyrin IX)