Fenipentol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Fenipentol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H16O | ||||||||||||||||||
| Kurzbeschreibung | farblose bis leicht gelbliche Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | A05AX07 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 164,24 g·mol−1 | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Löslichkeit | mischbar mit organischen Flüssigkeiten, praktisch nicht mischbar mit Wasser[1] | ||||||||||||||||||
| Brechungsindex | 1,4086 (25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Fenipentol ist ein Arzneistoff, der die Gallesekretion anregt und daher zur Gruppe der Choleretika gehört. Der Arzneistoff besitzt ein Stereozentrum, ist also chiral und liegt als Racemat [1:1-Gemisch des (R)-Isomeres und des (S)-Isomeres] vor.
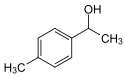
Er wurde synthetisch aus einem gallenwirksamen Inhaltsstoff der Kurkuma-Pflanze (Curcuma domestica), dem p [nach IUPAC: 1-(4-Methylphenyl)ethanol] abgeleitet. Seine Toxizität ist geringer als die der Muttersubstanz.

Synthese
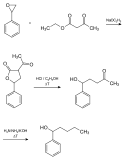
Ein möglicher Syntheseweg geht von Styrolepoxid aus. Styrolepoxid reagiert in Gegenwart von Natriumethanolat mit Acetessigester zu α-Acetyl-γ-phenyl-γ-butyrolacton, welches durch Erhitzen in ethanolischer Salzsäure unter Abspaltung von Kohlenstoffdioxid zu 5-Hydroxy-5-phenyl-pentanon weiterreagiert. Durch Erhitzen unter Rückfluss mit Hydrazin und Kaliumhydroxid entsteht in einer Wolff-Kishner-Reaktion das Fenipentol.[5]
Ein weiterer Syntheseweg ist die Umsetzung von Benzaldehyd mit n-Butylmagnesiumbromid, der Grignardverbindung aus n und Magnesium und anschließender Hydrolyse.[4]
Handelsnamen
Febichol (D, außer Handel)
Literatur
- Hermann J. Roth, Helmut Fenner: Arzneistoffe. Thieme, Stuttgart / New York 1988, S. 598–599.
Einzelnachweise
- ↑ a b The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, ISBN 0-911910-00-X, S. 679.
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-430.
- ↑ a b Datenblatt 1-PHENYL-1-PENTANOL bei Sigma-Aldrich, abgerufen am 31. März 2011 (PDF).
- ↑ a b c A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2001, ISBN 3-13-558404-6.
- ↑ Siegfried Ebel: Hagers Handbuch der Pharmazeutischen Praxis. Springer, 1999, ISBN 3-540-62644-1, S. 500 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur des p-Tolylmethylcarbinols
Synthese von Fenipentinol
Struktur des Fenistols