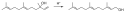Farnesol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
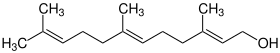 | |||||||||||||||||||
| (2E,6E)-Form von Farnesol | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Farnesol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C15H26O | ||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 222,37 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig | ||||||||||||||||||
| Dichte | 0,89 g·cm−3[3] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Farnesol ist ein acyclischer Sesquiterpenalkohol mit einem blumigen, an Maiglöckchen erinnernden Geruch. Der Name stammt von der Akazienart Acacia farnesiana. Farnesol ist ein Juvenilhormon und Insektenpheromon.


Vorkommen
Farnesol ist verbreitet im Öl von Moschuskörnern, Lindenblüten und kommt in Blauem Eukalyptus (Eucalyptus globulus),[4] Telosma cordata,[4][5] Bisameibisch (Abelmoschus moschatus),[6] Süße Akazie (Acacia farnesiana),[6] Eisenhölzern (Metrosideros sclerocarpa),[7] Ageratum (Ageratum conyzoides),[6] Cymbopogon parkeri,[6] Studentenblumen (Tagetes lucida),[7] Kreuzkümmel (Cuminum cyminum),[6] Ceylon-Zimtbaum (Cinnamomum verum),[7] Boldo (Peumus boldus),[6] Gamander (Teucrium polium, Teucrium gnaphalodes),[8] Gemeiner Schafgarbe (Achillea millefolium),[9] Griechischem Bergtee (Sideritis scardica),[6] Oregano (Origanum onites)[6] und Zitronengras (Cymbopogon winterianus),[6] sowie anderen ätherischen Ölen wie, Sternanisöl,[10] Anisöl, Jasminöl,[6] und Rosenöl (Rosa gallica, Rosa damascena)[6][9] vor.
Gewinnung und Darstellung
Es kann durch saure Isomerisierung von Nerolidol hergestellt werden.

Nerolidol kann über mehrere Schritte aus Linalool synthetisiert werden.
Verwendung
Es wird als Duft- und antibakterieller Wirkstoff in Kosmetika verwendet.[11]
Biologische Bedeutung
Farnesol ist als Diphosphat (auch Farnesylpyrophosphat, FPP, genannt) ein wichtiges Zwischenprodukt des Stoffwechsels. Es spielt bei der Prenylierung von Proteinen, bei der Biosynthese von Cholesterol, Ubichinon und anderer Terpene eine zentrale Rolle und wird selbst aus Geranyldiphosphat (GPP, siehe auch Geraniol) gebildet. Beim dimorphen Pilz Candida albicans hemmt Farnesol das Hyphenwachstum und wird in diesem Zusammenhang auch als Quorum sensing-Molekül bezeichnet.
Medizinische Anwendung
Farnesol hemmt die Bildung von Staphylokokken- und Streptokokken-Biofilmen. Auch degradiert Farnesol die Enzyme Farnesyltransferase und Fettsäure-Synthase, weshalb es in der Krebstherapie eingesetzt werden könnte.[12]
Einzelnachweise
- ↑ Eintrag zu FARNESOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Oktober 2021.
- ↑ a b Eintrag zu Farnesol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- ↑ a b c d e f Eintrag zu Farnesol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b CIS-TRANS-FARNESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2021.
- ↑ CIS,CIS-FARNESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2021.
- ↑ a b c d e f g h i j k FARNESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2021.
- ↑ a b c (E)(E)-FARNESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2021.
- ↑ (E,Z)-FARNESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2021.
- ↑ a b TRANS-TRANS-FARNESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2021.
- ↑ Jayanta Kumar Patra, Gitishree Das, Sankhadip Bose, Sabyasachi Banerjee, Chethala N. Vishnuprasad, Maria Pilar Rodriguez‐Torres, Han‐Seung Shin: Star anise (Illicium verum): Chemical compounds, antiviral properties, and clinical relevance. In: Phytotherapy Research. Band 34, Nr. 6, Juni 2020, S. 1248–1267, doi:10.1002/ptr.6614.
- ↑ Juliane Daphi-Weber, Heike Raddatz, Rainer Müller: Untersuchung von Riechstoffen – Kontrollierte Düfte. S. 94–95, in Band V der Reihe HighChem hautnah – Aktuelles aus der Lebensmittelchemie (Herausgegeben von der Gesellschaft Deutscher Chemiker) 2010, ISBN 978-3-936028-64-5.
- ↑ Robin E. Duncan, Michael C. Archer: Farnesol decreases serum triglycerides in rats: identification of mechanisms including up-regulation of PPARalpha and down-regulation of fatty acid synthase in hepatocytes. In: Lipids. Band 43, Nr. 7, Juli 2008, S. 619–627, doi:10.1007/s11745-008-3192-3, PMID 18509688.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Strukturformel von Farnesol
Autor/Urheber: 3268zauber, Lizenz: CC BY-SA 3.0
Blüten der Sommerlinde (Tilia platyphyllos)
Acid-catalyzed isomerization of nerolidol to farnesol.
Autor/Urheber: Kristine Paulus from New York, United States, Lizenz: CC BY 2.0
Swindler Cove Park