Farnesene
| Farnesene | |||
| Name | α-Farnesen | β-Farnesen | |
| Andere Namen | (3E,6E)-3,7,11-Trimethyl- 1,3,6,10-dodecatetraen | (6E)-7,11-Dimethyl-3-methylen- 1,6,10-dodecatrien | |
| Strukturformel | |||
| CAS-Nummer | 26560-14-5 (Z,E-α) | 18794-84-8 (trans-β) | |
| 502-61-4 (Isomerengemisch) | |||
| PubChem | 5281516 | 5281517 | |
| Summenformel | C15H24 | ||
| Molare Masse | 204,36 g·mol−1 | ||
| Aggregatzustand | flüssig | ||
| Kurzbeschreibung | farblose Flüssigkeit[1] | ||
| Dichte | 0,844–0,879 g·cm−3[2] | ||
| Brechungsindex | 1,490–1,505 (bei 20 °C)[2] | ||
| Siedepunkt | α-(Z)-Isomer: 98–102 °C (6,7 hPa)[1] | β-(Z)-Isomer: 95–107 °C (6,7 hPa)[1] | |
| Löslichkeit | unlöslich in Wasser[2] | ||
| GHS- Kennzeichnung[2] |
| ||
| H- und P-Sätze | keine H-Sätze | ||
| keine P-Sätze[2] | |||
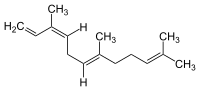
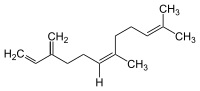
Die Farnesene (Betonung auf der dritten Silbe: Farnesene) bilden eine Stoffgruppe, die sechs nahe verwandte Verbindungen aus der Klasse der Sesquiterpene umfasst. α-Farnesen und β-Farnesen sind Isomere, mit unterschiedlicher Lage der Doppelbindung. Bei α-Farnesen handelt es sich um 3,7,11-Trimethyl-1,3,6,10-dodecatetraen, während β-Farnesen die Formel 7,11-Dimethyl-3-methylen-1,6,10-dodecatrien besitzt. Von der Alphaform existieren vier Konfigurationsisomere, die sich bezüglich der Geometrie der beiden innen liegenden Doppelbindungen unterscheiden (an den endständigen Doppelbindungen gibt es keine Möglichkeit zur Isomerie). Vom Beta-Isomer existieren zwei Isomere, die sich in der Konfiguration ihrer mittleren Doppelbindung unterscheiden.
α-Farnesen
Zwei der Konfigurationsisomere des α-Farnesens wurden als Naturstoffe isoliert.
(E,E)-α-Farnesen ist das verbreitetere von beiden. Es findet sich beispielsweise in der Schale von Äpfeln und anderen Früchten und ist Träger des charakteristischen „Grüner-Apfel-Aromas“. Oxidation durch Luft führt zu Verbindungen, die letztendlich zum Zelltod der äußeren Zellschichten der Frucht führen, wie man sie an den braunen Verfärbungen bei Druckstellen von Äpfeln beobachten kann.
(Z,E)-α-Farnesen wurde aus dem ätherischen Öl von Perilla isoliert. Beide Isomere wirken auf Insekten als Botenstoffe; sie wirken als Alarmpheromone bei Termiten[3] oder als Lockstoff beim Apfelwickler.[4]
α-Farnesen ist weiterhin der Hauptbestandteil des Gardenienöls (aus Gardenien) mit einem Anteil von etwa 65 % der flüchtigen Komponenten.[5]
Die beiden anderen Isomere sind technisch herstellbar.
β-Farnesen
Vom β-Farnesen wurde bisher ein Isomer in der Natur nachgewiesen.
Das (E)-Isomer ist ein Bestandteil verschiedener ätherischer Öle, z. B. von Cannabis sativa[6]. Es wird von Blattläusen als Alarmpheromon freigesetzt, um andere Blattläuse zu warnen. Es konnte gezeigt werden, dass verschiedene Pflanzen wie beispielsweise einige Kartoffelarten dieses Pheromon als ein natürliches Repellent gegen Insekten verwenden.[7][8]
Das (Z)-Isomer wurde bisher nur künstlich dargestellt.
Siehe auch
Einzelnachweise
- ↑ a b c Eintrag zu Farnesen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ a b c d e Datenblatt Farnesene bei Sigma-Aldrich, abgerufen am 29. März 2013 (PDF).
- ↑ Šobotník, J., Hanus, R., Kalinová, B., Piskorski, R., Cvačka, J., Bourguignon, T., Roisin, Y.: (E,E)-α-Farnesene, an Alarm Pheromone of the Termite Prorhinotermes canalifrons. In: Journal of Chemical Ecology. Band 34, April 2008, S. 478–486, doi:10.1007/s10886-008-9450-2.
- ↑ Hern, A. & Dorn, S.: Sexual dimorphism in the olfactory orientation of adult Cydia pomonella in response to alpha-farnesene. In: Entomologia Experimentalis et Applicata. Band 92, Juli 1999, S. 63–72.
- ↑ Shau-Chun Wang, Ting-Yu Tseng, Chih-Min Huanga, Tung-Hu: Gardenia herbal active constituents: applicable separation procedures. In: Journal of Chromatography B. Band 812, 5. Dezember 2004, S. 193–202.
- ↑ Nils Günnewich, Jonathan E. Page, Tobias G. Köllner, Jörg Degenhardt, Toni M. Kutchan: Functional Expression and Characterization of Trichome-Specific (-)-Limonene Synthase and (+)-α-Pinene Synthase from Cannabis sativa. In: Natural Product Communications. Band 2, Nr. 3, März 2007, doi:10.1177/1934578X0700200301.
- ↑ Gibson, R. W. & Pickett, J. A.: Wild potato repels aphids by release of aphid alarm pheromone. In: Nature. Band 302, 14. April 1983, S. 608–609, doi:10.1046/j.1570-7458.1999.00525.x.
- ↑ Avé, D. A., Gregory, P., Tingey, W. M.: Aphid repellent sesquiterpenes in glandular trichomes of Solanum berthaultii and S. tuberosum. In: Entomologia Experimentalis et Applicata. Band 44, Juli 1987, S. 131–138, doi:10.1111/j.1570-7458.1987.tb01057.x.
Auf dieser Seite verwendete Medien
alpha-Farnesen, Isomer (3Z,6E)-3,7,11-trimethyldodeca-1,3,6,10-tetraene
Chemische Struktur des α-Farnesens, Isomer (3E,6Z)-3,7,11-trimethyldodeca-1,3,6,10-tetraene
Chemische Struktur des α-Farnesens, Isomer (3Z,6Z)-3,7,11-trimethyldodeca-1,3,6,10-tetraene
beta_Farnesen Isomer (6E)-7,11-dimethyl-3-methylidenedodeca-1,6,10-triene
Chemische Struktur des α-Farnesens
alpha-Farnesen, Isomer (3E,6E)-3,7,11-trimethyldodeca-1,3,6,10-tetraene
Chemische Struktur des α-Farnesens
beta_Farnesen Isomer (6Z)-7,11-dimethyl-3-methylidenedodeca-1,6,10-triene