FAD-Synthetase
| FAD-Synthetase | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 587 Aminosäuren | |
| Kofaktor | Magnesium | |
| Isoformen | 5 | |
| Bezeichner | ||
| Gen-Name | FLAD1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.7.2, Nukleotidyltransferase | |
| Reaktionsart | Übertragung eines Adenylylrests | |
| Substrat | FMN + ATP | |
| Produkte | FAD + PPi | |
| Vorkommen | ||
| Homologie-Familie | FAD-Synthetase | |
| Übergeordnetes Taxon | Bilateria | |
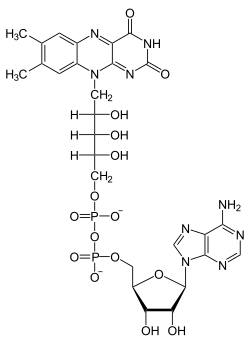
FAD-Synthetase (auch: FMN-Adenylyltransferase, Gen: FLAD1) ist das Enzym, das die Umwandlung von Flavinmononukleotid (FMN) in Flavinadenindinukleotid (FAD) katalysiert. Es ist daher unentbehrlich für die Verwertung von Riboflavin (Vitamin B2), da dieses nur als FAD Funktionen im Stoffwechsel ausübt. Die FAD-Synthetase kommt in den meisten Tieren (Bilateria) vor. Beim Menschen sind fünf Isoformen des Enzyms bekannt.[1]
Ein Überschuss an FMN hemmt die Synthetase (Substratüberschusshemmung).[2]
Katalysierte Reaktion
Ein Adenylylrest wird von ATP auf FMN übertragen und es entsteht FAD und Diphosphat.
Weblinks
- reactome.org: FMN is futher phosphorylated to FAD
Einzelnachweise
- ↑ UniProt Q8NFF5
- ↑ Helmut Heseker, Anna Stahl: Vitamin B2 (Riboflavin). (PDF) In: Ernährungs-Umschau. Oktober 2008, abgerufen am 23. Dezember 2022.
Auf dieser Seite verwendete Medien
Struktur von Flavinadenindinukleotid (FAD), oxidiert
Struktur von Riboflavin-5'-phosphat (Flavinmononukleotid, FMN)