Exkretion

C Blutkreislauf (oder Lymphe), D Verdauungstrakt, E Exkretionsöffnung, N Nervensystem, R Atmung[1]
Als Exkretion (lateinisch excernere „ausscheiden“) wird die Abgabe von überflüssigen[2] Stoffwechselprodukten aus dem Körper an die Umwelt bezeichnet.[3] Der Vorgang wird oft auch einfach Ausscheidung genannt, doch werden darunter auch Sekretionsleistungen und alle anderen Abgaben des Körpers verstanden. Exkretion umfasst die Abgabe gelöster Bestandteile, die Defäkation festerer Bestandteile[4] und die Abgabe gasförmiger Bestandteile, die der Körper nicht mehr benötigt.[5]
Defäkation ist die Abgabe unverdaulicher Bestandteile der Nahrung, die im Inneren des Darms verbleiben und nicht in den Körper aufgenommen wurden (z. B. unverdauliche Ballaststoffe), sowie unerwünschte bzw. überflüssige Stoffe des Stoffwechsels, die an den Darm zur Exkretion abgegeben werden können. Bei vielen Tieren werden sie durch eine Kloake abgegeben. Außerdem an der Exkretion beteiligt sind bei Wirbeltieren Atmung, Harnorgan und Haut.[5] Die Abgabe von Atemgasen (Kohlenstoffdioxid) und Wasserdampf wird meist zur Atmung und nicht zur Exkretion gerechnet.[3] Das rektal ausgeschiedene Gasvolumen (Meteorismus, Flatulenz) wird der Exkretion zugeordnet.[6]
Bei Organismen, die feste und gelöste Bestandteile getrennt (über Darmausgang und Harnorgan) abgeben (viele Säugetiere einschließlich Mensch), kann Exkretion auch nur auf die Abgabe in wässriger Form über die Harnröhre (Urethra) bezogen werden. Die Sammelbezeichnung für Produkte der Exkretion in gelöster Form und der Defäkation ist Exkremente.
Auch bei Pflanzen kann als Exkretion bezeichnet werden, wenn für den Organismus schädliche Stoffwechselprodukte ausgeschieden werden. Oft geschieht das über spezielle Exkretions- oder Absonderungsgewebe.

Ausgeschiedene Substanzen
Die Exkretion beinhaltet Abbauprodukte des Stoffwechsels, Salze bzw. deren Ionen und unverdaute Bestandteile, meist als Feststoffe wahrgenommen. Außerdem ist eine mehr oder minder große Menge Wasser enthalten.
Begleitstoffe

Wasser
Wasser ist in aller Regel kein Stoff, der abgegeben werden müsste. Im Gegenteil, Wasser benötigen alle Organismen, um Lebensfunktionen ausführen zu können. Wasser ist aber in den Exkretionen weitgehend unverzichtbar, um wasserlösliche Stoffe (in der Medizin wird auch von „harnpflichtigen Substanzen“ gesprochen) aus dem Körper zu leiten. Aber auch Verdauungsrückstände können noch beträchtliche Wassermengen binden, im menschlichen Kot sind etwa 40 % des ausgeschiedenen Wasservolumens enthalten. Wasser kann sogar den größten Anteil an den Ausscheidungen einnehmen. Gerade der verfügbare Wasseranteil ist charakteristisch für die verschiedenen in der Evolution entwickelten Exkretionssysteme. Bei wasserlebenden Organismen ist er kaum begrenzt. Trotzdem unterscheiden sich die Lösungswege der Wasserorganismen teilweise beträchtlich, sie bauen auf Lösungsansätzen ihrer Vorfahren auf, die teilweise keine Wasserorganismen waren. Bei terrestrisch lebenden Organismen steht nicht beliebig Wasser zur Verfügung, daher sind zum einen Mechanismen gefordert, die geringer Wassermengen bedürfen, zum anderen erlangt die Wasserrückgewinnung (Wasserresorption) Bedeutung. So wird der Primärharn in den Nierenkanälchen (Tubuli) der Nephrone der Säugetiere konzentriert, das heißt, Wasser wird zurückgewonnen. Bei fliegenden Organismen wird die zur Verfügung stehende Wassermenge noch kritischer, denn zu Exkretionszwecken erforderliche Wassermengen tragen zur Masse des Organismus bei. Effektive Gewichtsreduzierung bedeutet daher auch, dass der Exkretionsmechanismus möglichst wenig Wasser benötigt.
Anders ist die Situation nur für Organismen, die mit ihrer Nahrung größere Wassermengen aufnehmen. Dazu gehören nicht die großen Planktonfresser (Riesenhai, Walhai, Blauwal), die das Wasser gar nicht schlucken, sondern über Filter (Kiemenspalten bzw. Barten) abgeben oder auspressen. Organismen, die regelmäßig große Wassermengen mit der Nahrung aufnehmen, sind hauptsächlich blutfressende Ektoparasiten. Insbesondere für fliegende stellt der Wasserballast eine Herausforderung dar, denn die Blutaufnahme kann ihr eigentliches Körpergewicht übertreffen und ihre Flugfähigkeit sehr beeinträchtigen. Das betrifft nicht nur blutsaugende Insekten, auch beispielsweise Vampirfledermäuse sind genauso davon betroffen. Nach der Blutmahlzeit wird daher die Diurese hormonell stark angeregt, um einen Großteil der Wassermenge sehr rasch auszuscheiden.[7][8][9]
Gleitstoffe
Zur erleichterten Darmpassage und Ausscheidung sind neben der Hauptkomponente Wasser oft schleimige Gleitstoffe aus Darmschleimhaut oder Drüsen in den Exkreten, Fäzes und Exkrementen mit enthalten.
Abbauprodukte
Abbauprodukte des Stoffwechsels, die nicht mehr benötigt werden, müssen an die Umwelt abgegeben werden.[2] Manchmal sind diese Metaboliten für andere Organismen wie auch für den abgebenden Organismus giftig. Dies betrifft alle Organismen aller Reiche. Ein Ausfall des Harnorgans kann beispielsweise zu einer Harnvergiftung führen.

Stickstoffverbindungen
Eine zentrale Aufgabe der Exkretion der Tiere besteht darin, überschüssige Stickstoffverbindungen aus dem Körper zu schaffen. Alle Tiere ernähren sich von anderen Organismen oder deren Überbleibseln und nutzen die in deren Bestandteilen gespeicherte chemische Energie oder wandeln die aufgenommenen Substanzen zu körpereigenen Stoffen um (Stoffwechsel). Für die stickstoffhaltigen Komponenten (hauptsächlich aus Protein- und Nukleinsäureabbau) besteht jedoch weniger Bedarf. Der Überfluss muss ausgeschieden werden. Da dieser nicht in die Form gasförmigen Stickstoffs umgewandelt werden kann, werden andere Wege gegangen.[10] Die Wahl des Stickstoffträgers und die Ausgestaltung des Exkretionssystems[11] hängen von den Umgebungsbedingungen ab, insbesondere vom Wasserangebot. Wasserorganismen geben bevorzugt Ammonium als Stickstoffträger ab, während landlebende Tiere meist Harnstoff oder Harnsäure exzernieren.[10][11] Ammonium, Harnstoff und Harnsäure werden über verschiedene Mechanismen durch Zellmembranen transportiert, entsprechend ihrem chemischen Verhalten in Lösung.[10]
Wasserbedarf bei Ausscheidung von 1 g Stickstoff:
- Ammoniak-Lösung: 500 ml Wasser
- Harnstoff: 50 ml Wasser
- Harnsäure: 1 ml Wasser
Die Problematik der Stickstoffanreicherung besteht für Pflanzen weniger, sie haben in der Regel einen Mangel an organischen Stickstoffverbindungen.
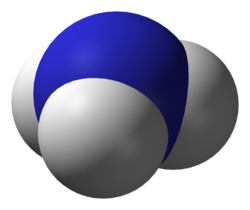
Ammoniak

blau: Stickstoff, weiß: Wasserstoff
Ammoniak stellt eine mögliche und einfach zu realisierende Stickstoffverbindung dar und besitzt zudem den Vorteil, kaum noch chemische Energie zu enthalten. Der Stoff ist aber für Organismen schon in geringen Mengen giftig,[2] z. B. für Menschen stechend riechend. Er ist ein Gas, in Wasser gut löslich, bedarf aber gelöst einer recht hohen Verdünnung, um auch während der Exkretion nicht giftig zu wirken. Somit eignet er sich besonders für die Abgabe mittels Kiemen. Bei den meisten Knochenfischen und den Larven vieler Amphibien erfolgt die Exkretion von Stickstoffverbindungen zum größten Teil als Ammoniak direkt aus dem Blut durch die Kiemen, eine Niere erübrigt sich dabei.
Ammonium
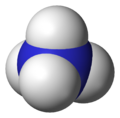
blau: Stickstoff, weiß: Wasserstoff
Ähnlich wie Ammoniak kann auch Ammonium durch die Kiemen vieler Fische direkt vom Blut an das Umgebungswasser abgegeben werden.
Eine andere Möglichkeit haben besonders kleine Vögel wie Kolibris entwickelt, sie scheiden Stickstoff überwiegend als Ammonium in wasserarmer Form (als Paste) aus.[12] Aber auch Säugetiere und der Mensch geben Ammonium mit ihrem Urin ab.
Harnstoff

blau: Stickstoff,
weiß: Wasserstoff,
rot: Sauerstoff,
schwarz: Kohlenstoff
Wasserlöslicher Harnstoff und dessen Exkretion als Urin ist vorteilhaft, denn er enthält nur noch wenig chemisch gebundene Energie, hat allerdings den Nachteil, dass er nur in Wasser gelöst ausgeschieden werden kann. Der Stickstoffträger Harnstoff wird von den meisten Säugetieren primär in ihrem Urin ausgeschieden, etwa 20 % mit dem Kot. Für Flugtiere wie Fledermäuse kommt die Harnstoffausscheidung wegen der Wasserbindung weniger in Betracht.
Beim Abbau des abgegebenen Harnstoffs kann sich daraus durch Hydrolyse Ammoniak entwickeln.
Auch Knochenfische können dazu befähigt sein, Harnstoff abzugeben und je nach Bedingungen zwischen verschiedenen Stickstoffträgern wählen. Dazu gehören Kletterfische (Anabas Scandens), Schildfische (Sicyases sanguineus), Schlangenkopffische (Asiatischer kleiner Schlangenkopf Channa Gachua), Schleimfische (Blennius pholis), Stachelwelse (Mystus vittatus) und andere, die sich amphibisch in der Gezeitenzone aufhalten.[13] Solange sie von ausreichend Wasser umgeben sind, geben sie Stickstoff wie die meisten Fische hauptsächlich über ihre Kiemen in Form von Ammoniak ab. Sind sie nicht mehr im Wasser, geben sie meist über ihre Schleimhäute Harnstoff ab.[11][14] Dieser Harnstoff trägt seinerseits zu Feuchthaltung bei, indem er Luftfeuchtigkeit bindet. Die Abgabe von Ammoniak über die Kiemen ist an Luft nicht möglich, die Abgabe von Ammoniak über die Schleimhäute wäre wegen der Anhaftung des Giftes nicht opportun.
Guanin

blau: Stickstoff, weiß: Wasserstoff,
rot: Sauerstoff, schwarz: Kohlenstoff
Die Ausscheidung von Guanin als Stickstoffträger ist nachteilig, da er energiereicher ist als Harnstoff, hat aber für Flugtiere den großen Vorteil, dass dessen Exkretion kaum Wasser benötigt, also auch weniger Ballast bedingt (die Energiebilanz ist positiv). Guaninausscheidung ist wenig verbreitet, aber die meisten Vögel und Fledermäuse scheiden Guanin (vermischt mit Harnsäure) als pastöse Exkrete aus, das gilt auch für flugunfähige Vögel wie Pinguine, aber nicht Strauße. Daraus bildet sich durch Verwitterung Guano bzw. Fledermausguano.
Harnsäure
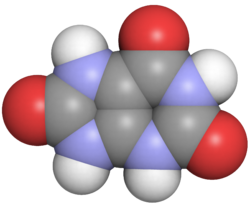
blau: Stickstoff, weiß: Wasserstoff,
rot: Sauerstoff, schwarz: Kohlenstoff
Harnsäure wird von vielen Insekten, Reptilien und Vögeln ausgeschieden.[15][16][17] Auch viele Säugetiere und der Mensch geben Harnsäure ab, zu etwa 65 % mit dem Urin und etwa 35 % mit dem Kot.
Kreatinin/Kreatin

blau: Stickstoff, weiß: Wasserstoff,
rot: Sauerstoff, schwarz: Kohlenstoff

blau: Stickstoff, weiß: Wasserstoff,
rot: Sauerstoff, schwarz: Kohlenstoff
Ebenfalls als Stickstoffträger, oft aber nur als körpereigenes Protein-Abbauprodukt gesehen, wird Kreatinin bzw. Kreatin ausgeschieden. Es rührt überwiegend aus dem Muskelabbau her.
Viele Säugetiere und der Mensch scheiden das harnpflichtige Stoffwechselprodukt Kreatinin im Urin aus. Zur Nierenfunktionsbeurteilung wird oft die Kreatinin-Clearance betrachtet, da dieser Vorgang die Nierenleistung besonders gut charakterisiert. Vögel scheiden stattdessen überwiegend Kreatin in ihren pastösen Exkreten aus.[18]
Ketokörper
Gesunde Menschen können gelegentlich, Erkrankte (Diabetes mellitus, Ketonämie) charakteristisch Ketokörper (Acetessigsäure und Betahydroxybuttersäure) oder Aceton ausscheiden, hauptsächlich im Urin (als Ketonurie bezeichnet), teilweise auch in den Atemgasen. Ketokörper sind Abbauprodukte.
Verdauungsgase
Mit der Verdauung entstehen bei vielen Tieren und beim Menschen auch gasförmige Bestandteile, die rektal abgegeben werden (0,5–1,5 Liter täglich), als Flatulenz bezeichnet.[6] Fünf verschiedene Gase in sehr variabler Menge machen beim Menschen 99 % der intestinalen Gasproduktion aus:[6]
| Gas | Formel | Anteil |
|---|---|---|
| Stickstoff | N2 | 11–92 % |
| Sauerstoff | O2 | 0–11 % |
| Kohlendioxid | CO2 | 3–54 % |
| Wasserdampf | H2O | 0–86 % |
| Methan | CH4 | 0–56 % |
Große Unterschiede rühren von unterschiedlicher Ernährung oder Erkrankungen (wie Reizdarmsyndrom).[6] Viele dieser Gaskomponenten entstehen primär als Atemgase der Endosymbionten, bei Cellulose verdauenden Tieren wie Wiederkäuern, die selber keine Cellulasen produzieren können, oft in erheblichem Ausmaß. Auch kann sich das Verhältnis der Gase zueinander ändern.
Außerdem können Kot und Exkremente viele volatile Stoffe enthalten wie Indol, Skatol, Alkanthiole und Schwefelwasserstoff, welche viele Tiere mit ihrem Geruchssinn wahrnehmen können, entweder um sie zu vermeiden, oder um sie als Nahrung zu nutzen.
Salze
Zur Osmoregulation und andere physiologische Vorgänge ist es erforderlich, Salzkonzentrationen im Körper durch selektive Ausscheidung zu steuern. Diese Notwendigkeit betrifft auch Pflanzen.
Eine Möglichkeit, Salze bzw. dessen Ionen (besonders Natriumionen und Chloridionen als die in der Regel am meisten vorkommenden) zur Osmoregulation auszuscheiden, bietet das Harnorgan. Dieser Exkretionsvorgang erfordert einen hohen Wasserumsatz, nicht im Wasser lebende Organismen können daher keine großen Salzmengen ausscheiden. Der Funktion des Harnorgans entsprechend kann die Exkretion von Salzen bei vielen Wirbellosen über Nephridien erfolgen.[19] Weitere Möglichkeiten bietet die Ausscheidung über die Haut (beispielsweise als Schweiß), bei sehr vielen Tieren bestehen allerdings Mengenbeschränkungen, insbesondere bei fliegenden. Auch ein Exoskelett (bei Gliederfüßern) steht diesem Weg entgegen. Viele Landtiere sind zur Exkretion von Schweiß daher nicht befähigt. Nahezu problemlos erfolgt die Salzabgabe über Kiemen.
Die Osmoregulation und Salzausscheidung mariner Säugetiere scheint sich prinzipiell nicht deutlich von der landlebender zu unterscheiden. Vermutlich nehmen sie kaum Meerwasser auf, sondern decken ihren Wasserbedarf aus ihrer Nahrung, die nur ca. die Hälfte der Salzkonzentration des Meerwassers enthält.[20][21]
Bei der Abgabe über das Harnorgan ist die Beteiligung einer Niere für die Salzabgabe erforderlich.
Unverdautes
Unverdaute und unverdauliche Bestandteile der Nahrung passieren meist den Darm zur Defäkation. Dazu gehören auch die hellen kalkreichen festen Ausscheidungen von Hyänen oder anderen Raubtieren, welche aus Resten der aufgenommenen Knochen bestehen.[22] Manche Feststoffe werden regelmäßig über den Aufnahmeweg wieder abgegeben oder ausgewürgt, so generell bei Nesseltieren (Cnidaria) oder vielen Vögeln (Nashornvogel), aber (zumindest gelegentlich) bei allen Tieren mit Mund (Erbrechen[23][24], Gewölle). Dieser Vorgang wird jedoch nur selten der Exkretion zugerechnet.[25]
Ausscheidungsformen
Es gibt viele Ausscheidungsformen, neben denen die Abgabe über Kiemen und fester kalkreicher Kot mancher Raubtiere die beiden extremen Gegensätze darstellen. Dazwischen liegen flüssige und pastöse Ausscheidungen. Vielfach sind Ausscheidungen auch inhomogene Mischformen, Zusammensetzungen verschiedener Konsistenzen mit abgrenzbaren stofflich unterschiedlichen Bereichen.
Urin
Bei vielen Tieren werden wasserlösliche Substanzen durch die Nieren aus dem Blut gefiltert und über den Urin abgegeben (renale Exkretion), insbesondere Harnstoff und Harnsäure, gelöst in Wasser, z. B. bei Affen und Menschen. Bei Reptilien ist der Harnsäureanteil größer, bei ihnen enthält er auch die Stickstoffanteile aus dem Aminosäureabbau. Auch Insekten scheiden in ihrem Urin Harnstoff aus.[19][26]

Kot
Einen Teil der Abbauprodukte gibt die Leber über die Galle in den Darm ab (biliäre Exkretion). Dort werden sie, zusammen mit den darmeigenen Ausscheidungen, zu einem Teil des Kotes.
Guanin
Der Kot der meisten Vögel, Reptilien und der Fledermäuse enthält das pastöse Guanin als Ausscheidungsform des Stickstoffes.
Kloakentiere
Tiere mit Kloake scheiden Harnsäure beziehungsweise die Produkte der Niere und den Darmkot gemeinsam über die Kloakenöffnung aus.
Schweiß
Schwitzen dient beim Menschen und vielen Säugetieren primär der Temperaturregulation und der innerartlichen Chemokommunikation. Soweit nur diese Vorgänge betrachtet werden, wird die Schweißproduktion üblicherweise nicht der Exkretion zugeordnet. Soweit aber die Osmoregulation betroffen ist und beispielsweise Natrium-, Kalium-, Kalzium- oder Magnesiumionen spezifisch durch den Schweiß aus dem Körper geschleust werden, zählt der Schweiß als Exkretion.[27][28] Als Exkretionsleistung gilt auch, dass die Harnstoffkonzentration im menschlichen Schweiß die im menschlichen Urin übersteigt.[29] Auch als Eliminationsweg für komplexere Stoffe des Stoffwechsels und leberbelastende Arzneistoffe dient der Schweiß.[30][31][32]
Organsysteme
Zentrales Stoffwechselorgan
Ein zentrales Stoffwechselorgan wie die Leber bei vielen Wirbeltieren ist oftmals verantwortlich für die Umwandlung von Substanzen in eine Form, die eine Ausscheidung ermöglicht. Deren Abgabe kann dann enterohepatisch und über den Darm erfolgen.
Körperoberfläche
Über die Haut können alle gelösten Stoffe abgegeben werden, soweit genügend Wasser und durchlässige Körperoberfläche vorhanden sind. Die Hautausscheidung ist daher besonders unproblematisch für Wassertiere mit weicher Oberfläche. Bei Kleinorganismen ohne Haut (Einzeller) erfolgt die Exkretion noch einfacher über die Zellmembran als Exozytose oder durch Expulsion eines Zellbestandteiles (wie beim Ausstoßen von Organellen und Zellkern bei der Reifung der Erythroblasten zu Erythrozyten).[33]
Bei der Hautexkretion und der Exkretion über die Zellmembranen sind die Funktionen Exkretion, Sekretion und Atmung kaum abgrenzbar.
Atmung
Über das Atmungssystem werden neben Kohlenstoffdioxid, dessen Abgabe eher der Atmung als der Exkretion zugeordnet wird, besonders Ammoniak oder Ammonium über die Kiemen vieler Wassertiere, so der marinen Knochenfische abgegeben. Viele marine Echte Knochenfische steuern ihre Osmoregulation und Salzabgabe ebenfalls über ihre Kiemen.[34]

Harnausscheidung
Harnbildung dient der Exkretion wasserlöslicher Stoffe, das sind Harnsäure, Harnstoff und viele Abbauprodukte.
Bei vielen Wirbellosen übernehmen verschiedene Formen der Nephridien die Exkretion; Protonephridien bei Plattwürmern (Plathelminthes) und vielen Larven der Spiralia und Metanephridien bei Ringelwürmern (Annelida) und weiteren Tieren mit einem Coelom. Das Harnorgan besteht aus Nieren, Harnleiter, Harnblase und Harnröhre. Dieses Organsystem ist bei vielen Säugetieren voll ausgebildet, bei vielen anderen Wirbeltieren nur partiell, bei Vögeln fehlen Blase und eine äußere Ureteröffnung (außer bei Straußen). Ein Harnorgan muss auch bei Arten nicht bestehen, wenn deren Exkretion über andere Organe abläuft, beispielsweise bei Endoparasiten über deren Haut.
Die Hauptaufgabe der Niere besteht darin, Wasser aus dem Primärurin zurückzugewinnen. In diesen Prozess fließt der Großteil der Energie, die die Nierenarbeit benötigt.

Rektale Ausscheidung
Bei Insekten werden die Abfallstoffe des Stoffwechsels mittels eines Systems Malpighischer Gefäße ausgeschieden.[35] Die auszuscheidenden Substanzen diffundieren oder werden aktiv in die Gefäße transportiert und von diesen in den Enddarm geleitet. Dort erfolgt dann der Entzug von Wasser und Ionen. Die restlichen Exkrete werden dann zusammen mit den Fäkalien ausgeschieden.[2]
Bei Säugetieren und anderen Wirbeltieren werden in der Leber erzeugte Abbauprodukte über die Galle (enterohepatisch) und über den Darm rektal ausgeschieden.
Gasförmige Substanzen können den Verdauungstrakt rektal[6] wie oral verlassen. Oft wird dieser Exkretionsform keine Bedeutung zugemessen, die Abgabe von Methan durch Wiederkäuer stellt jedoch einen ernstzunehmenden Faktor in der Berechnung der Treibhausgase dar. Flatulenz ist nicht der Atmung zuzurechnen (außer der der Archaeen im Wiederkäuermagen).

Kloake
Die meisten landlebenden Wirbeltiere besitzen eine einzige Körperöffnung (Kloake) zur Exkretion. Auch wenn hier getrennte Ausführgänge für feste und flüssige Bestandteile münden, können in der Kloake nochmals Wasser und Salze resorbiert werden und somit für die Gesamtexkretion einen geringeren Salz- und Wasserverlust erreichen.[36][37] Vögel geben ihre pastösen Exkrete über ihre Kloake ab.[38][39]

Spezielle Drüsen
Einige Krebstiere exzernieren über Antennendrüsen, einige Spinnentiere über Coxaldrüsen. Knorpelfische,[40] viele Meeresreptilien[41] (wie Meeresschildkröten[42] und Seeschlangen[43]) und Seevögel[44][45][46] besitzen Salzdrüsen zur Osmoregulation. Auch Pflanzen besitzen Salzausscheidungsorgane.[47][48]
Sekundärfunktionen
Ausscheidungsprodukte werden gelegentlich zusätzlich für weitere Funktionen genutzt.
Zusatznutzen
Osmoregulation und Säure-Basen-Regulation
Exkretionen von Ionen bedeuten meist gleichzeitig auch eine Osmoregulation und oft auch eine Regulation des Säure-Basen-Gleichgewichtes.[10] Dies betrifft die Salzexkretion, die Exkretion einiger Stickstoffträger und die Exkretion anderer geladener Metabolite. Unter den Stickstoffträgern liegen nicht alle in geladener Form vor, aber sowohl bei Wirbellosen wie bei Wirbeltieren dienen verschiedene Stickstoffträger der zellulären Osmoregulation.[10] Ammoniumausscheidung der Wirbeltiere über Nieren und der Ammoniumstoffwechsel sind verknüpft mit der renalen Säure-Basen-Regulation.[10]
Auftriebshilfe
Die Exkretion von Gasen, darunter auch Stickstoffträger, dient bei einigen wasserlebenden Tieren gleichzeitig dazu, für Auftrieb zu sorgen. Nicht alle Stickstoffträger sind dazu geeignet, sondern bevorzugt Ammonium.[10] Gleichfalls gasförmiges Ammoniak ist wegen seiner toxischen Eigenschaften ungeeignet, einen Auftriebskörper zu füllen. Die Abgabe über Kiemen steht ebenfalls einer Nutzung als Auftriebshilfe entgegen. Hauptsächlich wasserlebende Wirbellose können gasförmiges Ammonium als Auftriebshilfe nutzen.[10]
Thermoregulation
Die Schweißsekretion hat als Hauptfunktion eine temperatursenkende Thermoregulation bei einigen dazu befähigten Säugetieren und beim Menschen zum Ziel. Zur Optimierung enthält der Schweiß besonders hohe Harnstoffkonzentrationen, die dafür sorgen, zusätzlich Luftfeuchtigkeit an der Haut zu binden und so die Leistung der Verdunstungskühlung deutlich zu verlängern.
Kommunikation

Exkrete, Fäzes und Exkremente dienen bei Territorien bildenden Tieren oft der Revierabgrenzung und können dann zusätzliche Markierungsstoffe aus Analdrüsen enthalten.
Exkrete partnersuchender Tiere enthalten manchmal Lockstoffe, um mögliche Partner auf sich aufmerksam zu machen. Einige weibliche Tiere scheiden mit ihren Exkreten Stoffe aus, die ihren männlichen Artgenossen eine Paarungsbereitschaft anzeigen. Einige männliche Tiere nutzen die Individualität ihrer Geruchsstoffe in ihren Exkreten, um rivalisierende Männchen fernzuhalten.[49]
Einige Tiere nutzen die Geruchsstoffzusammensetzung ihrer Exkrete (aber auch Sekrete spezieller Drüsen), um einander individuell oder als Zugehörige einer Gemeinschaft zu identifizieren, besonders in weit verzweigten Bauen lebende. Oft ist es dazu erforderlich, dass sie sich mit ihren Exkreten einmassieren.[50]
In den Sekreten des Schweißes sind oft Pheromone enthalten, die die Attraktivität bei der Partnerwahl mitbestimmen, aber auch Faktoren, die eine individuelle Identifizierung von Rudelmitgliedern erlauben.[51] Allerdings teilen nicht alle Säugetiere diese anatomische Möglichkeit mit dem Menschen.[52]
Abwehrmittel
Manche Tiere sind befähigt, ihre Exkrete oder Exkremente zur Abwehr von Beutegreifern gezielt zu verspritzen, oft handelt es sich dabei allerdings um ein spezielles Sekret aus Stinkdrüsen, welches nicht als Exkret gilt.
Nutzen für andere Organismen

Nahrungsquelle
Ausscheidungsprodukte enthalten meist noch vielfältige Stoffe, in welchen chemische Energie gebunden ist und deren Abbau sich für darauf spezialisierte Organismen lohnt: Kotfresser (wie Heiliger Pillendreher) und viele der in toter organischer Substanz lebenden Organismen (Saprobionten und Saprophagen wie viele Schmeißfliegen bzw. deren Maden). Auch Honigbienen nehmen gelegentlich den von Rindenläusen ausgeschiedenen Honigtau von Fichten auf. Deren Verarbeitungsprodukt wird schließlich auch von Menschen im Waldhonig willig genossen. Der darin vorkommende Dreifachzucker Melezitose bezeugt seinen Ursprung aus dem Baumsaft.[53][54]
Einige Nagetiere (Meerschweinchen), Hasenartige und einige Pferdeverwandte, nehmen öfters ihre Ausscheidungen wieder auf, um sie in einer zweiten Darmpassage besser zu verwerten, analog zu Wiederkäuern, die zu einer intensiven Nutzung ihrer Futterstoffe befähigt sind, ohne ihre Ausscheidungen aufnehmen zu müssen. Der Vorgang des Fressens der eigenen Exkremente heißt Autokoprophagie.

Einige Tiere haben sich darauf spezialisiert, symbiotisch zusammenzuleben, wobei die Ausscheidungen der einen Art Nahrung der anderen darstellt. Bekannt dafür sind Blattläuse und Schildläuse, die von Ameisen gepflegt werden, um deren abgeschiedenen Honigtau aufzunehmen.
Ausbreitung
Viele Endoparasiten nutzen den Exkretionsweg zu einem Wirtswechsel oder zu einer Ausbreitung. Exkrete sind generell mit harmlosen und auch pathogenen Viren, Bakterien, Pilzsporen und Parasiten befrachtet. Dieser Infektionsweg stellt ein ernstes Hygieneproblem dar.
Pflanzen nutzen die Verschleppung im Verdauungssystem von Tieren und Exkretion ihrer Samen als Ausbreitungsstrategie. Um dies zu gewährleisten, investieren sie häufig in die Attraktivität von Früchten. Dieser Vorgang heißt allgemein Endochorie, bezogen auf Vögel Ornithochorie.
Orientierung
Es wurde vermutet, dass Nagetiere die Geruchswahrnehmung von Exkrementen besonders bedrohlicher Raubtiere nutzen können, um solche Gebiete zu meiden. Diese Vermutung wurde in einem Beispiel widerlegt.[55] Umgekehrt präferieren aber manche Beutegreifer aufgrund der Geruchswahrnehmung von Exkrementen ihrer Beutetiere bestimmte Jagdgebiete.[56]
Vandelliinae wie Vandellia cirrhosa (aus der Familie Schmerlenwelse im Amazonasbecken) schwimmen in die Kiemenöffnungen größerer Fische, dringen zur Kiemenaorta vor, perforieren sie mit ihren spitzen Zähnen und nehmen das austretende Blut ohne Saugakt auf. Um das Opfer auszumachen, nutzen Vandelliinae die Wahrnehmung dessen Exkretion und nehmen die Verfolgung auf, der Konzentration folgend. Aus Verwechslung dringen sie gelegentlich auch in die menschliche Harnröhre ein (was eine operative Entfernung erfordert), weshalb sie auch als Harnröhrenwelse oder Penisfische bezeichnet werden.[57]
Nachahmung
Visuell
Um sich vor Beutegreifern zu tarnen, ahmen einige Insektenlarven Vogelexkremente nach.[58][59] Diese Strategie der Nachahmung toter Objekte wird Allomimese genannt.
Geruchlich
Einige Organismen produzieren Geruchsstoffe, welche die in Ausscheidungen oft vorkommenden imitieren, um Koprophagen und Saprophagen olfaktorisch anzulocken. Dies ist bei einigen Pilzen und wenigen Pflanzen der Fall, die hauptsächlich Fliegen und Mücken (Zweiflügler) anlocken. Das geschieht zu verschiedenen Zwecken: So locken Stinkmorcheln damit, um die Verbreitung ihrer Sporen zu begünstigen, manche Aronstabgewächse locken, um ihre Befruchtung zu erreichen (beides Beispiele von Zoochorie) und manche fleischfressende Pflanzen, um Bestandteile von Zweiflüglern für ihren Stoffwechsel zu nutzen.
Begriffsabgrenzungen
Gegenüber Exkretion bezeichnet die Sekretion die Abgabe von Biomolekülen und Flüssigkeiten aus dem Körper, die eine biologische Funktion erfüllen (z. B. Schleim, Schweiß, Pheromone) und in einer Drüse gebildet wurden.[3]
Erstmals unterschieden zwischen Sekretion und Exkretion hatte 1830 der deutsche Anatom und Physiologe Johannes Müller.[60]
Der Begriff der exokrinen Sekretion klingt noch verwirrender, aber eine exokrine Drüse bedeutet eine Drüse, die ihre Sekrete mittels eines Ausführungsgangs in einen Körperhohlraum abgibt, z. B. Magen, Darm oder an die Hautoberfläche über die Brustdrüsen oder die Schweißdrüsen. Drüsen, die ihr Sekret an das Blut abgeben, nennt man endokrine Drüsen. Ebenfalls verwirrend klingt der Begriff der ekkrinen Sekretion, welcher die Abgabe des Produkts aus kleinen Bläschen (Sekretvesikel), die mit der Membran verschmelzen (Exozytose) umfasst.
In Zusammenhang mit der Exkretion, aber meist anatomisch abtrennbar, steht die Abgabe von Sekreten der Analdrüsen. Die Begriffsabtrennung zwischen Exkretion und Sekretion fällt allerdings bei vielen Organismen (beispielsweise Insekten, Einzellern, Pflanzen) schwer oder ist unmöglich.[2] Der Übergang zu Sekreten, also Verbindungen, die außerhalb des Organismus noch bestimmte Funktionen erfüllen (z. B. Anlockung von Bestäubern oder antibiotische Verbindungen), ist bei Pflanzen beispielsweise häufig fließend.
Siehe auch
Einzelnachweise
- ↑ Paul Bert: Leçons de zoologie Herausgeber G. Masson, Paris 1881.
- ↑ a b c d e D. G. Cochran: Excretion in insects. In: Insect Biochemistry and Function. Springer Netherlands, 1978, S. 177–281.
- ↑ a b c A. Remane, V. Storch, U. Welsch: Kurzes Lehrbuch der Zoologie. Gustav Fischer, Jena 1985.
- ↑ M. B. C. Sousa, T. E. Ziegler: Diurnal variation on the excretion patterns of fecal steroids in common marmoset (Callithrix jacchus) females. In: American Journal of Primatology. Band 46, Nr. 2, 1998, S. 105–117.
- ↑ a b B. S. Beckett: Biology: A Modern Introduction. Oxford University Press, 1987, ISBN 0-19-914260-2, S. 110 (englisch).
- ↑ a b c d e J. Stein: Meteorismus und Flatulenz. Funktionsdiagnostik in der Gastroenterologie. (PDF) Springer, Berlin/Heidelberg 2006, S. 231–240.
- ↑ T. S. Adams: Hematophagy and hormone release. In: Annals of the Entomological Society of America. Band 92, Nr. 1, 1999, S. 1–13, doi:10.1093/aesa/92.1.1.
- ↑ William A. Wimsatt: Transient behavior, nocturnal activity patterns, and feeding efficiency of vampire bats (Desmodus rotundus) under natural conditions. In: Journal of Mammalogy. 1969, S. 233–244, doi:10.2307/1378339, JSTOR:1378339.
- ↑ William N. McFarland, William A. Wimsatt: Renal function and its relation to the ecology of the vampire bat, Desmodus rotundus. In: Comparative Biochemistry and Physiology, Band 28, Nr. 3, 1969, S. 985–1006.
- ↑ a b c d e f g h Patricia A. Wright: Nitrogen excretion: three end products, many physiological roles. In: Journal of Experimental Biology. Band 198, Nr. 2, 1995, S. 273–281.
- ↑ a b c M. Ramaswamy, T. Gopalakrishna Reddy: Ammonia and urea excretion in three species of air-breathing fish subjected to aerial exposure. In: Proceedings: Animal Sciences, Band 92, Nr. 4, 1983, S. 293–297.
- ↑ Marion R. Preest, Carol A. Beuchat: Ammonia excretion by hummingbirds. In: Nature. 386. Jahrgang, Nr. 6625, April 1997, S. 561–562, doi:10.1038/386561a0 (englisch).
- ↑ J. Cancino, J. Castilla: Emersion behaviour and foraging ecology of the common Chilean clingfish Sicyases sanguineus (Pisces: Gobiesocidae). In: Journal of Natural History, Band 22, 1988, S. 249–261.
- ↑ J. Davenport, M. D. J. Sayer: Ammonia and urea excretion in the amphibious teleost Blennius pholis (L.) in sea-water and in air. In: Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology, Band 84, Nr. 1, 1986, S. 189–194.
- ↑ Paul R. Ehrlich, David S. Dobkin, and Darryl Wheye: Drinking. In: Birds of Stanford. Stanford University, 1988, abgerufen am 13. Dezember 2007 (englisch).
- ↑ Ella Tsahar, C Martínez Del Rio, I Izhaki, Z Arad: Can birds be ammonotelic? Nitrogen balance and excretion in two frugivores. In: Journal of Experimental Biology. 208. Jahrgang, Nr. 6, 2005, S. 1025–34, doi:10.1242/jeb.01495, PMID 15767304 (englisch).
- ↑ E. Skadhauge, K. H. Erlwanger, S. D. Ruziwa, V. Dantzer, V. S. Elbrønd, J. P. Chamunorwa: Does the ostrich (Struthio camelus) coprodeum have the electrophysiological properties and microstructure of other birds? In: Comparative biochemistry and physiology. Part A, Molecular & integrative physiology. 134. Jahrgang, Nr. 4, 2003, S. 749–755, doi:10.1016/S1095-6433(03)00006-0, PMID 12814783 (englisch).
- ↑ Frank Gill: Ornithology. WH Freeman and Co, New York 1995, ISBN 0-7167-2415-4 (englisch).
- ↑ a b V. B. Wigglesworth: The physiology of excretion in a blood-sucking insect, Rhodnius prolixus (Hemiptera, Reduviidae) I. Composition of the urine. In: Journal of Experimental Biology. Band 8, Nr. 4, 1931, S. 411–427.
- ↑ Rudy M. Ortiz: Osmoregulation in marine mammals. In: Journal of Experimental Biology. Band 204, Nr. 11, 2001, S. 1831–1844.
- ↑ M. Kjeld: Salt and water balance of modern baleen whales: rate of urine production and food intake. In: Canadian journal of zoology. 81.4 (2003), S. 606–616. doi:10.1139/z03-041
- ↑ Marcia Chame: Terrestrial mammal feces: a morphometric summary and description. In: Memórias do Instituto Oswaldo Cruz. Band 98, 2003, S. 71–94, doi:10.1590/S0074-02762003000900014.
- ↑ D. W. Sims, P. L. R. Andrews: The emetic reflex in African walking catfish develops with age. In: Journal of Fish Biology. Band 48, Nr. 6, 1996, S. 1231–1237. doi:10.1111/j.1095-8649.1996.tb01817.x
- ↑ Kouichi Yamamoto u. a.: Differential activity of drugs to induce emesis and pica behavior in Suncus murinus (house musk shrew) and rats. In: Physiology & Behavior. Band 83, Nr. 1, 2004, S. 151–156.
- ↑ Raymond Pierotti, Cynthia A. Annett: Diet and reproductive output in seabirds. In: BioScience. 1990, S. 568–574.
- ↑ E. Bursell: The excretion of nitrogen in insects. In: Advances in Insect Physiology. Band 4, 1967, S. 33–67.
- ↑ C. Frank Consolazio u. a.: Excretion of sodium, potassium, magnesium and iron in human sweat and the relation of each to balance and requirements. In: The Journal of Nutrition. Band 79, Nr. 4, 1963, S. 407–415.
- ↑ C. Frank Consolazio u. a.: Relationship between calcium in sweat, calcium balance, and calcium requirements. In: The Journal of Nutrition. Band 78, Nr. 1, 1962, S. 78–88.
- ↑ Irving L. Schwartz, Jørn Hess Thaysen, Vincent P. Dole: Urea excretion in human sweat as a tracer for movement of water within the secreting gland. In: The Journal of Experimental Medicine. Band 97, Nr. 3, 1953, S. 429–437.
- ↑ T. B. Vree, A. T. Muskens, J. M. Van Rossum: Excretion of amphetamines in human sweat. In: Archives Internationales de Pharmacodynamie et de Thérapie. Band 199, Nr. 2, 1972, S. 311, PMID 5070646.
- ↑ Howard L. Johnson, Howard I. Maibach: Drug excretion in human eccrine sweat. In: Journal of Investigative Dermatology. Band 56, Nr. 3, 1971, S. 182–188.
- ↑ Josef Parnas u. a.: Excretion of antiepileptic drugs in sweat. In: Acta Neurologica Scandinavica. Band 58, Nr. 3, 1978, S. 197–204. doi:10.1111/j.1600-0404.1978.tb02879.x.
- ↑ Ehud Skutelsky, David Danon: An electron microscopic study of nuclear elimination from the late erythroblast. In: The Journal of Cell Biology. Band 33, Nr. 3, 1967, S. 625–635, doi:10.1083/jcb.33.3.625.
- ↑ Christian Sardet, Monique Pisam, Jean Maetz: The surface epithelium of teleostean fish gills. In: J Cell Biol. Band 80, 1979, S. 96–117. PMC 2110284 (freier Volltext)
- ↑ R. A. Rakitov: Secretory products of the Malpighian tubules of Cicadellidae (Hemiptera, Membracoidea): an ultrastructural study. In: International Journal of Insect Morphology and Embryology. Band 28, Nr. 3, 1999, S. 179–193.
- ↑ William M. Hart, Hiram E. Essex: Water metabolism of the chicken (Gallus domesticus) with special reference to the role of the cloaca. In: American Journal of Physiology. Band 136, Nr. 4, 1942, S. 657–668.
- ↑ David H. Thomas: Salt and water excretion by birds: the lower intestine as an integrator of renal and intestinal excretion. In: Comparative Biochemistry and Physiology. Part A: Physiology. Band 71, Nr. 4, 1982, S. 527–535.
- ↑ J. Mora, J. Martuscelli, J. Ortiz Pineda, G. Soberon: The regulation of urea-biosynthesis enzymes in vertebrates. In: Biochemical Journal. 96. Jahrgang, Nr. 1, 1965, S. 28–35, PMID 14343146, PMC 1206904 (freier Volltext) – (englisch, biochemj.org [PDF]).
- ↑ Gary C. Packard: The Influence of Ambient Temperature and Aridity on Modes of Reproduction and Excretion of Amniote Vertebrates. In: The American Naturalist. 100. Jahrgang, Nr. 916, 1966, S. 667–82, doi:10.1086/282459 (englisch).
- ↑ Paul Ottolenghi: The reversible delipidation of a solubilized sodium-plus-potassium ion-dependent adenosine triphosphatase from the salt gland of the spiny dogfish. In: Biochem. J. Band 151, 1975, S. 61–66.
- ↑ Knut Schmidt-Nielsen, Ragnar Fange: Salt glands in marine reptiles. ( vom 10. Juni 2013 im Internet Archive) (PDF; 661 kB) In: Nature. Band 182, Nr. 4638, 1958, S. 783–785.
- ↑ Henry D. Prange, Lewis Greenwald: Effects of dehydration on the urine concentration and salt gland secretion of the green sea turtle. In: Comparative Biochemistry and Physiology. Part A: Physiology. Band 66, Nr. 1, 1980, S. 133–136.
- ↑ William A.Dunson, Margaret K. Dunson: Interspecific differences in fluid concentration and secretion rate of sea snake salt glands. In: American Journal of Physiology-Legacy Content. Band 227, Nr. 2, 1974, S. 430–438.
- ↑ Ragnar Fänge, Knut Schmidt-Nielsen, Maryanne Robinson: Control of secretion from the avian salt gland. In: American Journal of Physiology--Legacy Content. Band 195, Nr. 2, 1958, S. 321–326.
- ↑ Knut Schmidt-Nielsen: The salt-secreting gland of marine birds. In: Circulation. Band 21, Nr. 5, 1960, S. 955–967.
- ↑ Stephen A. Ernst, Richard A. Ellis: The development of surface specialization in the secretory epithelium of the avian salt gland in response to osmotic stress. In: The Journal of Cell Biology. Band 40, Nr. 2, 1969, S. 305–321.
- ↑ W. W. Thomson, W. L. Berry, L. L. Liu: Localization and secretion of salt by the salt glands of Tamarix aphylla. In: Proceedings of the National Academy of Sciences. Band 63, Nr. 2, 1969, S. 310–317.
- ↑ Kenneth B. Marcum, Sharon J. Anderson, M. C. Engelke: Salt gland ion secretion: A salinity tolerance mechanism among five zoysiagrass species. ( vom 5. Juni 2018 im Internet Archive) In: Crop Science. Band 38, Nr. 3, 1998, S. 806–810.
- ↑ Tracey J. Rich, Jane L. Hurst: Scent marks as reliable signals of the competitive ability of mates. In: Animal Behaviour. Band 56, Nr. 3, 1998, S. 727–735.
- ↑ Roxana R. Zenuto, María Sol Fanjul: Olfactory discrimination of individual scents in the subterranean rodent Ctenomys talarum (tuco-tuco). In: Ethology. Band 108, Nr. 7, 2002, S. 629–641, doi:10.1046/j.1439-0310.2002.00808.x.
- ↑ S. Achiraman, G. Archunan: Urinary proteins and pheromonal communication in mammals. In: Indian Journal of Experimental Biology. Band 40, Nr. 9, 2002, S. 1077–1078.
- ↑ B. W. L. Brooksbank, R. Brown, J-A. Gustafsson: The detection of 5α-androst-16-en-3α-ol in human male axillary sweat. In: Experientia. Band 30, Nr. 8, 1974, S. 864–865.
- ↑ Heinz Ruppertshofen: Der summende Wald – Waldimkerei und Waldhygiene – Kombinierter Biologischer Waldschutz. Ehrenwirth, Stuttgart 1995, S. 160–230.
- ↑ Gerhard Liebig: Die Waldtracht – Entstehung – Beobachtung – Prognose. Eigenverlag, Stuttgart 1999.
- ↑ Peter B. Banks: Responses of Australian bush rats, Rattus fuscipes, to the odor of introduced Vulpes vulpes. In: Journal of Mammalogy. 1998, S. 1260–1264.
- ↑ Minna Koivula, Jussi Viitala: Rough-legged buzzards use vole scent marks to assess hunting areas. In: Journal of Avian Biology. 1999, S. 329–332.
- ↑ Frederic Klein: Parasiten: Der Fisch, der sich wie ein Vampir ernährt. In: Welt Online. 9. November 2007, abgerufen am 16. Februar 2017.
- ↑ Andrew Starrett: Adaptive resemblance: a unifying concept for mimicry and crypsis. In: Biological Journal of the Linnean Society. Band 48, Nr. 4, 1993, S. 299–317, doi:10.1111/j.1095-8312.1993.tb02093.x.
- ↑ Justin O. Schmidt (Hrsg.): Insect defenses: adaptive mechanisms and strategies of prey and predators. SUNY Press, 1990.
- ↑ Otto Westphal, Theodor Wieland, Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), insbesondere S. 9–35 (Geschichte der Hormonforschung), hier: S. 12 f. (Die Drüsen).
Auf dieser Seite verwendete Medien
Autor/Urheber:
- Lobo_marcando_su_territorio.jpg: Daniel Mott from Stockholm, Sweden
- derivative work: Aelykkoe (talk)
Lobo marcando su territorio mediante sus fluidos corporales. Zoo de Kolmården (Suecia).
Autor/Urheber: Ina96, Lizenz: CC BY-SA 3.0
Gestüber vom Birkhuhn (Lyrurus tetrix)
Autor/Urheber: see source ; colored by Lamiot, Lizenz: CC BY-SA 3.0
English: Recovery and coloring of the "Animal theoretical";
Legend: D, digestive system, R, respiratory system, E, excretory system, C, circulatory system, N, nervous system (from Figure 24 during zoology Paul Bert (1881)
3D vdW - Guanine
Ball-and-stick models of the two tautomers of creatinine
A nephron of the kidney. from Gray's Anatomy 1918. The illustration includes an important anatomical error in that it fails to depict the distal tubulus (tubulus rectus distalis) passing by vascular pole of the glomerulus before becoming the distal convoluted tubule (tubulus contortus distalis). The distal tubulus together with the afferent arteriole (arteriola afferens) and the extra glomerular mesangial cells together make up the juxtaglomerular apparatus. This occurs in all nephrons but was not known in 1918.
Autor/Urheber:
Das Fleckvieh, auch Simmentaler oder Simmentaler Fleckvieh genannt, ist eine Rinderrasse, die ursprünglich aus dem Schweizer Simmental stammt. Die Kuh ist beim Wasserlassen.
Autor/Urheber: Pogrebnoj-Alexandroff, Lizenz: CC BY 3.0
The feces of poison dyeing dart frog Dendrobates tinctorius on the plant.
Autor/Urheber: Jynto (talk), Lizenz: CC0
Space-filling model of the urea molecule, also known as carbamide, an important biological compound and industrial raw material.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
- Nitrogen, N: blue
Autor/Urheber: Gilles San Martin from Namur, Belgium, Lizenz: CC BY-SA 2.0
The ladybird Hippodamia undecimpustulata laying faeces
Space-filling model of the ammonia molecule, NH3
Autor/Urheber: Muhammad Mahdi Karim, Lizenz: GFDL
Feces of a lizard. The white cast is a collection of Uric acid and the black material are the feces. Birds, Insects and Saurian reptiles excrete uric acid together with their feces in form of paste as this allows more efficient water retention.
Autor/Urheber: böhringer friedrich, Lizenz: CC BY-SA 2.5
melkende Ameise Honigtau
Photo taken on the mangrove walk St Kilda, South Australia
Created by using ACD Chemsketch and Weblab Viewer Lite 4