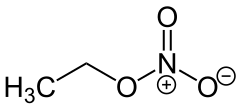
Ethylnitrat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ethylnitrat | |||||||||||||||
| Andere Namen | Salpetersäureethylester | |||||||||||||||
| Summenformel | C2H5NO3 | |||||||||||||||
| Kurzbeschreibung | farblose, angenehm riechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 91,07 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||
| Dichte | 1,11 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 88 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex | 1,3852 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | −190,4 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Ethylnitrat, der Salpetersäureester des Ethanols, ist eine durchsichtige hochexplosive Flüssigkeit mit angenehmem Geruch.
Natürliches Vorkommen
Nach Untersuchungen der University of East Anglia kommt Ethylnitrat neben der künstlichen Herstellung auch biogen vor. Ursprung sind mit hoher Wahrscheinlichkeit aquatische Bakterien.[5]
Darstellung
Ethylnitrat entsteht beim Einwirken konzentrierter, stickoxidfreier Salpetersäure auf Ethanol. Die Veresterungsreaktion verläuft mit einer molaren Reaktionsenthalpie von −25,9 kJ·mol−1 exotherm.[6] Um das entstandene Ethylnitrat zu isolieren, muss es vorsichtig abdestilliert werden. Die Herstellung von Ethylnitrat ist zwar bemerkenswert simpel und preiswert, aber gleichzeitig sehr gefährlich, da das Ethylnitrat zur Reinigung in den Gaszustand, in dem es hochexplosiv ist, überführt werden muss.
Um zu verhindern, dass durch eine Nebenreaktion eine Oxidation des Ethanols stattfindet, müssen auch kleinste Spuren Salpetriger Säure durch Zusatz von Harnstoffnitrat entfernt werden. Andernfalls kann es zu einer autokatalytisch verlaufenden Reaktion kommen, die explosionsartig verlaufen kann.
Eigenschaften
Ethylnitrat hat unter Normaldruck einen Siedepunkt von 88 °C und ist schwerer als Wasser. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 7,145, B = 1329 und C = 224,0 im Temperaturbereich von 0 °C bis 88 °C.[6] Die molare Verdampfungsenthalpie beträgt am Siedepunkt 33,9 kJ·mol−1, bei 25 °C 36,4 kJ·mol−1.[6] Mit Wasser wird ein bei 74,35 °C siedendes Azeotrop gebildet. Die Azeotropzusammensetzung ist dabei 22 % Wasser und 78 % Ethylnitrat.[7] Die Verbindung bildet leicht entzündliche Dampf-Luft-Gemische. Sie hat einen Flammpunkt von 10 °C. Die untere Explosionsgrenze (UEG) liegt bei 3,8 Vol.-% (140 g/m3).[8] Eine obere Explosionsgrenze (OEG) kann wegen des Selbstzerfalls der Verbindung nicht bestimmt werden. Die Dämpfe des Ethylnitrates sind, wie die des chemisch eng verwandten Methylnitrates, selbst unter Luftabschluss explosionsfähig, was in Verbindung mit der großen Flüchtigkeit der Stoffe hohe Gefahrenpotenziale birgt. Es ist ähnlich schlagempfindlich wie Nitroglycerin, ist diesem aber hinsichtlich der Sprengkraft unterlegen. Da es im Molekül nicht genügend Sauerstoffatome gibt, um die vorhandenen Kohlenstoff- und Wasserstoff-Atome vollständig zu oxidieren, besitzt es eine negative Sauerstoffbilanz. Daher enthalten die bei der Detonation entstehenden Schwaden brennbare Gase wie Wasserstoff und Kohlenmonoxid. Zur vollständigen Verbrennung muss Sauerstoff zugegeben werden:[6]
- .
Die molare Verbrennungsenthalpie beträgt −1355,8 kJ·mol−1.[6]
Explosionskenngrößen
Die Verbindung ist durch Schlag, Stoß, Reibung, Feuer und andere Zündquellen besonders explosionsgefährlich[9] und fällt im Umgang unter das Sprengstoffgesetz.[10] Wichtige Explosionskenngrößen sind:
Tabelle mit wichtigen explosionsrelevanten Eigenschaften: Sauerstoffbilanz −61,5 %[11] Stickstoffgehalt 15,24 %[11] Normalgasvolumen 1228 l·kg−1[11] Explosionswärme 4133 kJ·kg−1 (H2O (l))
3739 kJ·kg−1 (H2O (g))[11]Spezifische Energie 1108 kJ·kg−1 (113,0 mt·kg−1)[11] Bleiblockausbauchung 42,0 cm3·g−1[11] Detonationsgeschwindigkeit 5800 m·s−1[11]
Verwendung
Ethylnitrat findet nur geringe kommerzielle Verwendung, beispielsweise zur Erhöhung der Cetanzahl in Dieselkraftstoffen (ähnlich wie andere hierfür genutzte Alkylnitrate). In Reinform ist es schwächer und weniger handhabungssicher als Nitroglycerin. Allerdings wird es aufgrund der leichten Verfügbarkeit der Edukte häufig illegal hergestellt und von Terroristen eingesetzt. Wird es als Sprengstoff benutzt, so vermischt man es häufig mit brandfördernden Stoffen wie Ammoniumnitrat, um die Sauerstoffbilanz auszugleichen und die Sprengkraft des Stoffes optimal auszunutzen.
Siehe auch
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Ethylnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Dezember 2020. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-250.
- ↑ Eintrag zu Ethyl nitrate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ Antje Findeklee: Alkylnitrate natürlichen Ursprungs. spektrum.de, 23. August 2002.
- ↑ a b c d e P. Gray, M. W. T. Pratt, M. J. Larkin: The Latent Heat of Vaporisation and the Thermochemistry of Ethyl Nitrate. In: J. Chem. Soc. 1956, S. 210–212, doi:10.1039/JR9560000210.
- ↑ J. A. Dean (Hrsg.): Lange's Handbook of Chemistry. 15. Ed, McGraw-Hill, Inc. New York 1999, ISBN 0-07-016384-7.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Roth, L.; Weller, U.: Gefährliche Chemische Reaktionen, 65. Ergänzungslieferung, ecomed-Verlag 2011.
- ↑ Sprengstoffgesetz, Anhang I, Liste der explosionsgefährlichen Stoffe (BGBl. 1975 I S. 853), auf die das Gesetz in vollem Umfang anzuwenden ist.
- ↑ a b c d e f g J. Köhler, R. Meyer, und A. Homburg: Explosivstoffe, zehnte, vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, S. 123, ISBN 978-3-527-32009-7.
Auf dieser Seite verwendete Medien
Ethylnitrat Strukturformel
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for explosive substances


